Влияние температуры на скорость химической реакции. Правило Вант- Гоффа. Энергия активации молекул. Причины зависимости скорости реакции от температуры.
С повышением температуры скорость химической реакции, как правило, возрастает. В 1884 году Вант–Гофф установил, что при повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2–4 раза. Математически эта зависимость выражается соотношением:
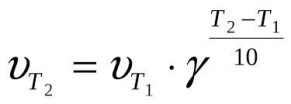
где: VT и kT - соответственно скорость и константа скорости реакции при температуре Т;
VТ + 10 и kТ + 10 – те же величины при температуре (Т + 10),
y = 2.4 – температурный коэффициент скорости реакции.
Следует отметить, что правило Вант–Гоффа можно использовать тогда, если реакция проводится при температуре, близкой к комнатной. С повышением температуры yуменьшается и для многих реакций при очень высоких температурах может стать даже меньше единицы, т.е. повышение температуры начинает вызывать не увеличение, а уменьшение скорости реакции.
Энергия активации
Энергия активации — один из основных параметров, который характеризует скорость химического взаимодействия. Энергия активации процесса зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше (при прочих равных условиях) скорость реакции. Энергия активации необходима в основном для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами, которое возникает при сближении молекул и атомов взаимодействующих веществ и мешает их столкновению.
То дополнительное количество энергии, которое надо добавить к средней энергии молекул исходных веществ, чтобы соударение между молекулами исходных веществ было активным, называется энергией активации (Еа).
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры.
Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса:
k=A*е–Ea/RT
где А – предэкспоненциальный множитель;
Еа – энергия активации,
R – универсальная газовая постоянная, равная 8,31 дж/моль–1К–1;
Т – абсолютная температура;
е –основание натуральных логарифмов.
Однако наблюдаемые константы скорости реакции, как правило, гораздо меньше, вычисленных по уравнению. Поэтому уравнение для константы скорости реакции видоизменяют следующим образом:
k=PZе –Ea/RT,
где Z – теоретическое число столкновений,
а Р – так называемый фактор вероятности или стерический, учитывает все влияния, вызывающие отклонения от идеального уравнения. Для реакции между двумя молекулами с достаточной энергией активации необходима их определенная взаимная ориентация при соударении. Этот фактор действует во многих случаях, особенно при реакциях между сложными молекулами. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция H2 + I2 = 2HI.
Реакция происходит при простом соударении молекулы водорода и молекулы йода с одновременным образованием двух молекул йодистого водорода.
Энергия активации этой реакции невелика, но скорость довольно мала. Это вызвано сравнительно жесткими геометрическими требованиями. Было действительно установлено, что соударения, имеют значительно меньше шансов привести к реакции. Соударения, при которых молекулы сталкиваются концами, еще менее продуктивны.
При сравнении уравнений следует, что A = PZ, т.е. А в уравнении Аррениуса характеризует число соударений с благоприятной ориентацией. Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
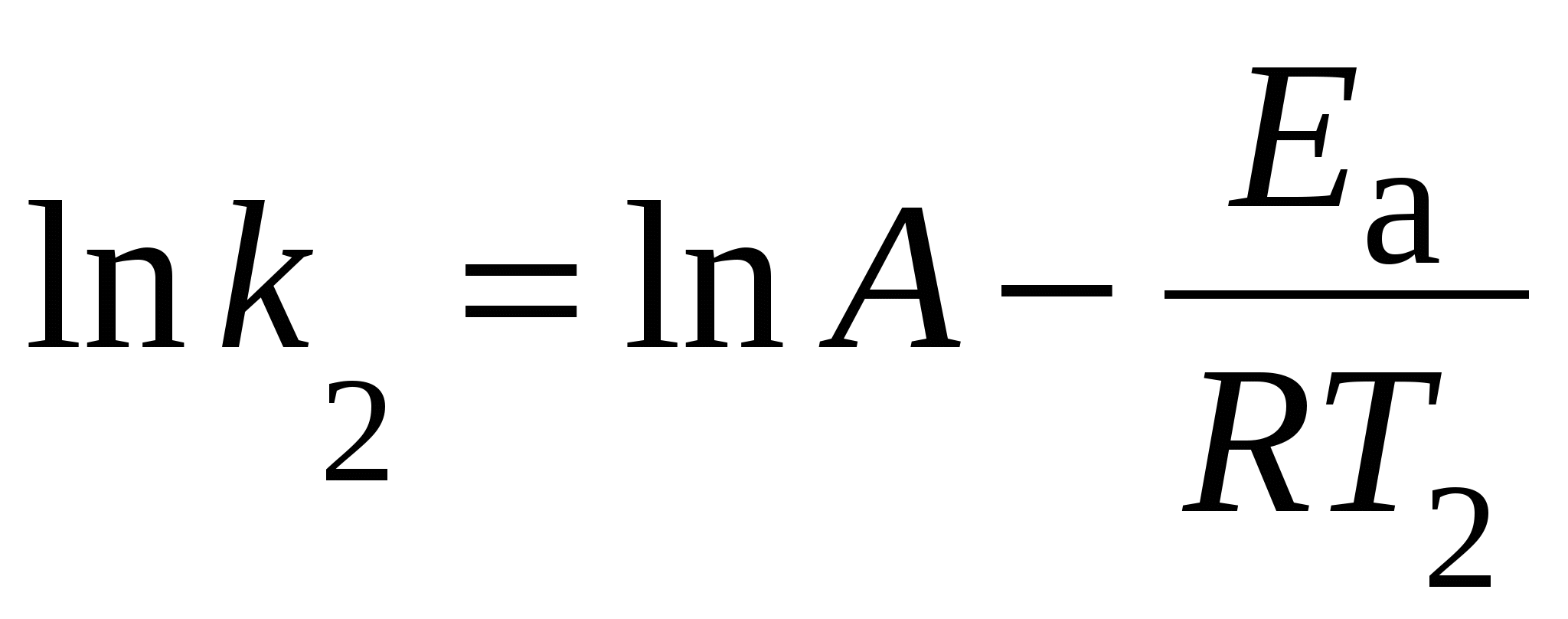
Энергия, необходимая для превращения реагирующих веществ в состояние переходного комплекса, называется энергией активации. Так как исходные молекулы еще не распались, а уже начали формироваться связи, характерные для молекул продуктов реакции, то, естественно, энергия перехода в активированное состояние (Еа) меньше энергии разрыва связей в молекулах исходных веществ: Ea < E диссоциации. Таким образом, образование переходного комплекса – процесс энергетически более выгодный, чем полный распад вступающих в реакцию молекул. Превращение активированного комплекса в продукты реакции всегда является процессом экзотермическим.
Основной постулат теории переходного состояния состоит в том, что исходные вещества всегда находятся в равновесии с переходным комплексами
При повышении температуры скорость химической реакции увеличивается.Т.К. увеличивается число активных частиц засчёт получения ими дополнительной энергии.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации.
В ходе химической реакции разрушаются одни и возникают другие молекулы и соединения, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые химические связи в ходе реакции сразу полностью разрушилась, то на это потребовалось бы большое количество энергии и реакция протекла крайне медленно. Как показали исследования, в ходе реакции система происходит через переходное состояние, через образование так называемого активированного комплекса.
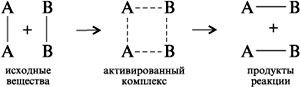
В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его невелико. При распаде комплекса образуется либо продукты реакции, либо исходные вещества. Для образования активированного комплекса необходима энергия. Система в переходном состоянии имеет более высокую энергию, чем в исходном и конечном состояниях.
Энергия, необходима для перехода вещества состояние активированного комплекса, называется энергия активации.
Возможность образования активированного комплекса, а соответственно и химического взаимодействия, определяется энергия молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. Таким образом, скорость реакции определяется числом столкновения, в которых принимают участие активные молекулы, кинетическая энергия которых выше предела, называемого энергией активации. Доля их в системе зависит от температуры.
 Как видно на рисунке с увеличение температуры растет доля молекул, энергия которых равна или выше энергии активации Ea, соответственно растет доля молекул, способных к активным столкновениями с образованием активированного комплекса, т.е. происходит ускорение реакции. Чем выше энергия активации, тем очевидно, меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации, и как иногда говорят, высокий энергетический барьер является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны. Так в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин, хотя изменение энергии Гиббса реакций окисления этих веществ ниже нуля.
Как видно на рисунке с увеличение температуры растет доля молекул, энергия которых равна или выше энергии активации Ea, соответственно растет доля молекул, способных к активным столкновениями с образованием активированного комплекса, т.е. происходит ускорение реакции. Чем выше энергия активации, тем очевидно, меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации, и как иногда говорят, высокий энергетический барьер является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны. Так в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин, хотя изменение энергии Гиббса реакций окисления этих веществ ниже нуля.
При высоких температурах доля активных частиц достаточно велика и реакции идут быстро. Раздел химии, изучающий реакции в низкотемпературной плазме, получил название плазмохимии. В то же время при очень низких температурах реакции протекают очень медленно. Для некоторых реакций обнаружено отклонение от закона Аррениуса в области сверхнизких температур, заключающееся в независимости скорости реакции от температуры в этих условиях. Скорость таких реакций при сверхнизких температурах выше по сравнению со скоростями реакций, рассчитанными по уравнению Аррениуса.
Область химии, изучающая химические реакции при сверхнизких температурах, называют криохимией.
Таким образом энергия активации – это энергия, необходимая для перехода частиц в состояние активированного комплекса. Частицы, энергия которых равна или выше энергии активации, называется активными. С ростом температуры растет доля этих частиц и соответственно скорость реакции. С увеличением уменьшается доля активных молекул и скорость реакций.
Причина сильной зависимости скорости реакции от температуры состоит в том, что увеличивается доля частиц, обладающих повышенной энергией, столкновение которых приводит к протеканию химической реакции. Поэтому скорости большинства химических реакций (экзо- и экзотермических, прямых, обратных, гомогенных, гетерогенных и т.д.) даже при незначительном увеличении температуры заметно возрастают. Повышение температуры на каждые 10 градусов скорость увеличивается в 2-4 раза.