Изменение энтальпии химических процессов. Закон Гесса.
Вопрос 18
Первый закон термодинамики — это закон сохранения энергии, распространенный на тепловые явления. Он формулируется следующим образом: количество теплоты Q, полученное системой, идет на изменение 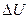 ее внутренней энергии и совершение работы
ее внутренней энергии и совершение работы 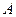 над внешними телами:
над внешними телами:
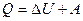 . (8.9)
. (8.9)
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения U своей внутренней энергии.
Применим первый закон термодинамики к изопроцессам в идеальных одноатомных газах.
1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно:
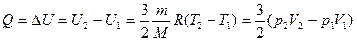 . (8.10)
. (8.10)
Здесь U1 и U2 – внутренние энергии газа в начальном и конечном состояниях. При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Обращаем внимание, что количество теплоты можно рассчитывать либо через изменение температуры, либо через значения давления и объема в начальном и конечном состоянии газа.
2. В изобарном процессе (p = const) газ совершает работу, меняется его температура, а значит, и внутренняя энергия. Следовательно:
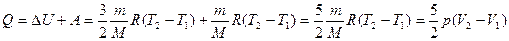 . (8.11)
. (8.11)
При изобарном расширении температура увеличивается, внутренняя энергия увеличивается, U > 0; газ совершает положительную работу, A > 0; Q > 0 – тепло поглощается газом При изобарном сжатии температура уменьшается, внутренняя энергия уменьшается, U > 0; газ совершает отрицательную работу, A < 0; Q < 0 – тепло отдается внешним телам.
Обращаем внимание, что количество теплоты можно рассчитывать либо через изменение температуры, либо через изменение объема при известном давлении газа.
3 .В изотермическом процессе температура газа не изменяется, а значит, не изменяется и внутренняя энергия газа, U = 0. Следовательно:
 . (8.12)
. (8.12)
Здесь T – температура изотермического процесса; V1 p1 и V2 p2 – объем и давление в начальном и конечном состоянии газа. Формула (8.12) получена путем расчета работы, как площади криволинейной трапеции на диаграмме ( p V) для изотермического процесса.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Такие процессы называются адиабатическими.
4. В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид:
 или
или  . (8.13)
. (8.13)
 При адиабатическом расширении работа газа положительна A > 0, температура газа уменьшается Т2 < Т1,внутренняя энергия газа уменьшается,т. е. газ совершает работу за счет убыли его внутренней энергии.
При адиабатическом расширении работа газа положительна A > 0, температура газа уменьшается Т2 < Т1,внутренняя энергия газа уменьшается,т. е. газ совершает работу за счет убыли его внутренней энергии.
При адиабатическом сжатии работа газа отрицательна A < 0, температура газа увеличивается Т2> Т1, внутренняя энергия газа увеличивается,т. е. положительная работа внешних сил, действующих на газ, идет на увеличение внутренней энергии газа.
На диаграмме (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении температура газа уменьшается. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом (рис. 8.4).
Изменение энтальпии химических процессов. Закон Гесса.
Термохимия изучает тепловые эффекты химических процессов. Химические реакции сопровождаются выделением или поглощением энергии в виде теплоты. Уравнения реакций, в которых учитываются их тепловые эффекты, называют термохимическими. В этих уравнениях выделение теплоты обозначают знаком (+), а поглощение (-).
В термодинамике принята обратная система знаков, и выделение теплоты обозначают знаком (-), а поглощение знаком (+). Агрегатные состояния веществ (К – кристалл, Ж – жидкость, Г – газ) обозначаются буквами у химических символов реагентов.
Основными понятиями термохимии являются теплота образования, теплота разложения, теплота сгорания.
Теплотой образования соединения называется количество выделяемой или поглощаемой теплоты при образовании одного моля соединения из простых веществ.
Теплотой разложения соединения называется количество теплоты, которое поглощается или выделяется при разложении одного моля соединения на простые вещества.
Теплотой сгорания соединения называется количество теплоты, которое выделяется при сгорании вещества количеством вещества один моль.
В качестве стандартных условий в термодинамике принимается температура 25  (298 К) и давление 1,013 ×
(298 К) и давление 1,013 ×  Па. Теплоты образования в этих условиях называют стандартными, для многих веществ они приводятся в таблицах справочной литературы.
Па. Теплоты образования в этих условиях называют стандартными, для многих веществ они приводятся в таблицах справочной литературы.
Основным законом термохимии является закон Гесса (1840): тепловой эффект (энтальпия) химических реакций, протекающих при постоянном объеме или при постоянном давлении, не зависит от числа промежуточных стадий и определяется только по начальным и конечным состояниям системы.
Следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпии) образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов перед формулами этих веществ в управлении реакции.
Тепловые эффекты химических реакций связаны с изменением внутренней энергии системы при переходе от исходных веществ к продуктам реакции. Теплота Q, поглощаемая системой, идет на изменение ее внутренней энергии  U и на совершение работы A.
U и на совершение работы A.
Q=  U+A
U+A
Внутренняя энергия является функцией состояния, т.е. ее изменение определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс.
 U=
U=  -
- 
Работа, которую совершает химическая система против внешних сил, равна произведению давления Р на изменение объема =  V системы:
V системы:
A=P(  -
-  )=P
)=P  V
V
При изохорном процессе А=0, т.е. изменения объема системы не происходит. Тогда Q=  -
-  =
=  U.
U.
Для изобарического процесса тепловой эффект равен  =
=  U+ P
U+ P  V, где
V, где  V - изменение объема системы.
V - изменение объема системы.
 V=
V=  -
- 
Тогда  =(
=(  -
-  )+P(
)+P(  -
-  )
)
 =(
=(  +
+  )-P(
)-P(  +
+  )
)
Введем обозначение U+PV=H
Тогда  =
=  -
-  =
=  H
H
Величина H называется энтальпией (теплосодержанием).
Таким образом, для реакции аА+bB+…=dD+eE…
Тепловой эффект изохорного процесса
 =
=  U=
U=  -
- 
Изобарного процесса
 =
=  H=
H=  -
- 
Энтальпия, как и внутренняя энергия, аддитивная величина, которая не зависит от промежуточных стадий реакции и определятся только начальным и конечным состоянием системы:
 =
=  -
- 
где  – энтальпия образования соединения из простых веществ при температуре 298
– энтальпия образования соединения из простых веществ при температуре 298  K.
K.