Химические свойства оксидов
ОКСИДЫ
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
| Формула | Название | Формула | Название |
| CO | оксид углерода ( II ) | Fe2O3 | оксид железа (III ) |
| NO | оксид азота ( II ) | CrO3 | оксид хрома (VI ) |
| Al2O3 | оксид алюминия | ZnO | оксид цинка |
| N2O5 | оксид азота (V ) | Mn2O7 | оксид марганца (VII ) |
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
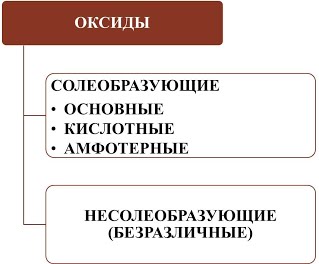
| Оксиды металлов МехОу | Оксиды неметалловнеМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды– это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII)):

3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например,N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II - основный);
Cr 2O3 (III - амфотерный);
CrO3 (VII - кислотный).
Химические свойства оксидов
| ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 2. Основной оксид + Кислота = Соль + Н2О (р. обмена) 3K2O + 2H3PO4 = 2K3PO4 + 3H2O 3. Основной оксид + Вода = Щёлочь (р. соединения) Na2O + H2O = 2NaOH |
| ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид + Вода = Кислота (р. соединения) СO2 + H2O = H2CO3, SiO2 – не реагирует 2. Кислотный оксид + Основание = Соль + Н2О (р. обмена) P2O5 + 6KOH = 2K3PO4 + 3H2O 3. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 4. Менее летучие вытесняют более летучие из их солей CaCO3 + SiO2 = CaSiO3 +CO2 |
| ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ Взаимодействуют как с кислотами, так и со щелочами. ZnO + 2 HCl = ZnCl2 + H2O ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] ( в растворе) ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении) |
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
SO3 + H2O = H2SO4
CaO + H2O = Ca(OH)2
В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
Оснóвные гидроксиды содержат гидроксогруппы ОН, способные замещаться на кислотные остатки. Примеры:
NaOH - гидроксид натрия, LiOH - гидроксид лития, Ba(OH)2 - гидроксид бария,
Cu(OH)2 - гидроксид меди(II), La(OH)3 - гидроксид лантана(III).
Реакция нейтрализации
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция нейтрализации, или солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Гидроксиды (гидроокиси, водокиси) — неорганические соединения, содержащие в составе гидроксильную группу -OH. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных и щёлочноземельных металлов, таллия, а также аммония являются растворимыми и их называют щелочами.
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
· основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.) При реакциях и диссоциации отщепляется группа -OH.
· кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4, сернистая кислота H2SO3 и др.) При реакциях и диссоциации отщепляется протон.
· амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинка Zn(ОН)2).
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам. Также иногда называют гидроксидом воду.
Химические свойства[править | править вики-текст]
Основные гидроксиды[править | править вики-текст]
Оксиды щелочных и некоторых щëлочноземельных металлов взаимодействуют с водой, образуя щëлочи:
{\displaystyle {\mathsf {Na_{2}O+H_{2}O\rightarrow 2NaOH}}} 
{\displaystyle {\mathsf {CaO+H_{2}O\rightarrow Ca(OH)_{2}}}} 
Нерастворимые основания при нагревании, как правило, разлагаются на оксид и воду, например:
{\displaystyle {\mathsf {2Fe(OH)_{3}\rightarrow Fe_{2}O_{3}+3H_{2}O}}} 
{\displaystyle {\mathsf {Cu(OH)_{2}\rightarrow CuO+H_{2}O}}} 
Кислотные гидроксиды[править | править вики-текст]
При взаимодействии оксида неметалла с водой образуется кислородсодержащая кислота:
{\displaystyle {\mathsf {SO_{3}+H_{2}O\rightarrow H_{2}SO_{4}}}} 
15. Водород (лат. Hydrogenium), H, химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,0079. При обычных условиях Водород - газ; не имеет цвета, запаха и вкуса.
Историческая справка. В трудах химиков 16 и 17 веков неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 году Г. Кавендиш собрал и исследовал выделяющийся газ, назвав его "горючий воздух". Будучи сторонником теории флогистона, Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 году А. Лавуазье путем анализа и синтеза воды доказал сложность ее состава, а в 1787 определил "горючий воздух" как новый химический элемент (Водород) и дал ему современное название hydrogene (от греч. hydor - вода и gennao - рождаю), что означает "рождающий воду"; этот корень употребляется в названиях соединений Водорода и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование "Водород" было предложено М. Ф. Соловьевым в 1824 году.
Распространение Водорода в природе. Водород широко распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. Водород входит в состав самого распространенного вещества на Земле - воды (11,19% Водорода по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (то есть в состав белков, нуклеиновых кислот, жиров, углеводов и других). В свободном состоянии Водород встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют в атмосфере. В околоземном пространстве Водород в виде потока протонов образует внутренний ("протонный") радиационный пояс Земли. В космосе Водород является самым распространенным элементом. В виде плазмы он составляет около половины массы Солнца и большинства звезд, основную часть газов межзвездной среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и в кометах в виде свободного Н2, метана СН4, аммиака NH3, воды Н2О, радикалов типа CH, NH, OH, SiH, PH и т. д. В виде потока протонов Водород входит в состав корпускулярного излучения Солнца и космических лучей.
Изотопы, атом и молекула Водорода. Обыкновенный Водород состоит из смеси 2 устойчивых изотопов: легкого Водорода, или протия (1H), и тяжелого Водорода, или дейтерия (2Н, или D). В природных соединениях Водорода на 1 атом 2Н приходится в среднем 6800 атомов 1Н. Радиоактивный изотоп с массовым числом 3 называют сверхтяжелым Водородом, или тритием (3Н, или Т), с мягким -излучением и периодом полураспада T½ = 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере его ничтожно мало (4·10-15% от общего числа атомов Водорода). Получен крайне неустойчивый изотоп 4Н. Массовые числа изотопов 1Н, 2Н, 3Н и 4Н, соответственно 1, 2, 3 и 4, указывают на то, что ядро атома протия содержит только один протон, дейтерия - один протон и один нейтрон, трития - один протон и 2 нейтрона, 4Н - один протон и 3 нейтрона. Большое различие масс изотопов Водорода обусловливает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов.
Атом Водорода имеет наиболее простое строение среди атомов всех других элементов: он состоит из ядра и одного электрона. Энергия связи электрона с ядром (потенциал ионизации) составляет 13,595 эв. Нейтральный атом Водород может присоединять и второй электрон, образуя отрицательный ион Н- при этом энергия связи второго электрона с нейтральным атомом (сродство к электрону) составляет 0,78 эв. Квантовая механика позволяет рассчитать все возможные энергетические уровни атома Водород, а следовательно, дать полную интерпретацию его атомного спектра. Атом Водорода используется как модельный в квантовомеханических расчетах энергетических уровней других, более сложных атомов.
Молекула Водород Н2 состоит из двух атомов, соединенных ковалентной химической связью. Энергия диссоциации (то есть распада на атомы) составляет 4,776 эв. Межатомное расстояние при равновесном положении ядер равно 0,7414Å. При высоких температурах молекулярный Водород диссоциирует на атомы (степень диссоциации при 2000°С 0,0013, при 5000°С 0,95). Атомарный Водород образуется также в различных химических реакциях (например, действием Zn на соляную кислоту). Однако существование Водорода в атомарном состоянии длится лишь короткое время, атомы рекомбинируют в молекулы Н2.
Физические свойства Водорода. Водород - легчайшее из всех известных веществ (в 14,4 раза легче воздуха), плотность 0,0899 г/л при 0°С и 1 атм. Водород кипит (сжижается) и плавится (затвердевает) соответственно при -252,8°С и -259,1°С (только гелий имеет более низкие температуры плавления и кипения). Критическая температура Водорода очень низка (-240°С), поэтому его сжижение сопряжено с большими трудностями; критическое давление 12,8 кгс/см2 (12,8 атм), критическая плотность 0,0312 г/см3. Из всех газов Водород обладает наибольшей теплопроводностью, равной при 0°С и 1 атм 0,174 вт/(м·К), то есть 4,16·10-4 кал/(с·см·°С). Удельная теплоемкость Водорода при 0°С и 1 атм Сp 14,208 кДж/(кг·К), то есть 3,394 кал/(г·°С). Водород мало растворим в воде (0,0182 мл/г при 20°С и 1 атм), но хорошо - во многих металлах (Ni, Pt, Pa и других), особенно в палладии (850 объемов на 1 объем Pd). С растворимостью Водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия Водорода с углеродом (так называемая декарбонизация). Жидкий Водород очень легок (плотность при -253°С 0,0708 г/см3) и текуч (вязкость при -253°С 13,8 спуаз).
Химические свойства Водорода. В большинстве соединений Водород проявляет валентность (точнее, степень окисления) +1, подобно натрию и другим щелочным металлам; обычно он и рассматривается как аналог этих металлов, возглавляющий I группу системы Менделеева. Однако в гидридах металлов ион Водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na+H- построен подобно хлориду Na+Cl-. Этот и некоторые других факты (близость физических свойств Водорода и галогенов, способность галогенов замещать Водород в органических соединениях) дают основание относить Водород также и к VII группе периодической системы. При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Атомарный Водород обладает повышенной химические активностью по сравнению с молекулярным. С кислородом Водород образует воду:
Н2 + 1/2О2 = Н2О
с выделением 285,937 кДж/моль, то есть 68,3174 ккал/моль тепла (при 25°С и 1 атм). При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом. Пределы взрывоопасности водородо-кислородной смеси составляют (по объему) от 4 до 94% Н2, а водородо-воздушной смеси - от 4 до 74% Н2 (смесь 2 объемов Н2 и 1 объема О2называется гремучим газом). Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe + 4Н2О, и т. д.
С галогенами Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl.
При этом с фтором Водород взрывается (даже в темноте и при - 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с иодом только при нагревании. С азотом Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и давлениях. При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром. С чистым углеродом Водород может реагировать без катализатора только при высоких температуpax:
2Н2 + С (аморфный) = СН4 (метан).
Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя гидриды:
Н2 + 2Li = 2LiH.
Важное практическое значение имеют реакции Водорода с оксидом углерода (II), при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например НСНО, СН3ОН и другие. Ненасыщенные углеводороды реагируют с Водородом, переходя в насыщенные, например:
СnН2n + Н2 = СnН2n+2.
Роль Водород и его соединений в химии исключительно велика. Водород обусловливает кислотные свойства так называемых протонных кислот. Водород склонен образовывать с некоторыми элементами так называемую водородную связь, оказывающую определяющее влияние на свойства многих органических и неорганических соединений.
Получение Водорода. Основные виды сырья для промышленного получения Водорода - газы природные горючие, коксовый газ и газы нефтепереработки. Водород получают также из воды электролизом (в местах с дешевой электроэнергией). Важнейшими способами производства Водорода из природного газа являются каталитическое взаимодействие углеводородов, главным образом метана, с водяным паром (конверсия):
СН4 + H2О = СО + ЗН2,
и неполное окисление углеводородов кислородом:
СН4 + 1/2О2 = СО + 2Н2
Образующийся оксид углерода (II) также подвергается конверсии:
СО + Н2О = СО2 + Н2.
Водород, добываемый из природного газа, самый дешевый.
Из коксового газа и газов нефтепереработки Водород выделяют путем удаления остальных компонентов газовой смеси, сжижаемых более легко, чем Водород, при глубоком охлаждении. Электролиз воды ведут постоянным током, пропуская его через раствор КОН или NaOH (кислоты не используются во избежание коррозии стальной аппаратуры). В лабораториях Водород получают электролизом воды, а также по реакции между цинком и соляной кислотой. Однако чаще используют готовый заводской Водород в баллонах.
Применение Водорода. В промышленном масштабе Водород стали получать в конце 18 века для наполнения воздушных шаров. В настоящее время Водород широко применяют в химической промышленности, главным образом для производства аммиака. Крупным потребителем Водорода является также производство метилового и других спиртов, синтетического бензина и других продуктов, получаемых синтезом из Водорода и оксида углерода (II). Водород применяют для гидрогенизации твердого и тяжелого жидкого топлив, жиров и других, для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы Водорода - дейтерий и тритий.