Укажите отличия скрининга «направленного» от «ненаправленного», описание стадий.
Билет 28
1. MgSO4*7H2O Магния сульфат. Magnesii sulfas
Магния сульфат относится к седативным лекарственным средствам. При парантеральном введении в зависимости от дозы, может наблюдаться седативный, снотворный или наркотический эффект. При пероральном применении магния сульфат оказывает послабляющее и желчегонное действие. При внутривенном введении 20-25% растворов – седативное, противосудорожное, спазмолитическое действие.
2. Магния сульфат – бесцветные призматические выветривающиеся кристаллы, легко растворим в воде и практическим нерастворим в этаноле.
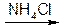 3. Подлинность магния сульфата можно подтвердить по образованию нерастворимого в воде, но растворимого в уксусной кислоте осадка фосфата магния-аммония (белый):
3. Подлинность магния сульфата можно подтвердить по образованию нерастворимого в воде, но растворимого в уксусной кислоте осадка фосфата магния-аммония (белый):
MgSO4 + Na2HPO4 + NH4OH NH4MgPO4 + Na2SO4 + H2O
NH4MgPO4 + 2CH3COOH Mg(CH3COO)2 + NH4H2PO4
Наличие сульфат-иона обнаруживают по реакции с раствором бария хлорида, наблюдая образование белого осадка сульфата бария: MgSO4 + BaCl2 BaSO4 + MgCl2
4. Количественное определение магния сульфата проводят прямым комплексонометрическим титрованием в среде аммиачного буферного раствора (индикатор – кислотный хром-черный). Титрант 0,05 М раствор трилона Б до синего окрашивания раствора.
В. 2 Основным руководящим документом по созданию асептических условий являются правила GMP Всемирной организации здравоохранения, стран ЕЭС, правила GMP Белоруссии и стран СНГ. В них устанавливаются 4 класса чистоты производственных помещений. Ранее таким документом был документ РДП 64-3-80 «Требования к помещениям для производства лекарственных средств в асептических условиях». В асептических условиях должны изготавливаться инъекционные, глазные, детские ЛФ, ЛФ с антибиотиками, ЛС, вводимые в полости тела (внутреннее ухо, мочевой пузырь, матку). Требования, предъявляемые к инъекционнымлекарственным формам:
1. Стерильность - отсутствие жизнеспособных микроорганизмов и их спор.
2. Апирогенность - отсутствие продуктов жизнедеятельности и распада микроорганизмов.
3. Стабильность - неизменяемость по составу и количеству находящихся в р-ре ЛВ в течение установленных сроков хранения
4. Отсутствие механических включении - прозрачность инъекц. р-ра (или отсутствие каких-либо взвешенных частиц)
Обеспечить эти требования должен весь технологический процесс (помещения, технологическое оборудование, упаковка, система вентиляции, транспортные системыввода сырья ивывода готового продукта, обслуживающий персонал).
Большая часть инъекционных препаратов является ЛФ промышленного производства (ампулы, флаконы, шприц-тюбики).
В аптеках готовят растворы для инъекций, которые отпускают в герметично укупоренных флаконах вместимостью 5—1000 мл. На флаконы наклеиваются этикетки «Стерильно».
Технология инъекционных препаратов — сложный многостадийный процесс, состоящий из основных и вспомогательных этапов. Условия изготовления ЛФ д/ин д. б. асептическими, т. е. исключающими попадание в готовый продукт микроорганизмов и механических частиц. Только после определения способов стерилизации для различных инъекционных лекарственных форм стало возможно их практическое применение.
2 способа заполнения ампул: 1 – вакуумный, включая пароконденсационый, 2 – шприцевой.
Вакуумный. Кассету с амп. ставят в аппарат, создают вакуум до определенной меры, отключают вакуум и впускают ч/з фильтр чистый стерильный воздух, который вдавливает р-р внутрь амп. (аппарат АП-4М2)
Пароконденсационный. Воздух заменяется водяным паром, кототрый, конденсируясь, создаёт вакуум в амп., снимаемый водяным паром, когда капилляры опущены в р-р ЛС. Затем амп. переворачивают и удаляют жидкость из капилляра двумя путями: 1) в аппарате создают вакуум и р-р отсасывается из капилляра наружу; 2) В аппарат подают сжатый воздух под давлением. Жидкость из капилляра вдавливается внутрь. Полностью удалить р-р не удаётся. При запайке органические в-ва сгорают, образуя чёрные пятна. Чтобы избежать последнего производят обмыв капилляров: а) капилляры обрабатывают потоком пара, который конденсируется на стебельке и омывает капилляр; б) смывание р-ров с помощью пульверизатора. Стерильная вода подаётся под давлением ч/з пульверизатор. При вакуумном заполнении в кассетах из-за больших колебаний V в амп., в части амп. кол-во р-ров оказывается выше нормы, что приводит к перерасходу препаратов. Необходимы и допонительные операции (освобождение капилляра от жидкости, ополаскивание).
Шприцевой метод. Менее производителен. В амп. вводится полая игла, ч/з которую подаётся нужный V р-ра. Для ускорения заполнения амп. могут использоваться дозированные приспособления, используют бюретки с тонким капилляром-иглой шприца.В настоящее время есть аппараты для автоматического наполнения шприцевым методом. Используются полуавтоматы линейного, карусельного типа.
Выработаны специальные условия выполнения стадий и операций технологического процесса для соответствия готового раствора требуемым стандартам.
Повышенные требования предъявляются к следующим объектам: 1) производственным помещениям; 2) технологическому оборудованию; 3) системам подготовки основных и вспомогательных материалов; 4) вентиляции; 5) обслуживающему персоналу.
На каждой из стадий производственного процесса существует угроза микробной контаминации и внесения в раствор загрязнений иного рода. Технология ампулированных препаратов: 1) получение ампул (флаконов);2) подготовка тары, ампул, фл, укупорочного материала и персонала; 3) получение и подготовка растворителя; 4) подготовка помещений; 5) подготовка фильтров; 6) растворение ЛВ, стабилизаторов, консервантов; 7) фильтрование р-ров; 8) наполнение ампул, фл; 9) запайка, укупорка; 10) стерилизация; 11) проверка герметичности ампул, фл; 12) контроль качества; 13) этикетирование; 14) упаковка, маркировка.
Инъекционные растворы должны отвечать требованиям нормативной документации по разделам: описание, подлинность, прозрачность, цветность, объем заполнения, механические включения, рН, стерильность, токсичность, пирогенность, количественное определение.
В. 3 Производящее растение: розмарин лекарственный – Rosmarinus officinalis; Лекарственное сырье: листья розмарина – Folia Rosmarini; Сем. Яснотковые – Lamiaceae
Культивируемое растение. Преимущественно субтропические и тропические районы.
Химический состав: алкалоиды: розмарицин; урсоловая и розмариновая кислоты; дубильные вещества; горечи; смолы; эфирное масло: -пинен, камфен, цинеол, борнеол, L-камфора, кариофиллен, борнилацетат
Эфирные масла представляют собой смеси душистых веществ, относящихся к различным классам органических соединений, преимущественно к терпеноидам, реже ароматическим или алифатическим соединениям. Эфирные масла получают обычно из растительного сырья путем дистилляции с водой или водяным паром, а также экстракцией органическими растворителями, прессованием и другими способами.
Количественное определение эфирного масла в ЛРС:
Определение содержания эфирного масла в лекарственном растительном сырье
Определение содержания эфирного масла проводят путем его перегонки с водяным паром из растительного сырья с последующим измерением объема. Содержание масла выражают в объемно-весовых процентах в пересчете на абсолютно сухое сырье.
Навеску измельченного сырья помещают в широкогорлую круглодонную или плоскодонную колбу А вместимостью 1000 мл, приливают 300 мл воды и закрывают резиновой пробкой Б с обратным шариковым холодильником В. В пробке снизу укрепляют металлические крючки, на которые при помощи тонкой проволоки подвешивают градуированный приемник Г так, чтобы конец холодильника находился над воронкообразным расширением приемника, не касаясь его. Приемник должен свободно помещаться в горле колбы, не касаясь стенок, и отстоять от уровня воды не менее чем на 50 мм. Цена деления градуированной части приемника 0,025 мл.
Колбу с содержимым нагревают и кипятят в течение времени, указанного в соответствующей нормативной документации на лекарственное растительное сырье.

Объем масла в градуированной части приемника замеряют после окончания перегонки и охлаждения прибора до комнатной температуры.
Условия хранения:
В сухом, хорошо вентилируемом помещении, в плотно укупоренной таре; в аптеках – стеклянной, металлической таре, в ящиках с крышкой; на складах – в тюках или закрытых ящиках на стеллажах.
Резанное сырье – в тканевых мешках, порошки – в двойных мешках: внутренний – бумажный, многослойный, наружный – тканевый, или картонных упаковках.
Пути использования:
¾ получение индивидуальных веществ
¾ получение эфирного масла
¾ получение галеновых и новогаленовых препаратов
Фармакологическая группа:Тонизирующее средство. Эфирное масло – в парфюмерно-косметической промышленности.
Препараты:«Канефрон Н»
Укажите отличия скрининга «направленного» от «ненаправленного», описание стадий.
Понятие скрининга - процесс поиска и отбора микроорганизмов продуцентов антибиотиков с предварительной общей характеристикой образуемых ими антибиотиков. При скрининге обычно изучаются почвенные грибы, актиномицеты и бактерии. Ненаправленный скрининг (первичный) - это процесс выделения из природных источников микроорганизмов продуцентов и отбор наиболее активных среди них по способности продуцировать (производить) антибиотики или другие биологически активные вещества. Направленный скрининг - это поиск и отбор продуцентов антибиотиков определенного химического строения или с определенным типом механизма антагонистического действия. Схема выделения: приготовление стерильных питательных сред (посевные и ферментационные), приготовление почвенной суспензии и посев на среду с агаром, выделение микроорганизмов продуцентов антибиотиков в виде чистых культур - штаммов, хранение штаммов и оценка их способности продуцировать антибиотики в процессе хранений.
В. 5 Инвентаризация-прием, используемый для выявления фактического состояния имущества и финансовых обязательств организации и его сопоставления с данными бухгалтерского учета.
Исходя из действующих НД организации, но находящегося на его территории; определение фактического количества использованных товарно-материальных ценностей в процессе торговой деятельности; сопоставление фактических данных с данными бухгалтерского учета; проверка правильности оценки имущества и обязательств с учетом рыночной стоимости.
В соответствии с «Положением по ведению бухгалтерского учета и отчетности в РФ» проведение инвентаризации обязательно:
• при передаче имущества организации в аренду, выкупе, продаже, а также в случаях, предусмотренных законодательством при преобразовании государственного или муниципального унитарного предприятия;
• перед составлением годовой бухгалтерской отчетности, кроме имущества, инвентаризация которого проводилась не ранее 1 октября отчетного года. Инвентаризация основных средств может проводиться 1 раз в 3 года. В районах, расположенных на Крайнем Севере, и приравненных к ним местностях инвентаризация товаров, сырья и материалов проводят в период их наименьших остатков;
• при смене материально-ответственных лиц (на день приемки-передачи дел);
• при установлении фактов хищений или злоупотреблений, а также порчи ценностей;
• в случаях стихийных бедствий, пожара, аварий или других чрезвычайных ситуаций, вызванных экстремальными условиями;
• при ликвидации (реорганизации) предприятия перед составлением ликвидационного (разделительного) баланса и в других случаях, предусматриваемых законодательством РФ или нормативными актами Министерства финансов РФ;
• при коллективной (бригадной) материальной ответственности инвентаризация проводится при смене руководителя коллектива (бригады), выбытии из коллектива (бригады) более 50 % его членов, по требованию одного или нескольких членов коллектива (бригады).
Количество инвентаризаций в отчетном году, дата их проведения, перечень имущества и финансовых обязательств, проверяемых при каждой из них, устанавливаются руководителем фармацевтической организации самостоятельно (кроме случаев, требующих обязательного проведения инвентаризации).
Для проведения инвентаризации в организации создается постоянно действующая инвентаризационная комиссия, персональный состав которой утверждает руководитель.
Документ о составе комиссии (приказ, постановление или распоряжение) регистрируют в журнале контроля за выполнением приказов о проведении инвентаризации.
В состав инвентаризационной комиссии включаются представители администрации фармацевтической организации, работники бухгалтерии, другие работники.
В число подготовительных мероприятий при проведении инвентаризации, помимо формирования состава комиссии включают издание Приказа по форме № ИНВ-22 «О проведении инвентаризации»; определение сроков проведения инвентаризации и видов проверяемого имущества; разработку внутренних инструкций - памяток. До начала проверки фактического наличия имущества инвентаризационной комиссии надлежит получить последние на момент инвентаризации приходные и расходные документы или отчеты о движении материальных ценностей и денежных средств. Председатель инвентаризационной комиссии визирует все приходные и расходные документы, приложенные к реестрам (отчетам), с указанием «до инвентаризации на "..." (дата)», что должно служить бухгалтерии основанием для определения остатков имущества к началу инвентаризации по учетным данным. Материально ответственные лица дают расписки о том, что к началу инвентаризации все расходные и приходные документы на имущество сданы в бухгалтерию или переданы комиссии и все ценности, поступившие на их ответственность, оприходованы, а выбывшие списаны в расход. Аналогичные расписки дают и лица, имеющие подотчетные суммы на приобретение или доверенности на получение имущества.
Фактическое наличие имущества при инвентаризации определяют путем обязательного подсчета, взвешивания, обмера. Сведения о фактическом наличии имущества и реальности учтенных финансовых обязательств записывают в инвентаризационные описи или акты инвентаризации не менее чем в 2 экземплярах. Категорически запрещается вносить в описи данные об остатках ценностей со слов материально ответственных лиц или по данным учета без проверки фактического наличия.
Составляемые комиссией инвентаризационные описи могут быть заполнены как с использованием средств вычислительной и другой организационной техники, так и ручным способом. Наименования инвентаризуемых ценностей и объектов, их количество указывают в описях по номенклатуре и в единицах измерения, принятых в учете.
Результаты инвентаризации оформляются в «Актах инвентаризации...»по отдельным видам имущества и финансовых обязательств, а также «Сличительных ведомостях результатов инвентаризации...».
Выявленные при инвентаризации расхождения фактического наличия имущества с данными бухгалтерского учета регулируются в соответствии с «Положением о бухгалтерском учете и отчетности в Российской Федерации» в следующем порядке:
• основные средства, материальные ценности, денежные средства и другое имущество, оказавшиеся в излишке, подлежат оприходованию и зачислению соответственно на финансовые результаты организации или увеличение финансирования (фондов) у бюджетной организации с последующим установлением причин возникновения излишка и виновных лиц;
• убыль ценностей в пределах норм, утвержденных в установленном законодательством порядке, списывается по распоряжению руководителя организации соответственно на издержки производства и обращения или на уменьшение финансирования (фондов) у бюджетной организации. Нормы убыли могут применяться лишь в случаях выявления фактических недостач;
• недостачи материальных ценностей, денежных средств и другого имущества, а также порча сверх норм естественной убыли относятся на виновных лиц. В случаях, когда виновники не установлены или во взыскании с виновных лиц отказано судом, убытки от недостач и порчи списываются на финансовые результаты (убытки), а у бюджетной организации - на уменьшение финансирования (фондов).
Результаты инвентаризации должны быть отражены в учете и отчетности того месяца, в котором закончена инвентаризация, а по годовой инвентаризации - в годовом бухгалтерском отчете.
Данные результатов проведенных в отчетном году инвентаризаций обобщаются в ведомости результатов, выявленных инвентаризацией.