Потенциометрические сенсоры на основе электрополимеризованных материалов
КАРИМОВА ГЕЛЮСЯ РАВХАТЬЕВНА
НАЗВАНИЕ
Студент __ курса
Группа ____ _________________ (Каримова Г.Р)
Казань–2016
СОДЕРЖАНИЕ
ВВЕДЕНИЕ............................................................................................................... 3
1.ПОТЕНЦИМЕТРИЧЕСКИЕ СЕНСОРЫ НА ОСНОВЕ ЭЛЕКТРОПОЛИМЕРИЗОВАННЫХ МАТЕРИАЛОВ (Литературный обзор)....................................... 5
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ................................................................ 12
2.1 Постановка задачи..............................................................................................
2.2 Материалы и реагенты.......................................................................................
2.3 Приборы и методы эксперимента.....................................................................
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ..................................................................
ВЫВОДЫ................................................................................................................... 31
СПИСОК ИСПОЛЬЗОВАННЫХ БИБЛИОГРАФИЧЕСКИХ
ИСТОЧНИКОВ........................................................................................................ 32
В В Е Д Е Н И Е
Методы потенциометрического анализа являются одними из старейших в электроаналитической химии. Благодаря бестоковому режиму потенциометрические измерения не приводят к изменениям состава анализируемого образца, а простота конструкции ионселективных электродов (ИСЭ) позволяет использовать их в полевых условиях и интегрировать в автоматические системы контроля.
Однако работы швейцарской школы ионометрии под руководством проф. Э.Претча (E.Pretch) значительно расширили интервалы определяемых концентраций и селективность определения основных неорганических ионов [1,2]. В настоящее время разработаны способы определения кальция, свинца, ряда других катионов металлов с пределами обнаружения до n× (10-8 – 10-11) M. Помимо этого, интерес к потенциометрии подстегнули исследования в области создания твердоконтактных сенсоров на основе электропроводных материалов [3], а также мультисенсорных систем [4].
В традиционных ИСЭ измерение концентрации потенциалопределяющего иона производится относительно внутреннего стандартного раствора, отделённого от анализируемого раствора мембраной, обеспечивающей селективный транспорт иона. Такая конструкция имеет ряд ограничений, из которых наиболее важными являются обменные процессы «перетока» ионов под действием пассивного транспорта, контролируемого диффузией и отчасти миграцией. Это приводит к завышению предела обнаружения потенциалопределяющего иона. Также вероятны нарушение герметичности крепления мембраны и изменение параметров ее проницаемости и омического сопротивления в процессе хранения ИСЭ и его эксплуатации.
Наличие жидкостного контакта ограничивает возможности миниатюризации, хотя в биолого-медицинских исследованиях используют микроэлектроды с жидкостной мембраной, удерживаемой капиллярными силами в тонкой стеклянной трубке.
Альтернативой ИСЭ с жидкостным контактом являются электроды с твердым внутренним контактом, известные более 30 лет. В простейшем случае для изготовления такого электрода используют стандартный корпус ИСЭ, но токосъемник приклеивают непосредственно к внутренней стороне мембраны. Вариантом является наложение мембраны на поверхность планарного токосъемника, в свою очередь, закрепленного на непроводящем субстрате. Однако первые эксперименты в области твердоконтактных ИСЭ показали неустойчивость потенциала, его значительный дрейф при эксплуатации и резкое снижение параметров селективности и чувствительности по сравнению с традиционными ИСЭ с жидкостным внутренним контактом. [5]
Многие из указанных недостатков связаны с возникновением, так называемого, запорного потенциала на границе сред с различным характером проводимости – ионным для анализируемого раствора и электронным для металлического токосъемника, а также более выраженное влияиние на потенциал такого электрода растворенного кислорода.
Одним из способов решения указанных проблем является модификация электрода веществами, способными к ионному обмену с раствором и одновременно обладающими электрохимической активностью. Первоначально с этой целью использовались оксиды переходных металлов [6], однако в настоящее время основное внимание уделяется ИСЭ на основе электрополимеризованных материалов.
Потенциометрические сенсоры на основе электрополимеризованных материалов
(Литературный обзор)
Электрополимеризованные материалы образуются на поверхности электрода в химической реакции, инициируемой анодным окислением мономера. Обычно реакция начинается с образования катион-радикала при высоких анодных потенциалах. Пленка полимера меняет характеристики поверхности, что выражается в закономерном снижении тока по мере накопления целевого продукта. Условия полмеризации весьма сильно влияют на характеристики покрытия, в том числе, их электрохимическую ионообменную активность [7-12]. В настоящее время выделяют три группы продуктов электрополимеризации:
- соединения, обладающие электропроводностью и электрохимической ктивностью благодаря наличию в молекулах конъюгированных двойных связей и редокс-центров. В составе электрохимических сенсоров этой группы применяют в основном производный полианилина, полипирррола, и политиофена (рис.1), в том числе допированные электрохимически активными низкомолекулянизкомолекулярными соединениями [13, 14];
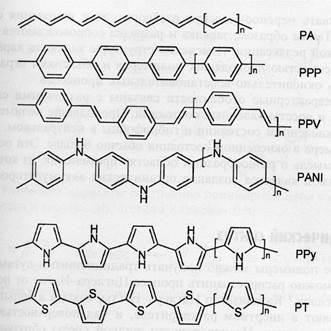
Рисунок 1. Некоторые типичные проводящие полимеры. PA – транс-полиацетилен, PPP- поли(n-фенилен), PPV – поли(n-фениленвинилен), PANI – полианилин, PPy – полипиррол, PT – политиофен.
- соединения, обладающие электрохимической активностью, но проявляющие электропроводность в узком интервале потенциалов, соответствующих обратному переносу электрона. К числу таких соединений относят, например, полимерные формы фенотиазиновых и феноксазиновых красителей [15-17];
- непроводящие соединения, такие как продукты полимеризации фенолов и ароматических диаминов, сверхокисленный полипиррол и ряд других[18-20]. Они не могут использоваться во вспомогательных целях, например, для механической защиты, создания электростатического барьера переноса мешающих ионов и др.
Полимерные материалы в настоящее время получают в основном путем циклирования потенциала. При этом формируются плотные пленки с высокой адгезией к поверхности электрода. В качестве токосъемника могут выступать платиновые, золотые и стеклоугеродные электроды, как стандартные, так и тонкопленочные, формируемые с помощью трафаретной печати или фотолитографии[21]. В чистом виде электрополимеризованные слои не проявляют селективности, меняя потенциал в присутствии всех ионов соответствующего знака. Также практически все электрополимеризованные слои в той или иной мере чувствительны к сильным окислителям. Исключением является полианилин, обладающий избирательной чувствительностью к ионам водорода [22-28].
Для придания селективности потенциометрического отклика в состав электрополимеризованного слоя вносят рецепторы, способные к селективному связыванию определенных ионов. Предложены три варианта таких слоев:
- рецепторы-допанты, удерживаемые в составе слоя за счет электростатических взаимодействий[29,30];
- рецепторы, ковалентно связанные с мономерами и, соответственно, с основной полимерной цепью[31,32];
- рецепторы, вносимые механически в состав полимерного покрытия. Примером может служить нанесение электрополимеризованного слоя тонкой пленки ПВХ, в которой растворен соответствующий ионофор[33,34].
Твердоконтактные потенциометрические сенсоры, в которых электрод покрыт только электрополимеризованным слоем, имеют ограничение. В отличие от обычных электродов с ПВХ-мембранами и внутренним раствором сравнения они обладают редокс-активностью, а значит, чувствительны к изменению окислительно-восстановительного потенциала анализируемого раствора. По этой причине в настоящее время более популярны гибридные покрытия из ПВХ, в которые введен электрохимически активный полимер. Состав этого слоя в целом аналогичен обычным мембранам ИСЭ с жидкостным внутренним контактом, но его толщина существенно меньше. Для получения таких покрытий чаще используют химически синтезированный полимер, который вводят в состав мембраны, растворяя в подходящем растворителе.
Примеры реализации потенциметрических сенсоров на основе различных электрополимеризованных материалов.
Полианилин.Данный полимер линейного строения образуется при полимеризации в сильнокислой среде, необходимой для стабилизации первичного катион-радикала. Его также получают путем фотохимического окисления анилина при низких температурах в присутствии персульфата, бихромата или Fe (III). В случае химически синтезированного полианилина его наносят на электрод, растворяя в органических растворителях, таких как хлороформ, в смеси с фенолом (пластификатор) и сильными органическими кислотами. В зависимости от рН и редокс-потенциала среды полианилин может находится в нескольких формах, среди которых только одна – солевая форма эмералдина – электропродна. Основным электрохимическим процессом, определяющим потенциал электрода, покрытого полианилином, в кислых и лабокилых средах является взаимный переход эмералдина и анилинового черного. Рис.2
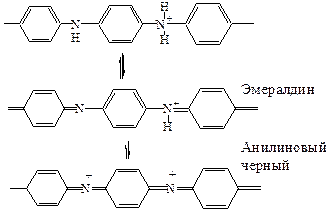
Рисунок 2. Cхема перехода эмералдина и анилинового черного.
Политиофен и его производные. Данный полимер, как и полианилин, может быть получен путем катион-радикальной полимеризации в неводных полярных органических растворителях и в воде с химическим и электрохимическим инициированием. В составе твердоконтактных потенциометрических сенсоров чаще применяют 3,4-этилендиоксипроизводное PEDOT, не имеющее ограничений по степени полимеризации, а также поли(н-октилтиофен), проявляющий липофильные свойства и хорошо совместимый с классическими полимерными мемебранами ИСЭ (рис.3)

Рисунок 3.Схемы фенотиазиновых производных.
Главное отличие политиофена и полипиррола от полианилина состоит в том, что их окислительно-восстановительные превращения не связаны с переносом эквивалентного количества ионов водорода, а значит, рН-независимы (1)

Это позволяет получить стабильный отклик на присутствие потенциалопределяющего иона, реагирующего с ионофором, при различных рН. Вторым важным отличием, в определённой мере следующим из первого, является то, что переключение между нейтральным (неэлектропроводным) и окисленным (электропроводным) состоянием полипиррола и политиофена не сопровождается массопереносом между полимером и раствором. Противоионы могут оставаться в пределах полимерного слоя и не «выдавливаются» в раствор.
Потенциметрические сенсоры на основе фенотиазина и фенотиазиновых производных.
Натан С.Лавенсе и Джозеф Ванг в своих исследованиях провели оценку красителей фенотиазина, адсорбированных на модифицированных нанотрубках. Сигнал регистрировали методом циклической вольтамперометрии, получена стабильного низкого сигнала сенсоров для определенения NADH.Для сравнения были взяты три типа электродов: чистые нанотрубки, натнотрубки, модифиицрованные толуидиновым синим и планарные графитовые электроды, покрытые толуидиновыйм синим. Амперометрические характеристики электродов доказали стабильность и чувствительность полученных электродов. Получены и описаны токи окисления и восстановления для приведенных выше модифицированных электродов. Время отклика электродов, модифицированных толуидиновым синим (и в случае и нанотрубок и в случае графитового электрода), показало стабильно увеличение сигнала при добавлении 50 мМ NADH (при потенциале -0,2V), Более того, сигнал был стабилен и не уменьшался в течение 60 минут (для электрода, покрытого нанотрубкми с толуидиновым синим) и затем держался в присутствии 500 мМ NADH. [37]
Похожие исследования были сделаны Делиа Глигор,Юзеф Диглин фотокатилитического окисления/восстановления NADH графитового электрода, модифицированного новым производным фенотиазина формальдегида (PPF). Электрохимические исследования открыли, что присутствие графит/ феноиазин формальдегид дате квазиобратимый фольамперометричесикй отлклик, отвечающий переносу 2е- /2Н+ и что модифицированный электрод показывал электрокаталитическую активность для окисления/восстановления NADH/ затем поверхность электрода была подвергнута облучению светового источника (250 в галогеновая лампа) и после этого было обнаружено значительное увеличение электрокаталического тока. Была рассчитана величина константы для экспериментов вращательного дискового электрода, выполненных для различных концентраций NADH. Амперометрические измерения показали увеличение чувствительности в присутствие светового облучения. [36]
Барабара Брунетти и Паоло Уго описывают золотой наноэлекродный композит, имеющий в своей основе микропористую углеродную мембрану. Была изучена электрохимия медиаторов трехэлектродного переноса для биосенсоров, основаннная на ферментах-редуктазах – два фенотиазина (азур А и Б). Все три медиатора имел более отрицательный диапазон потенциала Е1/2, чем изученные ранее наноэлектродных композитов. Однако, их негативный предел обнаружения для золота ограничивается при использовании электролита буфер с рН=7.4. Было изучено влияние обратного тока на предел обнаружения. Если рассматривать макроэлектрод, то вольамперограммы для фенотиазиновых производных, являются искаженными из-за адсорбции уменьшенных форм на поверхности электрода. Этот адсорбционный процесс является концентрационной зависимостью. Найденный низкий предел обнаружения для наноэлектродных композитов, позволяет использовать низкие концентрации медиаторов и их нежелательный адсорбционный процесс может быть удален благодаря композитам с мембранными поликарбонатными микропорами [40].
В работе Поурнагхи-Азар и Фархади описано изучение перодатом тетрабутиламмония и фенотиазина в присутствии сильных кислот в хлороформе посредством потенциометрии. Были определены направления реакции. Были оптимизированы условия оксидиметрического титрования феотиазиновых производных, используя стандартизированный раствор хлороформа перодатом тетрабутиламмония. Была определена конечная точка потенциометрического титрования. Относительное стандартное отклонение для определения 5 мг фенотиазаина было определено и составило около 1-1,5%. В качестве электрода сравнения использован хлорсеребряный электрод, 0.05 М и 0.5 М растворы кислот в хлороформе готовили в отдельной ячейке, бутылке с плотно закрытой керамической пробкой. Индикаторным электродом служил платиновый электрод. Параллельно проводили спектрометрические исследования абсорбционных процессов элюентов. В результате были изучены несколько вариантов эксперимента, для того, чтобы оптимизировать предложенный потенциометрический метод. Из всех вариантов тестируемых кислот, более подходящими для определения фенотиазина оказались паратолуолсульфокислота и хлорная кислота (рис 4).
Миттал С.К и Кумар А.С.К описали новый мембранный электрод, полученный на чувствительном материале. Мембрана состояла из: ПВХ (33%), лиганда (2-6%), пластификатор – о-нитрофенилоктил (63 %), растворенных в 2-3 мл тетрагидрофурана. Были подобраны оптимальные соотношения ингредиентов мембраны.
Полученный электрод показал стабильное сохранение сигнала для определения ионов металлов в широком диапазоне измерений (1×10-4 до 1×10-1 М) (таблица 1). Найден предел обнаружения, он составил 6×10-5 М. Электрод показал хорошую воспроизводилось сигнал ионов серебра в присутствии ионов ртути. В значительной степени электрод должен быть использован как индикаторный при определении ионов серебря в различных синтетических образцах и также может быть рекомендован для определения SCN, CN, S2 и I.
Основные характеристики описанных электродов приведены в таблице 2.

Рисунок 4. Потенциометрическое титрование 5 мл 0.005 M фенотиазина 0.0009 M раствором хлорной кислоты в присутствии (a) 0.1 M сульфоновой кислоты и (b) 0.1 M паратолуолсульфокислоты [35].
Таблица 1.
Коэффициенты селективности для некоторых ионов металлов.
(1) – первоначальный диапазон концентраций от 1×10-1 до 1×10-6 М при концентрации мешающего иона 1×10-2 М; (2) - первоначальный диапазон концентраций от 1×10-2 до 1×10-4 М, с концентрацией раствора сравнения 1×10-4 М при концентрации мешающего иона 1×10-2 М. [38]
| Определяемый ион | - lg KAg+ | |
| Na+ | 1.9 | 2.1 |
| K+ | 1.8 | 2.1 |
| Mg2+ | 2.5 | 2.1 |
| Ca2+ | 2.5 | 2.3 |
| Sr2+ | 2.3 | 2.5 |
| Pb2+ | 2.1 | 2.7 |
| Cu2+ | 2.2 | 1.7 |
| Co2+ | 3.0 | 2.4 |
| Ni2+ | 2.1 | 2.6 |
| Zn2+ | 2.2 | 2.6 |
| Cd2+ | 3.0 | 2.6 |
| Hg2+ | 2.3 | 2.3 |
| Fe3+ | 2.2 | 2.5 |
Таблица 2.
Основные характеристики разработанных сенсоров (литературные данные).
| Способ нанесения | Определяемое вещество | Селективность | Аналитические характеристики | Лит. |
| Реакция между тетрабутиламмония периодатом и фенотиазином в присутствии сильных кислот в хлороформе | Лекарственные препараты на основе фенотиазинов | Сведения не приведены | Сведения не приведены | [35] |
| Фотокаталитическое окисление никотинамидодениндинуклеотида новым полимерным фенотиазином | Никотинамидодениндинуклеотид | Сведения не приведены | pH=7.0 , kobs, [NADH]=0 = 3.9×103 M-1 S-1 | [36] |
| Химическая адсорбция фенотиазиновых красителей на углеродных нанотрубках | Фенотиазиновые красители | Сведения не приведены | Сведения не приведены | [37] |
| Материал был использован для изготовления жидкого мембранного электрода для определения серебра | 2-аминотиофенольная основа в качестве ионофора | Коэффициенты для тесно связанных ионов металлов | диапазон измерения (1 × 10-4 до 1 × 10-1 М), ПрО (6 × 10-5 М), рН (3.3-8.0) | [38] |
| Модифицированные электроды с новым производным фенотиазина | Электрокаталитическое окисление никотинамидодениндинуклеотида | Сведения не приведены | k1 (1.8×103 M-1 s-1, при pH 7.0) | [39] |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Постановка задачи
В рамках выполнения учебной практики были поставлены следующие задачи:
- освоить методику модификации печатного электрода полифенотиазином;
- изучить влияние рН среды на модифицированный электрод;
- получить с помощью модифицированного электрода вольтамперометрические зависимости в растворе гексацианоферратов.
Материалы и реагенты
В работе использовали азотную кислоту (ООО НПО «ТатХимПродукт», г. Казань), универсальный буфер, желтую и красную кровяные соли, в качестве ионофора был использован полифенотиазин (ПФТА), синтезированный и любезно предоставленный В.В. Горбачуком (кафедра органической химии Химического института им. А.М.Бутлерова КФУ).
Буферные растворы готовилииз точных навесок компонентов в дистиллированной воде с последующей корректировкой рН с помощью концентрированного раствора NaOH.
Структурная формула полифенотиазина, использованного в работе, и схема его получения представлены на рисунке 5.

Рисунок 5. Схема получения полифенотиазина, n=1-5.
Окисление фенотиазина проводилось в присутствии двойного избытка п-толуолсульфоновой кислоты избытком персульфата аммония в двухфазной системе хлороформ-вода. Реакционную смесь промывали водой и аммиаком (3 раза, порции по 100 мл) с последующим отделением фазы хлороформа, затем продукт окислительной полимеризации выделили осаждением петролейным эфиром, отфильтровали на воронке Шотта. Продукт сушили в эксикаторе над оксидом фосфора при комнатной температуре. В соответствии с данными масс-спектрометрии МАЛДИ, продукт окислительной полимеризации имеет структуру, представленную на рис. 5.
Приборы и методы
В качестве рабочих использовали печатные графитовые электроды, электродом сравнения служил хлоридсеребряный электрод. Измерения проводили в двухэлектродной ячейке.
Контроль величины pH и потенциометрические измерения проводили с помощью pH-метра-иономера "Эксперт – 001" (электрод ЭВЛ-1М3.1) производства НПП "Эконикс-Эксперт", г.Москва.
Для получения вольтамперометрических зависимостей использовали AutoLab.
Дозирование реагентов при приготовлении растворов и проведении измерений производили с помощью микродозаторов «Ленпипет», Unipipette 2010 и Vari (“Plastomed”, Польша).
Перемешивание раствора в ячейке осуществляли с помощью магнитной мешалки.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Microcal Origin 8.1.
Изготовление модифицированного электрода.
Модификацию печатного электрода проводили путем капельного нанесения раствора полифенотиазина в хлороформе Концентрация раствора?. Наносили 2 мкл раствора с последующим высушиванием при комнатной температуре.
Методика измерений
Для измерения сигнала полученный сенсор погружали в ячейку с универсальным буфером и при непрерывном перемешивании измеряли потенциал электрода.
Для измерения вольтамперометрических характеристик разработанный сенсор и электрод сравнения погружали в ячейку с 10 мл 0.1 М раствора КNO3 и снимали циклическую вольтамперограмму. Измерения проводили в режиме многократного циклирования потенциала в диапазоне -0.4 – +0.8 в при различной концентрации K3Fe(CN)6 в ячейке (1.0×10-6 – 1.0×10-3 М).
Приготовление рабочих растворов.Для приготовлениярастворакрасной кровяной соли (K3[Fe(CN)6]) взвесили 0.329 г сухого K3[Fe(CN)6] и растворили его в 10 мл дистиллированной воды для получения 0.1 М раствора. Для приготовления 0.1 М раствора желтой кровяной солиK4[Fe(CN)6] взяли навеску 0.4220 г сухого K4[Fe(CN)6] и растворили в 10 мл дистиллированной воды. Для получения 0.5 М раствора желтой кровяной соливзвесили 2.11 г сухого K4[Fe(CN)6] и растворили его в 10 мл дистиллированной воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Влияние рН среды
Для сравнения были взяты два образца полифенотиазина с однодневной разницей в получении. На рисунке 6 представлены рН-зависимости для обоих образцов. Можно видеть, что оба образца демонстрируют схожие зависимости.


Образец 1 Образец 2
Рисунок 6. Влияние рН среды на печатные электроды, модифицированные полифенотиазином, синтезированным в первый день (образец 1) и во второй день (образец 2).
3.2. Вольтамперометрические характеристики модифицированных электродов.
В ходе экспериментов были получены вольтамперограммы при различных концентрациях ферроцианидов в растворе с помощью электрода, модифцированного полифенотиазином 1 (образец 1) (рис.7). Рассчитаны токи пиков окисления и восстановления при соответствующих потенциалах (табл.3).

Рисунок 7. Вольтамперограммы, полученные с помощью электрода, модифицированного полифенотиазином 1, при различных концентрациях ферроцианидов в растворе.
Таблица 3.
Значения тока пиков окисления и восстановления ферроцианидов, полученные с помощью электрода, модифицированного полифенотиазином 1.
| Рецептор | СK3Fe(CN)6, М | Eк, мВ | Iк, мкA | Eа,мВ | Iа, мкA |
| ПФТА 1 | |||||
| 1×10-5 | - | - | - | - | |
| 5×10-5 | 0,297 | 2,985 | 0,525 | 2,029 | |
| 1×10-4 | 0,253 | 6,250 | 0,548 | 6,753 | |
| 5×10-4 | 0,163 | 19,061 | 0,566 | 41,072 |
Далее была выбрана оптимальная концентрация ферроцианидов, равная 5×10-3 М, и получены вольтамперограммы в зависимости от скорости развертки потенциала (циклирование потенциала в диапазоне 5 ÷ 700 мВ) (рис 8).

Рисунок 8. Циклическая вольтамперограмма, полученная на электроде, модифицированом полифенотиазом 1, при различной скорости развертки. Концентрация ферроцианидов в растворе 5×10-3 М.
Аналогичным образом были изучен и охарактеризован электрод, модифицированный полифенотиазном 2 (рис.9, 10).

Рисунок 9. Вольтамперограммы, полученные с помощью электрода, модифицированного полифенотиазином 2, при различных концентрациях ферроцианидов в растворе.

Рисунок 10. Циклическая вольтамперограмма, полученная на электроде, модифицированом полифенотиазом 1, при различной скорости развертки. Концентрация ферроцианидов в растворе 5×10-3 М.
ВЫВОДЫ
1. Освоена методика изготовления потенциометрических сенсоров на основе планарных печатных электродов, модифицированных химически синтезированным полифенотиазином.
2. Освоена методика определения влияния рН среды на потенциометрический сигнал модифицированных электродов.
3. С помощью разработанных модифицированных электродов получены вольтамперометрические зависимости в растворе ферроцианидов при различной скорости развертки потенциала и при различных концентрациях ферроцианидов.
4. По полученным вольтамперограммам рассчитаны потенциалы и токи пиков окисления и восстановления.