Основные сведения о строении и свойствах материалов
Из известных 106 элементов Периодической системы Д.И. Менделеева 76 являются металлами. Все металлы и металлические сплавы – тела кристаллические: атомы (ионы) расположены закономерно с образованием, так называемой кристаллической решетки. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие твердое кристаллическое тело. Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, называется элементарной кристаллической ячейкой.
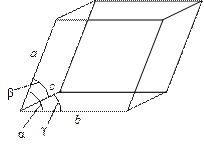
Свойства металлов определяются типом кристаллической решетки и типом связи между атомами и электронами, составляющих металл. Различают несколько типов кристаллической решетки. Кристаллические пространственные решетки делят на семь систем – сингоний, исходя из соотношения между осевыми единицами и углами. Обозначим ребра ячейки (параллелепипеда) через a, b и c, углы между ребрами , , . Тогда семь кристаллических систем соответствуют следующим формам ячеек:
1.
|
2. Моноклинная: a b c и = = 900; 900;
3. Ромбическая: a b c и = = = 900;
4. Гексагональная: a=bc и ==90; =1200;
5. Ромбоэдрическая: a = b = c и = = 900;
6. Тетрагональная: a = b c и = = =9 00;
7. Кубическая: a = b = c и = = = 900;
Подавляющее число технически важных металлов образуют одну из следующих сложных (имеющих несколько атомов на одну ячейку) решеток с плотной упаковкой атомов:
- кубическую объемноцентрированную (О.Ц.К.): Rb, K, Na, Li, Ta, W, V и другие.
- кубическую гранецентрированную (Г.Ц.К.): Pb, Ni, Ag, Au, Pb, Pt, Cu и другие.
- гексагональную: Mg, Cd, Ru, Zn, Co, Zr и другие.
- тетрагональную: Sn, I (мало)
На элементарную ячейку ОЦК решетки приходится два атома (1+1/8*8=2);
На элементарную ячейку ГЦК – 4 атома (1/8*8+1/2*6=4);
На элементарную ячейку ГПЦ – 6 атомов
Чем больше атомов в ячейке – тем меньше расстояние между ними и тем выше коэффициент заполнения ячейки, который определяется как отношение объема, занятого атомами, к объему ячейки. Так ГЦК и ГПЦ (с/а=1,633) – наиболее компактные, в них коэффициент заполнения объема равен 74% (а есть и 25%).
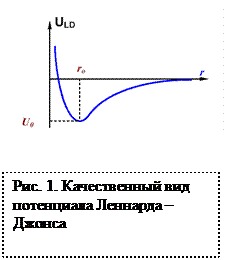
В зависимости от типа кристаллической решетки период решетки металлов находится в пределах от 0,1нм до 0,7нм. (1нм=0,1Å). Это расстояние между атомами является устойчивым положением равновесия и энергия взаимодействия между ними при этом является минимальной.
Сближение атомов (ионов) на расстояние меньше равновесного (R0) или удаление их на расстояние r>R0 осуществимо только при совершении определенной работы против сил отталкивания или притяжения (потенциал Леннарда - Джонса).
 Эти силы имеют электрическую природу. Они
Эти силы имеют электрическую природу. Они
определяются электрическим взаимодействием между
положительно заряженными ионами и электронами. У
атомов металлов электрон – ядерные конфигурации
таковы, что при их сближении становится
энергетически выгодным состояние, в котором
внешние электроны этих атомов теряют связь с
отдельными атомами, становится общими, т.е.
коллективизируются и свободно перемещаются по
определенным энергетическим уровням между положительно заряженными и периодически расположенным в пространстве ионами. Такое взаимодействие между ионным скелетом и электронным газом получило название металлической связи. Она определяет устойчивость такой ионно-электронной системы и ее свойства.
Основными признаками (свойствами) металлов являются:
1. Высокие тепло – и электропроводность;
2. Положительный температурный коэффициент сопротивления (ТКС), а также сверхпроводимость;
3. Термоэлектронная эмиссия (способность испускать электроны при нагреве);
4. Хорошая отражательная способность; металлы непрозрачны и обладают металлическим блеском;
5. Повышенная способность к пластичной деформации.
Чистые металлы (99,99 - 99,999% - основного металла) в обычном структурном состоянии обладают низкой прочностью. Поэтому их применяют сравнительно редко. Наиболее широко используются сплавы. Сплавыполучают сплавлением или спеканием двух или более металлов или металлов с неметаллами. Они обладают характерными свойствами, присущие металлическому состоянию. Химические элементы, образующие сплав, называют компонентами. В сплавах в зависимости от взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы, химические соединения.
Фазойназывают однородную составляющую часть системы (совокупности фаз, находящихся в состоянии равновесия), имеющую определенный состав, кристаллическое строение, свойства, а так же одно и то же агрегатное состояние и отделенную от остальных частей системы поверхностью раздела. Так, однородный чистый металл или сплав является однофазной системой. Если жидкий сплав (металл) и кристаллы – двухфазной системы. Если в твердом сплаве есть зерна матрицы и частицы карбидов – тоже двухфазный сплав.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры. Таким образом, первый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки, и представляют собой одну фазу.
Различают твердые растворы замещения и твердые растворы внедрения. В твердых растворах замещения атомы растворенного компонента замещают часть атомов растворителя в узлах его кристаллической решетки.
В твердых растворах внедрения атомы растворенного компонента располагаются в междоузлиях (пустотах) кристаллической решетки растворителя.
Так как электронное строение и размеры атомов растворителя и растворенного компонента различны, то при образовании твердого раствора кристаллическая решетка всегда искажается, а периоды ее изменяются. В твердом растворе замещения период решетки может увеличиваться или уменьшаться, в зависимости от соотношения атомных радиусов растворителя и растворенного компонента. В твердом растворе внедрения период решетки растворителя всегда возрастает.
Все металлы могут в той или иной степени растворяться один в другом в твердом состоянии. Например, в Al может растворяться до 5,5% Cu, а в меди до 39% Zn без изменения типа их кристаллической решетки. В тех случаях, когда компоненты могут замещать один другого в кристаллической решетке в любых количественных соотношениях, образуется непрерывный ряд твердых растворов.
Твердые растворы замещения с неограниченной растворимостью могут образоваться при следующих условиях:
1. Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками. Тогда возможен непрерывный переход от кристаллической решетки одного компонента к решетке другого компонента.
2. Различие в атомных размерах компонентов не должно превышать R=9-15% (правило Юм-Розери)
3. Компоненты должны обладать близким строением валентной оболочки электронов в атомах т.е. быть в одной или смежной родственной группы табл. Менделеева. Например, неограниченно растворяются Ag и Au (R=0,2%), Ni и Сu (R=3%) и т.д. В то же время Na, Ca, K, Pb и другие, имеющие большой атомный диаметр в Cu, Ag нерастворимы.
Твердые растворы внедрения могут возникнуть только в тех случаях, когда диаметр растворенного атома невелик. Поэтому твердые растворы этого типа получаются лишь при растворении в металле (например Fe, Mo, Gr и т.д.) углерода (ат. радиус 0.077нм), азота (ат. рад. 0.071нм), водорода (0.046нм), т.е. элементов с малым атомным радиусом.
Твердые растворы внедрения могут быть только ограниченной концентрации, поскольку число пор в решетке ограничено. Роль этого вида твердого раствора значительна в сталях и чугунах.
Химические соединения. В отличие от твердых растворах химические соединения обычно образуются между компонентами, имеющие большое различие в электронном строении атомов. Соединение общих металлов с другими носят общее название интерметаллидов. Соединение металлов с неметаллами (карбиды, нитриды и т.д.), которые могут обладать металлической связью называют металлическими соединениями.
Характерные особенности химических соединений.
1. Кристаллическая решетка отличается от решеток компонентов, образующих соединение. Атомы каждого компонента располагаются закономерно по определенным узлам решетки.
2. Свойства соединений резко отличается от свойств компонентов.
3. Температура плавления постоянна.
4. Образование химического соединения сопровождается значительным тепловым эффектом.