
Категории:
АстрономияБиология
География
Другие языки
Интернет
Информатика
История
Культура
Литература
Логика
Математика
Медицина
Механика
Охрана труда
Педагогика
Политика
Право
Психология
Религия
Риторика
Социология
Спорт
Строительство
Технология
Транспорт
Физика
Философия
Финансы
Химия
Экология
Экономика
Электроника
Билет № 50. Изопроцессы. 2011 г. 10 кл
Изопроцессы.
Процессы, протекающие в системе с неизменной массой газа при постоянном значении одного из макроскопических параметров, называются изопроцессами.
- Изотермический процесс –процесс, происходящий с неизменной массой данного газа при постоянной температуре.
pV = m/M RT – уравнение состояния идеального газа ( уравнение Менделеева – Клапейрона)
Если m = const и T =const , то: pV = const или p = const/V или p ~ 1/V
При изотермическом процессе произведение давления на объём есть величина постоянная. – закон Бойля – Мариотта.
Или: при изотермическом процессе давление газа обратно пропорционально объёму.
Закон Бойля – Мариотта для двух состояний газа: p1V1 = p2V2
Эту запись легко получить из уравнения Клапейрона (p1V1/Т1 = p2V2/Т2) , учитывая, что Т1 =Т2
Изотерма – линия на графике, соединяющая точки с одинаковой температурой. Изотема – это гипербола.
Построим изотерму в различных координатах.
P p V
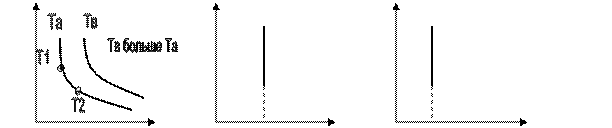
0 V 0 T 0 T
Пунктирная линия на графике показывает, что при низких температурах, близких к абсолютному нулю, данный процесс происходить не может. ( Газ превратится в жидкость).
Чем выше изотерма на графике, тем при большей температуре проведен данный изотермический процесс.
С точки зрения МКТ с увеличением объёма газа уменьшается его концентрация, а следовательно уменьшается давление.
- Изобарный процесс - процесс, происходящий с неизменной массой данного газа при постоянном давлении.
pV = m/M RT – уравнение состояния идеального газа
Если m = const и р =const , то: V ~ T, т. е. V = const T
При изобарном процессе объём газа прямо пропорционален абсолютной температуре.- закон Гей- Люссака.
Для двух разных состояниях газа: V1/T1 = V2/T2
Эту запись легко получить из уравнения Клапейрона (p1V1/Т1 = p2V2/Т2) , учитывая, что
p1 =p2
Изобара – линия на графике, соединяющая точки с одинаковым давлением.
Построим изобару в различных координатах.
P Р V
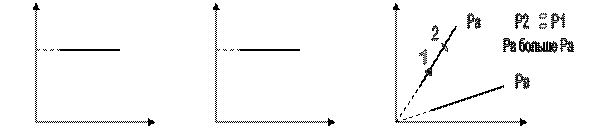
0 V 0 T 0 T
Чем выше изобара на графике, тем при меньшей температуре проведен данный изобарный процесс. P1 > P2
С точки зрения МКТ с увеличением температуры газа увеличивается среднее расстояние между молекулами и следовательно растет объём
- Изохорный процесс - процесс, происходящий с неизменной массой данного газа при постоянном объёме.
pV = m/M RT – уравнение состояния идеального газа
Если m = const и V =const , то: p ~ T, т. е. p = const T
При изохорном процессе давлени газа прямо пропорционален абсолютной температуре.- закон Шарля.
Для двух разных состояниях газа: р1/T1 = р2/T2
Эту запись легко получить из уравнения Клапейрона (p1V1/Т1 = p2V2/Т2) , учитывая, что
V1 = V2
Изохора – линия на графике, соединяющая точки с одинаковым объёмом.
Построим изохору в различных координатах.
P V p
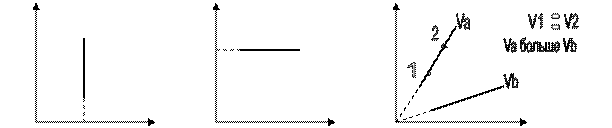
0 V 0 T 0 T
Чем выше изобара на графике, тем при меньшей температуре проведен данный изобарный процесс. V1 > V2
С точки зрения МКТ с увеличением температуры газа увеличивается скорость движения молекул газа , они сильнее ударяют о стенки сосуда и давление газа возрастает.
Изохорный процесс можно осуществить нагреванием или охлаждением газа в закрытом соcуде.
План решения задач на газовые законы.
- Выделить несколько состояний газа.
- Записать параметры газа для каждого состояния.

- Записать данные.
- Определить какие из параметров газа являются постоянными.
- Определить какой процесс произошел с газом и каким законом надо воспользоваться.
Если у газа только одно состояние, или с газом произошёл произвольный процесс, или задана масса газа, или массу надо найти, или масса газа менялась, то используют уравнение Менделеева- Клапейрона.
Если m = const и задано несколько состояний, то используют уравнение Клапейрона.
Если m = const и Т = const, то процесс изотермический и используют закон Бойля – Мариотта.
Если m = const и р = const, то процесс изобарный и используют закон Гей- Люссака.
Если m = const и V = const, то процесс изохорный и используют закон Шарля.