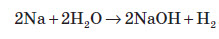Хімічні властивості натрію й калію
Лужні та лужноземельні елементи
Маючи в зовнішньому електронному шарі тільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми лужних елементів досить легко віддають електрон, тобто характеризуються низькою енергією йонізації.
Зі сполук лужних металів широко розповсюджені в природі лише сполуки Натрію й Калію. У вигляді простих речовин у природі вони не зу стрічаються, тому що занадто активні.
Найважливішими природними сполуками Натрію й Калію є: натрій хлорид (NaCl), натрій сульфат —мірабіліт (Na2SO4*10H2O), сильвініт (NaCl*KCl), карналіт (KCl*MgCl2*6H2O). Сполуки інших лужнихметалів зустрічаються дуже рідко. Францій отриманий штучно в ядерних реакціях.
Лужні метали надзвичайно активні і є найсильнішими серед відомих відновників, тому електроліз водних розчинів солей цих металів не призводить до добування самих металів, а лише до утворення лугів. Прості речовини добувають електролізом розплавів їхніх галогенідів, найчастіше — хлоридів, що утворюють природні мінерали. Металічний натрій у промисловості добувають електролізом розплаву натрій хлориду з інертними (графітними) електродами.
Фізичні властивості натрію й калію
Натрій і калій — сріблясто-білі метали, що мають добру електропровідність; м’які, легші від води
(плавають на її поверхні, реагуючи з нею).
Хімічні властивості натрію й калію
Натрій і калій активно взаємодіють із галогенами:
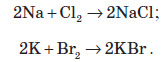
На повітрі натрій і калій активно згорають. Причому продуктом реакції є не оксиди, а пероксиди або надпероксиди:
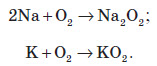
Як і всі лужні метали, натрій і калій активно взаємодіють із водою з утворенням водню та відповідних лугів. Калій найчастіше при такій взаємодії вибухає: