Понятие о константе Михаэлиса. Уравнение Михаэлиса-Ментен
Уравнение Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата.
В 1903, французский биофизик Victor Henri обнаружил, что ферментативная реакция инициируется после связывания фермента и субстрата. Эта работа была взята за основу немецким биохимиком Михаэлисом (Leonor Michaelis) и канадским физиологом Ментен (Maud Menten) (кстати, первая женщина, получившая докторскую степень по медицине), которые изучали кинетику механизма ферментативной реакции инвертазы при гидролизе сахарозы на фруктозу и глюкозу. В 1913 ими была предложена математическую модель ферментативной реакции. Они основывались на том, что субстрат [S] взаимодействует с ферментом [E] с образованием фермент-субстратного комплекса [ES] который после преобразования распадается на продукт [P] и фермент. Понятие константы Михаэлиса было внесено в 1925 году английским ботаником Бригсом (G. E. Briggs) и британским генетиком Холдейном (J. B. S. Haldane), так как в модели Михаэлиса-Ментен не учитывалась константа скорости распада [ES] с образованием продукта. В настоящее время математическая модель реакции выглядит следующим образом:
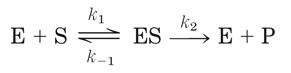 где k1, k-1 и k2 обозначены как констатны скорости. Авторы считали, что образование и распад фермент-субстратного комплекса вполне обратимый процесс. Скорость ферментативной реакции определяется скоростью распада фермент-субстратного комплекса:
где k1, k-1 и k2 обозначены как констатны скорости. Авторы считали, что образование и распад фермент-субстратного комплекса вполне обратимый процесс. Скорость ферментативной реакции определяется скоростью распада фермент-субстратного комплекса:
V0 = k2[ES]
Практическим путём определить экспериментально уровень [ES] весьма затруднительно, поэтому необходимо было найти альтернативный способ его определения. Для этого были применены некоторые вводные:
· [Et] – общий уровень фермента участвующий в реакции на данный момент (сумма свободного и связанного с субстратом фермента). Тогда концентрация свободного фермента ровна [Et] - [ES].
· так как [S] обычно значительно превосходит концентрацию фермента [Et], можно пренебречь количеством субстрата связанного с ферментом в каждый данный момент реакции.
23. Регуляция активности ферментов. Активаторы и ингибиторы ферментов. Типы ингибирования ферментов: обратимое и необратимое; конкурентное и неконкурентное.
На скорость химической реакции влияют различные вещества. Те из них, которые тормозят ферментативные процессы, называются ингибиторами. Те же, которые усиливают реакции - активаторами. Активаторами могут быть:
1) кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са, лактатдегидрогеназа (ЛДГ) - 2п, аргиназа - Мп, пептидаза - Мд и коферменты: витамин С, производные различных витаминов (НАД, НАДФ, ФМН, ФАД, КоА8Н и др.). Они обеспечивают связывание активного центра фермента с субстратом.
2) анионы также могут оказывать активирующее влияние на активность фермента, например, анионы С1- активируют слюнную амилазу;
3) активаторами могут служить также вещества, создающие оптимальное значение рН среды для проявления ферментативной активности, например, НС1 для создания оптимальной среды желудочного содержимого для активации пепсиногена в пепсин;
4) активаторами являются также вещества, переводящие проферменты в активный фермент, например, энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин;
5) активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром фермента и способствуют формированию активного центра фермента.
Ингибиторы - это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования: необратимое и обратимое.
При необратимом ингибировании - ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.), соединения мышьяка и другие токсические вещества, способные привести к необратимой денатурации апофермента (неспецифические ингибиторы).
Специфический необратимый ингибитор может связываться с ферментом и инактивировать в его активном центре функциональную группу, которая необходима для проявления его каталитической активности. Например, диизопропилфторфосфат, йодацетат и ион ацетамида.
Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента. Классический пример, конкурентного ингибирование - торможение действия сукцинатдегидрогеназы малоновой кислотой.
Неконкурентные ингибиторы связываются с аллостерическим центром фермента. Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к деформации каталитического центра фермента и снижению ферментативной активности. Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма.