Лекция 4
Химическая связь. Правило Октета. Метод валентных связей (МВС). Параметры молекулы. Свойства ковалентной связи: насыщаемость, направленность и поляризуемость. Гибридизация атомных орбиталей. Геометрия молекул. Химическая связь, валентность, степень окисления.
Химическая связь – это сложное электростатическое взаимодействие, которое сопровождается перестройкой электронных оболочек атомов, приводящей к образованию простых и сложных веществ или кристаллов.
При этом потенциальная энергия атомов понижается. Следовательно, образование связи – процесс энергетически выгодный.
Основные виды химической связи: ионная, ковалентная и металлическая. Кроме того, между молекулами возникают водородная связь и вандерваальсовы взаимодействия.
В 1968 г. немецкий ученый В. Коссель высказал идею о том, что атомы при взаимодействии либо отдают электроны, либо присоединяют их, превращаясь при этом соответственно в катионы или анионы, имеющие устойчивые электронные конфигурации. Взаимное притяжение положительно и отрицательно заряженных частиц и обусловливает образование химической связи. Идеи Косселя легли в основу разработки теории ионной химической связи.
В том же году американский ученый Г. Льюнс предположил, что устойчивые внешние электронные конфигурации молекул могут возникать в результате обобщения пары электронов. Связь, образованная за счет обобществления пары электронов, поставляемых по одному от каждого атома получила название ковалентной.
Правило октета
В результате образования химической связи атомы могут приобретать такую же электронную конфигурацию, как у благородных газов, которые (за исключением гелия) имеют на внешнем уровне восемь (октет) электронов. Стремление к созданию такой устойчивой электронной конфигурации получило название октета. Оно справедливо и для ионной и ковалентной связей.
Для исследования химической связи используют два метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
4.1. Метод валентных связей (МВС)
Его разработали в 1927 г. английские ученые В. Гейтлер и Ф. Лондон на примере образования молекулы водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков:
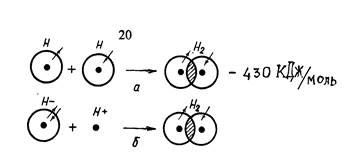
Рис. Образование молекулы водорода по образованному (а) и по донорно-акцепторному (б) механизму
Электронная плотность между ядрами возрастает, ядра стягиваются друг к другу, энергия системы понижается.
Механизмы образования ковалентной связи:
1) Обменный (спаривания).
Связь возникает путем перекрывания двух одноэлектронных орбиталей. Например, образование H2, Cl2 и др.
2) Донорно-акцепторный.
Связь возникает за счет перекрывания двухэлектронной орбитали одного атома (донора) со свободной орбиталью другого атома (акцептора). Например, образование молекулы Н2 из гидрид-иона и протона, образование иона аммония 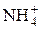 .
.

Основные положения МВС:
1) При образовании связи происходит перекрывание электронных облаков атомов и электронная плотность между ядрами увеличивается примерно до 20%.
Это приводит к притяжению атомных ядер и уменьшению энергии системы.
2) Связь осуществляется двумя электронами с анти-паралелльными спинами.
3) Все связи в молекуле рассматриваются как локализованные, двухцентровые и двухэлектронные.
4.2. Параметры молекул
Количественными параметрами ковалентной связи являются: энергия, длина, валентный угол и полярность.
Энергия, выделяемая при образовании связи из одиночных атомов, называется энергией связи. Она зависит, от электронной плотности перекрывающихся орбиталей и от глубины их перекрывания. Чем больше эти характеристики, тем больше энергия связи.
Длина связи – это расстояние между ядрами химически связанных атомов. Связь тем прочнее, тем меньше ее длина.
Угол, образованный направлением двух связей, называется валентным. Он создает определенную ориентацию химической связи в пространстве.
Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной. Примеры: H2, O2, Cl2 N2 и др. Если один из атомов в молекуле сильнее притягивает электроны связи, то возникает ковалентная полярная связь. Например в молекулах HCl, H2O, NH3 и др. Критерием способности атома притягивать электроны к себе может служить электроотрицательность (ЭО). Чем выше ЭО атома, тем более вероятно смещение электронной пары в сторону ядра этого атома. Поэтому разность ЭО разных атомов характеризует полярность связи. Чем больше разность ЭО, тем выше полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно он получает заряд, называемый эффективным зарядом атома (обозначается буквой «дельта» -). У второго атома повышается плотность положительного заряда (+). Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине зарядами, находящимся на определенном расстоянии (д) друг от друга. Мерой полярности связи служит электрический момент диполя (µ). Он равен произведению эффективного заряда атома на длину диполя: µ = · д.
Электрический момент диполя имеет единицу измерения Кл ·м. Внесистемная единица измерения Дебай (D), равная 3,3 ·10–30 Кл ·м.
укажем приведенные выше характеристики на примере молекулы воды.
| H2O | Длина связи (ОН) 0,0097 нм | 
| Энергия связи (ОН) 450 кДж/моль | Полярность связи (ОН) 1,5 D |
В многоатомных молекулах полный диапольный момент равен векторной сумме дипольных моментов отдельных связей.
Неполярная связь имеет µ = 0,
полярная связь имеет µ = 4D,
ионная связь имеет µ от 4D до 12 D.
С позиции поляризации связи ионная связь – это предельно поляризованная ковалентная связь.
Водородную и металлическую связи можно условно рассматривать как разновидности ковалентной связи. Таким образом, природа химической связи едина!
4.3. Виды и кратность связи
Атомные орбитали перекрываются по разному. С этих позиций различают s- и p- связи.
s- связь возникает при перекрывании АО любой симметрии на линии связи.
Схематическое изображение:
Число образованных s- связей, называется координационным. Атом, А образующий s- связи партнерами (лигандами), называется центральным. Координационное число атома А в молекуле AB4 равно 4.
p- связь образуется при перекрывании р- , d- и f- орбиталей на прямой перпендикулярной линии связи. Схематическое изображение:
p- связь может возникнуть только совместно с s- связью. Число связей соединяющих 2 атома, называется кратностью связи. Кратность связи в молекулах H – H, H2C = CH2, N= N соответственно равна 1, 2, 3.
4.4. Свойства ковалентной связи
К ним относятся насыщаемость, направленность и поляризуемость.
Насыщаемость – это способность атома использовать все свои валентные возможности.
Валентность – это свойство атома элемента присоединять или замещать определенное число атомов другого элемента. Количественно она определяется номером группы в периодической системе Д.И. Менделеева, т.е. от единицы до восьми.
Мерой валентности может служить число химических связей, образуемых данным атомом с другими атомами. В представлении метода валентных связей числовое значение валентности равно числу ковалентной связей, которые образует атом.
Направленность. Атомные орбитали направлены в пространстве, следовательно, и химические связи, возникающие при перекрывании атомных орбиталей, имеют также определенную направленность.
Направленность и валентный угол обусловливают геометрию молекулы. При изучении геометрии молекул было обнаружено два противоречия:
1) отклонение реальных валентных углов от теоретически ожидаемых;
2) равноценность связей, образованных энергетически неравноценными орбиталями. Для объяснения этих противоречий в химию была ведена концепция гибридизации.
Гибридизация АО
Гибридизация АО – это смешивание и выравнивание АО, образующих s-связи, по форме и энергии. Другими словами, это состояние центрального атома, когда из n неравноценных орбиталей образуется столько же равноценных, но гибридных орбиталей.
Гибридная орбиталь имеет форму искаженной гантели . Различают несколько типов гибридизации:
Возможны и другие типы гибридизации, например, sp3d2.
4.5. Геометрия молекул
По типу гибридизации центрального атома можно прогнозировать геометрию несложных молекул. Однако, гибридные орбитали, имеющие пару электронов, не всегда участвуют в образовании связей. Электронная пара, не образующая связь, называется неподеленной. Поэтому одному типу гибридизации может соответствовать несколько видов молекул.
Таблица
Геометрические формы молекул
4.6. Поляризуемость
Поляризуемость – это способность электронов в молекуле и атоме смещаться под действием внешнего электрического поля и зависящая от объема частицы. Молекула или атом могут поляризоваться также под действием других молекул, например партнера по реакции.
Графически поляризуемость изображается прямой или изогнутой стрелкой, направленной к более электроотрицательному атому:
+ +
Н Сl C = O
Полярная связь – это ковалентная связь между атомами с различной электроотрицательностью. При образовании полярной связи область перекрывания электронных облаков смещается в сторону атома с большей ЭО. Например, в молекуле хлороводорда
Чем больше разность величин ЭО связанных атомов, тем больше полярность связи.
Полярность молекулы определяется полярностью связей в этой молекуле и их взаимным расположением. Например в молекуле HCl существует только одна полярная связь. Эта молекула является полярной. В ней есть центр положительного заряда (на атоме Н) и центр отрицательного заряда (на атоме Cl). Полярные молекулы являются диполями. Схематично диполь изображается так:
 |
+
| l |
Количественной характеристикой полярности связи (молекулы) является дипольный момент (µ), равный µ = · l, где – величина заряда, l – длина диполя.
При значительной поляризации возможен даже разрыв связи по гетеролитическому или гомолитическому и механизму:
4.7. Химическая связь, валентность, степень окисления
Химическая связь – сила, удерживающая вместе определенное количество атомов, ионов, молекул. Величина этой силы зависит от электронной конфигурации атомов.
Валентность – это способность атомов образовывать химические связи.
Химическая связь – это физико-химический процесс, а валентность – формальная величина характеристики элемента.
Степень окисления (С.О.) – это условный заряд атома элемента в химическом соединении, определяемый из предположения ионного строения молекулы. Нельзя отождествлять валентность и степень окисления.
Например, валентность атома углерода в нижеприведенных соединения равна 4, а степень окисления различна:
Д.з. Г., с. 115-136, 150-154.
К., с. 35-56.