Задача 1. 1. Основні поняття хімії 6
ЗМІСТ
Вступ. 5
1. Основні поняття хімії 6
2. Стехіометричні поняття. 11
3. Розрахунки за рівняннями хімічних реакцій. 21
ВСТУП
Мета методичного посібника – допомогти вчителю в організації і проведенні самостійної учбової діяльності школярів з метою збільшення частки самостійної праці учнів на уроках, розвитку їх самостійності у навчанні.
Посібником особливо зручно користуватись при проведенні передбачених програмами семінарських занять з питань екологічного виховання.
Задачі для самостійного розв’язання з посібника можна використовувати на розсуд учителя як для поглиблення набутих знань, закріплення вивченого, так і для перевірки результатів навчання.
Здебільшого одна й та сама тема дає змогу розв’язати водночас кілька дидактичних завдань, залежно від поставленої вчителем мети.
Матеріали посібника зручно виконувати під час групової та індивідуальної роботи. При цьому можна пропонувати учням виконувати завдання повністю або частково, згідно з планом роботи на уроці або позаурочного заходу.
Застосовуючи свої знання і здібності, учні можуть виконувати різну кількість завдань. За такої організації роботи відбувається диференціація: одні учні розв’яжуть лише найпростіші задачі, другі – більш складніші, треті – усі завдання. Такий підхід дасть можливість учневі вірно оцінити свої можливості, побачити перспективу зростання своїх знань та умінь.
Залежно від мети, поставленої вчителем, виду роботи, контингенту класу, вчитель може на свій розсуд, відповідно до його майстерності й уподобань, використовувати запропонований матеріал з екологічних питань.
ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Атоми. Молекули. Хімічні елементи. Відносні атомні і молекулярні маси. Маси атомів і молекул. Кількість речовини. Стало Авогадро. Молярна маса.
Приклади розв’язання типових задач
Задача 1.
На висоті 20-30 км над Землею знаходиться шар озону О3, який захищає поверхню Землі від ультрафіолетового випромінювання. Підраховано, що в середньому на кожного мешканця міста Ізмаїл у повітряному просторі над містом припадає по 140 моль озону. Скільки молекул та яка маса озону припадає в середньому на одного мешканця міста?
Дано:
υ (O3) = 140 моль
М (О3) = 48 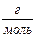
NА = 6,02 · 1023 моль-1
N (О3) - ?
m (О3) - ?
Рішення:
У рішенні задачі використовується рівняння, яке пов’язує між собою число молекул N(О3), кількість речовини υ (O3) і сталу Авогадро NА:
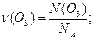
звідки N(O3) = υ (O3) · NA;
N(O3) = 140 · 6,02 · 1023 [моль·моль-1] = 8,43·1025 (молекул)
m(О3) = υ (O3) · М (О3);
m (О3) = 140 г · 48  = 6 720 (г) = 6,72 (кг).
= 6 720 (г) = 6,72 (кг).
Відповідь: у повітряному просторі над містом на кожного мешканця Ізмаїла припадає 6,72 кг озону, або 8,43 · 1025 молекул О3.