ЛАБОРАТОРНАЯ РАБОТА № 7
Тема. Комплексонометрическое определение кальция, магния в воде.
Цель. Ознакомиться с методом комплексонометрического титрования, со способом стандартизации раствора комплексона III, определить содержание кальция и магния в питьевой воде.
Жесткостью воды называется совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальция и магния.
В зависимости от рН и щелочности воды жесткость выше 10°Ж может вызывать образование шлаков в распределительной системе водоснабжения и накипи при нагревании. Вода жесткостью менее 5°Ж может оказывать коррозионное воздействие на водопроводные трубы. Жесткость воды может влиять и на применяемость для потребления человеком с точки зрения ее вкусовых свойств.
Согласно ГОСТ 6055 – 86 различают:
Ø карбонатную жесткость – это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой;
Ø некарбонатную жесткость – совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой;
Ø общую жесткость, складывающуюся из карбонатной и некарбонатной жесткости. Она равна сумме концентраций ионов Са2+, Mg2+, Fе2+.
Количественно жесткость воды выражают единицами жесткости. Для общей жесткости воды она равна сумме молярных концентраций эквивалентов ионов кальция (½Ca2+) и магния (½Mg2+) в воде, т.е. одна единица жесткости соответствует массовой концентрации ионов Са2+, равной 20,4 мг/л или ионов Mg2+, равной 12,15 мг/л. Единицей измерения жесткости являлся моль/м3. Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м3.
При оценке жесткости воды обычно воду характеризуют следующим образом:
| Вода | Жесткость, ммоль/л |
| очень мягкая вода | < 1,5 |
| мягкая вода | 1,5 - 4 |
| вода средней жесткости | 4 - 8 |
| жесткая вода | 8 - 12 |
| очень жесткая вода | > 12 |
Общую жесткость питьевых вод определяют по ГОСТ Р 52407-2005.
Метод определения жесткости основан, на реакции комплекообразования между катионами кальция и магния (катионы жесткости) и полидентатным лигандом - динатриевой солью этилендиаминтетрауксусной кислоты (комплексон III или Трилон Б) при рН = 9 - 10. Комплексон III имеет структуру:
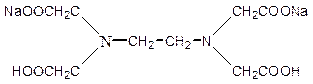
Реакции взаимодействия комплексона III с катионами Са2+ и Мg2+ в аммиачном буферном растворе при рН = 9-10 могут быть выражены уравнением:
Me2+ + HY3- + NH3 ó MeY2- + NH4+
Для титрования с комплексоном III используют металлохромный индикатор - эриохром черный Т (общая формула H3Ind):

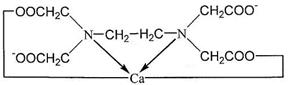
Индикатор при рН =9 - 10 образует с ионами Са2+ и Mg2+ окрашенное в красный цвет комплексное соединение, менее прочное чем комплексонаты кальция и магния:
Me2+ + HInd2– + NH3 ó MeInd– + NH4+
голубой красный
Образующийся комплекс имеет строение:

При титровании раствором комплексона III, комплекс металла с индикатором менее прочный, он разрушается:
MeInd–+ HY3– + NH3 ó MeY2–+HInd2-+NH4+
красный голубой
Таким образом, в точке эквивалентности наблюдают цвет свободного индикатора в аммиачном буфере.
Растворы: раствор комплексона III с концентрацией С(½ Комплексон III) = 0,05 моль/л; стандартный раствор соли цинка(ІІ) с концентрацией С(½ Zn2+) = 0,05000 моль/л; аммиачный буферный раствор с рН 9,5-10; индикаторная смесь эриохрома черного Т с хлористым натрием (1:100).
Стандартизация раствора комплексона III
Аликвоту 10,00 мл стандартного раствора соли цинка переносят в коническую колбу для титрования, добавляют 70 мл дистиллированной воды, 10 мл буферного раствора и около 0,1 г индикаторной смеси эриохрома черного Т. Раствор перемешивают и титруют из бюретки раствором комплексона III до перехода красной окраски раствора в голубую. Титрование повторяют несколько раз.
Молярную концентрацию раствора комплексона III рассчитывают по формуле:
| С (½ Комплексона III) = | С(½Zn2+)·V(Zn2+) |
| VкомплексонаIII |
где С(½Zn2+) – молярная концентрация эквивалента стандартного раствора соли цинка, моль/л;
V(Zn2+) – объем аликвоты стандартного раствора цинка, мл;
VкомплексонаIII – объем раствора комплексона III, пошедший на титрование.
Определение общей жесткости воды комплексонометрическим методом
ОТБОР ПРОБ
Общие требования к отбору проб - по ГОСТ Р 51592 и ГОСТ Р 51593.
Пробу анализируемой воды отбирают в емкость, изготовленную из полимерных материалов или стекла. Срок хранения пробы воды - не более 24 ч.в. Отбор пробы производится после спуска воды в течение не менее 15 минут при полностью открытом кране. Объем пробы воды для определения общей жесткости должен быть не менее 400 мл. Для увеличения срока хранения пробы и для предотвращения осаждения из воды карбонатов кальция (что характерно для подземных или бутилированных вод) пробу подкисляют соляной кислотой до рН < 2. Контроль рН проводят по универсальной индикаторной бумаге или с использованием рН-метра. Срок хранения подкисленной пробы воды - не более одного месяца.
В коническую колбу для титрования вносят 100 мл испытуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой. Затем прибавляют 5 мл аммиачного буферного раствора, приблизительно 0,1 г сухого индикатора эриохрома черного Т и сразу же титруют при сильном взбалтывании 0,05 М раствором комплексона ІІІ до изменения окраски в эквивалентной точке из красной в синюю с зеленоватым оттенком.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной для титрования, до внесения реактив следует прибавить 5 капель 1%-ного раствора солянокислого гидроксиламина и далее определяют жесткость, как указано выше.
Если титрование приобретает крайне затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдается при высокой щелочности воды, ее влияние устраняется прибавлением к пробе воды, отобранной для титрования, до внесения реактивов 0,1н раствора HCl в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением или продуванием раствора воздухом в течение 5 мин. После этого прибавляют буферный раствор, индикатор и далее определяют жесткость, как указано выше.
Запись в лабораторном журнале:
Объем аликвоты воды, зятой для анализа V(Н2О) = 100,0 мл
Концентрация раствора титранта C(½ Комплексона III)·= _,_ _ _ _ моль/л
Объем раствора титранта, пошедший на титрованиеVкомплексонаIII (1) =_ _,_ _ мл
VкомплексонаIII (2) =_ _,_ _ мл
VкомплексонаIII (3) =_ _,_ _ мл
VкомплексонаIII (среднее)=_ _,_ _ мл
Общую жесткость воды С(½Ca2+, ½ Mg2+) в ммоль/л (°Ж) вычисляют по формуле:
| С(½Ca2+, ½ Mg2+) = | C (½ Комплексона III)·VкомплексонаIII·1000 |
| Vводы |
где C (½ Комплексона III) - концентрация раствора комплексона ІІІ, рассчитанная при стандартизации раствора титранта, моль/л;
VкомплексонаIII – среднее значение объема раствора комплексона ІІІ, израсходованного на титрование, мл;
Vводы - объем воды, взятый для определения, мл.
Расхождения между повторными определениями не должно превышать 2 отн.%.
Литература
1. ГОСТ Р 52407-2005. Вода питьевая. Методы определения жесткости. – М.: Стандартинформ, 2006. -
2. Шевчук И.А., Симонова т.Н., Рокун А.Н. Практикум по аналитической химии: гравиметрический и титриметрический методы в анализе природных и промышленных объектов. – Донецк: Изд-во «Вебер» (Донецкое отделение), 2009. – 392 с.
3. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. - М.:Химия, 1990. - Т.1. - С.273 - 291.