Химическое строение и физико-химические свойства местных анестетиков
Подавляющее большинство местных анестетиков представляет собой амфифильные молекулы, содержащие липофильную (ароматическую) и гидрофильную (амидную) группировки, которые соединены эфирной или амидной связью. Важнейшими факторами, которые определяют действие местных анестетиков являются:
· Липофильность – чем более крупные липофильные заместители содержит молекула тем выше его сила и длительность действия. Считают, что это связано с тем, что липофильные молекулы образуют депо в липидах мембраны нервных клеток. Одновременно с силой липофильность повышает и токсичность местных анестетиков.
· Размеры молекулы – они определяют скорость взаимодействия местного анестетика с мишенью действия. Чем меньше размеры молекулы, тем большая частота взаимодействия местного анестетика с молекулами-мишенями.
Все местные анестетики являются слабыми основаниями, поэтому, чтобы повысить устойчивость их растворов, обычно их готовят в форме кислых солей (гидрохлоридов). pKBH+ большинства местных анестетиков лежит в пределах 8,0-9,0 и степень ионизации их молекул зависит от соотношения рН среды организма и pKBH+ анестетика. В нормальной ткани, при рН=7,3-7,4 только 3-24% анестетика находится в неионизированном липофильном состоянии и может проникать через мембрану клетки к ее внутренней стороне, где он оказывает свое действие[2]. Впрочем, даже такого небольшого количества молекул достаточно для реализации их действия.
Внутри клетки среда более кислая (рН=6,0-7,0) за счет интенсивно протекающих процессов гликолиза. В таких условиях неионизированными остаются лишь 0,1-1,0% молекул, а остальные 99,0-99,9% лекарства уже не могут покинуть нервное волокно. В воспаленной ткани происходит смещение рН среды в кислую сторону (за счет выделения клетками биологически активных веществ, органических кислот, появления продуктов цитолиза) и она сравнивается с внутриклеточным рН. В таких условиях количество ионизированных молекул местного анестетика во внеклеточной среде резко возрастает до 99,0-99,9% и он уже не в состоянии проникнуть через мембрану нервного волокна для реализации анестезирующего действия. Поэтому неудивительно, что инфильтрационная анестезия абсцессов, флегмон, гнойно-септических очагов челюстно-лицевой области неэффективна и хирурги обычно прибегают к проводниковой анестезии тканей на удалении от очага воспаления.
МД: Считают, что основным механизмом действия местных анестетиков является их способность блокировать натриевые каналы мембран клетки.
Натриевые каналы представляют собой олигомерные белки, состоящие из a, b1 и b2-субъединиц. Основой канала служит a-субъединица, которая формирует пору. Внутри поры имеются 2 воротных механизма – активационный и инактивационный. В состоянии покоя мембрана возбудимых клеток поляризована, ее потенциал »-90¸-60 мВ и в канале закрыты активационные (m) ворота и открыты инактивационные (h) ворота. Такое состояние предупреждает поступление ионов Na+ в клетку (состояние I или состояние покоя, схема 1).
При прохождении нервного импульса или действия раздражителя возникает пороговая деполяризация, которая открывает m-ворота и в клетку устремляется поток Na+ (состояние II).
Поступление натрия деполяризует мембрану и обеспечивает генерацию и распространение потенциала действия на данный участок мембраны. Одновременно, деполяризация начинает медленно закрывать h-ворота и канал постепенно инактивируется, ток натрия прекращается (состояние III).
В это время начинается реполяризация мембраны за счет утечки ионов K+ из клетки по K+-каналам и работы Na+/K+-АТФазы. Реполяризация способствует возвращению m-ворот в закрытое состояние (состояние IV), после чего h-ворота открываются и канал вновь переходит в состояние покоя.
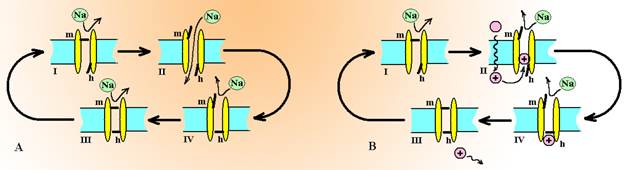
Схема 1. Цикл функционирования Na+-каналов клетки.
А – работа каналв в физиологических условиях: I – состояние покоя, II – активное состояние канала, III-IV – состояние инактивации, m – акивационные ворота, h – инактивационные ворота.
В – работа канала при аппликации местного анестетика. Молекулы анестетика проникают внутрь клетки и подвергаются ионизации, после чего блокируют канал в области инактивационных ворот в момент открытия канала. Блокада канала продолжается до его перехода в фазу полной инактивации IV.
Молекулы местных анестетиков в неионизированной форме проникают через мембрану клетки в цитоплазму, где они протонируются и по водной фазе заходят в устье канала с внутренней стороны в момент его активации (состояние II). Работа канала при этом блокируется, а ток ионов Na+ в клетку прекращается. Связь местного анестетика с каналом сохраняется и в состоянии инактивации (состояние III), при этом лекарство крайне медленно освобождает канал и состояние его инактивации затягивается в 10-1.000 раз. Канал перестает реагировать на повторные нервные импульсы.
Т.о. местные анестетики блокируют открытые и инактивированные каналы, продлевая состояние их инактивации.
ФЭ:
1. Локальное местноанестезирующее действие. Связано с действием анестетика в месте введения. Характеризуется блокадой мембран рецепторов, нервных волокон и ганглиев под влиянием местного анестетика. При инъекции в ткани анестетик вначале выключает вегетативные рефлексы, затем болевую чувствительность, температурную и наконец тактильное чувство и чувство давления. Последними выключаются проприоцептивныая чувствительность и произвольные движения (двигательные нервы). Если нанести анестетик на слизистую оболочку рта и языка, то первыми исчезают ощущения горечи, затем сладкого и кислого, последним утрачивается чувство соленого. Такое действие лекарств зависит от нескольких факторов:
[ Диаметра нервного волокна и его миелинизации. Чем меньше диаметр нервного волокна, тем меньше площадь его мембраны и расстояние между точками проведения – требуется меньшая концентрация анестетика, чтобы нарушить распространение импульса. Напротив, толстые нервные проводники имеют большую площадь мембраны, узлы проведения лежат в них далеко и требуется значительное количество анестетика, чтобы блокировать нерв. Миелинизация нерва усиливает его чувствительность к блокаде, т.к. достаточно нарушить проведение на небольшом участке нерва – 2-3 перехвата Ранвье – чтобы вызвать блок.
[ Потенциала нервного волокна и частоты импульсации. Чем более низок потенциал волокна, тем более оно чувствительно к действию анестетика, т.к. при снижении потенциала большее число Na+-каналов может переходить в инактивированное состояние, которое и стабилизируют местные анестетики. Аналогично, при увеличении частоты импульсации нерва, его чувствительность к анестетику возрастает, т.к. большое количество Na+-каналов находится в каждый момент времени в открытом состоянии. Волокна вегетативных и чувствительных нервов генерируют длительные (более 5 мс) потенциалы действия с высокой частотой, тогда как моторные нервы генерируют низкочастотные ультракороткие потенциалы (менее 0,1 мс) и поэтому более резистентны к действию анестетика.
[ Положения нервных волокон в нервных стволах. Как правило, в нервном стволе снаружи расположены двигательные волокна, затем лежат проксимальные и в самом центре – дистальные чувствительные нервы. Очевидно, что в этом случае, при проводниковой анестезии крупного ствола первым пропадет двигательная активность, затем будет исчезать перцептивная чувствительность в направлении от центра (места инъекции) к периферии.
Чувствительность различных нервных волокон к местным анестетикам (без учета их локализации в нервном стволе) представлена в таблице 3.
Таблица 3. Влияние местных анестетиков на нервные волокна
(по Carpenter & MacKey, 1992 с изм.)
| Тип | Функция | Диаметр, мкм | Миелинизация | Чувствительность к анестетикам |
| A-тип Aa Ab Ag Ad | Двигательная (эфферентные), проприорецепция (афферентные) Давление, тактильная (афферентные) Работа мышечных веретен, сухожильный рефлекс (афферентные) Боль, температура (афферентные) | 6-22 5-12 3-6 1-4 | Ê Ê Ê Ê | Ê ÊÊ ÊÊ ÊÊÊ |
| B-тип | Преганглионарные вегетативные | <3 | Ê | ÊÊÊÊÊ |
| C-тип | Постганглионарные, афферентные корешки | 0,3-1,3 | ÊÊÊÊ |
2. Резорбтивное действие местных анестетиков. Связано с поступлением местноанестезирующих средств в системный кровоток и рассматривается в целом как нежелательное действие. В основе резорбтивного действия местноанестезирующих средств также лежит их влияние на Na+-каналы мембран клеток.
[ Нарушение функций ЦНС[3]. Связано с угнетением возбудимости мембран нейронов, под влиянием местноанестезирующих средств. Влияние анестетиков на ЦНС двухфазное – вначале подавляется работа тормозных нейронов и развивается беспокойство, тремор, эйфория, клонические подергивания мышц. Затем, угнетается работа возбуждающих нейронов и возникает сонливость, утрата сознания, нарушения работы дыхательного центра.
[ Миокард. Местноанестезирующие средства способны блокировать Na+-каналы проводящей системы сердца и рабочего миокарда. Это приводит к замедлению генерации в них импульсов, снижению возбудимости и проводимости с развитием брадикардии, уменьшением силы сердечных сокращений. В тяжелых случаях возможно развитие аритимй и сердечной недостаточности под влиянием анестетиков. Действие местноанестезирующих средств на миокард проявляет четкую частотную зависимость и реализуется тем сильнее, чем выше частота сердечных сокращений. Данная особенность действия анестетиков положена в основу их применения как антиаритмических средств при тахиаритмиях.
[ Сосуды. За счет блокады проведения импульсов по симпатическим сосудосуживающим нервам местные анестетики расширяют артериальные сосуды, что приводит, с одной стороны, к гипотензии, а с другой, - ускоряет их абсорбцию в системный кровоток и укорачивает продолжительность местной анестезии. Данный нежелательный эффект легко устраним добавлением к раствору местноанестезирующих средств сосудосуживающих веществ – эпинефрина (из расчета 1:50.000-1:200.000 или 1 капля 0,1% раствора на 10 мл анестетика), фенилэфрина (1:20.000). Такое совместное применение местноанестезирующих средств и симпатомиметических аминов имеет несколько отличительных черт:
· Сосудосуживающие средства в 1,5-2,0 раза увеличивают длительность анестезии, за счет замедления абсорбции анестетика из места введения;
· Снижается токсичность местноанестезирующих средств, т.к. их концентрация в системном кровотоке уменьшается;
· Инъекция анестетиков становится более болезненной;
· Повышается риск локальной ишемии ткани в месте инъекции, снижается скорость заживления раны, т.к. сосудосуживающие агенты ухудшают доставку кислорода в ткани.
[ Аллергогенность. Местноанестезирующие средства (особенно эфирной структуры) достаточно часто провоцируют аллергические реакции в виде крапивницы, дерматита, отека Квинке, бронхоспазма и анафилактического шока. При развитии гиперчувствительности у пациента, она, как правило, носит перекрестный характер, т.е. проявляется ко всем местноанестезирующим средствам эфирного строения.
Таблица 4. Сравнительная характеристика местных анестетиков
| Лекарство | Сила* | Токсичность* | Длительность§ |
| Прокаин Бензокаин Тетракаин Лидокаин Артикаин Бупивакаин | 0,5 | 30 мин 30 мин 2-3 часа 1 час 1-2 часа 7-14 часов |
Примечание:
* - в относительных единицах, по сравнению с прокаином;
§ - при инфильтрационной или поверхностной (для бензокаина и тетракаина) анестезии
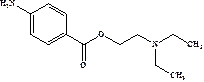 Прокаин (Procaine, Novocain) Первый синтетический местный анестетик, внедрен в клиническую практику в 1905 г. До конца XX в. оставался одним из широко применявшихся анестетиков ввиду малой токсичности. По активности (силе) уступает другим анестетикам. Действует непродолжительно, т.к. подвергается быстрому гидролизу псевдохолинэстеразой крови и эстеразами печени. В процессе гидролиза образуется пара-аминобензойная кислота, которая ослабляет действие сульфаниламидных средств, поэтому прокаин нерекомендуется применять у пациентов, которые проходят лечение сульфаниламидными средствами.
Прокаин (Procaine, Novocain) Первый синтетический местный анестетик, внедрен в клиническую практику в 1905 г. До конца XX в. оставался одним из широко применявшихся анестетиков ввиду малой токсичности. По активности (силе) уступает другим анестетикам. Действует непродолжительно, т.к. подвергается быстрому гидролизу псевдохолинэстеразой крови и эстеразами печени. В процессе гидролиза образуется пара-аминобензойная кислота, которая ослабляет действие сульфаниламидных средств, поэтому прокаин нерекомендуется применять у пациентов, которые проходят лечение сульфаниламидными средствами.
Прокаин лишен поверхностной местноанестезирующей активности, т.к. очень плохо проникает в толщу кожи и слизистых. Оказывает слабое М-холиноблокирующее, ганглиоблокирующее и Н1-гистаминоблокирующее действие.
Показания к применению и режимы дозирования:
1. В анестезиологической практике для выполнения местной анестезии: инфильтрационной (0,25-0,5% растворы), проводниковой (1-2% растворы), эпидуральной (2% раствор).
2. При лечении ожогов ЖКТ, вызванных коррозивными ядами, язвенной болезни желудка и 12-перстной кишки с тяжелым болевым синдромом 0,25-0,5% растворы по 30-40 мл внутрь.
3. Лечение анальных трещин, симптоматическая помощь при геморрое – по 1 свече 2-3 раза в день.
4. Прокаин используют как растворитель некоторых антибиотиков для уменьшения болезненности в процессе инъекции (0,25-0,5% растворы).
Максимальная безопасная доза прокаина при инъекционном введении составляет 700-750 мг.
ФВ: растворы 0,25 и 0,5% в ампулах по 1, 2, 5 10 и 20 мл, 1 и 2% в ампулах по 1, 2, 5 и 10 мл, 0,25 и 0,5% во флаконах по 200 и 400 мл, мазь 5 и 10%, суппозитории 100 мг.
Тетракаин (Tetracaine, Dicain) Можно рассматривать как N-бутилзамещенный прокаин. Введение заместителя сопровождается повышением липофильности и активности молекулы (более чем в 10 раз). Однако, одновременно возрастает и токсичность тетракаина.
 Метаболизм тетракаина протекает подобно прокаину, однако, скорость его значительно ниже, поэтому действие тетракаина более длительное.
Метаболизм тетракаина протекает подобно прокаину, однако, скорость его значительно ниже, поэтому действие тетракаина более длительное.
Применение и режим дозирования. Ввиду высокой токсичности, тетракаин применяют в основном для терминальной анестезии при офтальмохирургических вмешательствах, измерении внутриглазного давления в виде 0,25-2,0% глазных капель. Глазные пленки назначают при лечении язвы роговицы, герпеса глаз (для купирования болевого синдрома).
В ЛОР-практике при выполнении хиругических вмешательств прибегают к орошению слизистых 2-3 мл 0,5-1,0% раствора.
Иногда тетракаин используют для спинальной анестезии (1 мл 1% раствора).
Максимально безопасная доза тетракаина составляет 100 мг. Ввиду высокой токсичности, все растворы тетракаина в обязательном порядке должны содержать сосудосуживающие средства.
ФВ: порошок для приготовления 0,25-2,0% растворов, глазные пленки 0,75 мг
 Бензокаин (Benzocaine, Anesthezin) Является дездиэтиламино-прокаином. Устранение диэтиламиновой части молекулы не позволяет бензокаину образовывать хлористоводородные соли, поэтому он практически не растворим и применяется, как правило, наружно. При нанесении на кожу и слизистые бензокаин не всасывается и обеспечивает длительную терминальную анестезию, расположенных в ней окончаний.
Бензокаин (Benzocaine, Anesthezin) Является дездиэтиламино-прокаином. Устранение диэтиламиновой части молекулы не позволяет бензокаину образовывать хлористоводородные соли, поэтому он практически не растворим и применяется, как правило, наружно. При нанесении на кожу и слизистые бензокаин не всасывается и обеспечивает длительную терминальную анестезию, расположенных в ней окончаний.
Показания для применения и режимы дозирования:
1. Лечение зудящих дерматозов, терминальная анестезия при язвах, анальных трещинах, эрозиях – используют мази на основе бензокаина, аэрозоли, суппозитории.
2. Купирование болевого синдрома при гастродуоденитах, язвенной болезни ЖКТ - назначают в виде таблеток 2-4 раза в день. Иногда таблетки бензокаина применяют при лечении икоты, тошноты и рвоты.
НЭ: Низкая системная абсорбция предполагает и низкую токсичность бензокаина. Однако, в медицинской литературе имеются сообщения о развитии метгемоглобинемии у пациентов, получающих чрезмерно высокие дозы бензокаина. Может вызвать перекрестную сенсибилизацию к другим анестетикам эфирной структуры.
ФВ: порошок, таблетки по 300 мг, мазь 5%, комбинированные средства – таблетки «Bellalgin», суппозитории «Anaesthesol», аэрозоль «Dentispray».
 Лидокаин (Lidocaine, Xylocaine) Был первым анестетиком амидной структуры, внедренным в 1948 г в клиническую практику. Отличается быстрым началом действия и достаточно длительным сохранением эффекта. Он значительно превосходит прокаин по активности, но лишь незначительно токсичнее его.
Лидокаин (Lidocaine, Xylocaine) Был первым анестетиком амидной структуры, внедренным в 1948 г в клиническую практику. Отличается быстрым началом действия и достаточно длительным сохранением эффекта. Он значительно превосходит прокаин по активности, но лишь незначительно токсичнее его.
Особенности метаболизма. В отличие от анестетиков эфирной структуры лидокаин не подвергается действию эстераз. Основными метаболизирующими его ферментами являются микросомальные печеночные оксидазы. Активность данных ферментов в отношении лидокаина столь высока, что практически 100% леакрственных средств разрушается при первом прохождении через печень. В процессе метаболизма из лидокаина образуется моноэтилглицинксиламид и глицинксиламид. Эти соединения обладают некоторой местноанестезирующей активностью.
Особенности фармакологических эффектов. Для лидокаина характерна не только местноанестезирующая активность, но и четко выраженное противоаритмическое действие, которое связано с его влиянием на Na+-каналы миокарда желудочков. Способность лидокаина блокировать Na+-каналы миокарда проявляется только при высокой ЧСС, когда частота поступления импульсов совпадает с частотой блокирования-деблокирования канала лидокаином. При нормальной частоте сердечных сокращений противоаритмическое действие лидокаина практически не проявляется[4].
Показания для применения и режим дозирования:
1. В анестезиологической практике растворы лидокаина применяют для инфильтрационной (0,25-0,5%), проводниковой анестезии (0,5-2,0%), спинальной (2,0-5,0%). Для терминальной анестезии при выполнении фибробронхоскопии, фиброгастродуоденоскопии, хирургических манипуляций на орофарингеальной зоне применяют 5% растворы и 10% аэрозоли. Максимальная безопасная доза лидокаина составляет 500 мг.
2. В кардиологической практике 1 и 2% растворы применяют для лечения желудочковых тахиаритмий путем внутривенного и внутримышечного введения[5].
НЭ: Лидокаин редко вызывает реакции гиперчувствительности, не обладает перекрестной сенсибилизацией с местными анестетиками эфирной структуры. Однако, для лидокаина характерно нейротоксическое резорбтивное действие, которое обусловлено, в значительной мере, метаболитами лидокаина.
ФВ: раствор 1% в ампулах по 10 мл, 2% в ампулах по 2 и 10 мл, 10% в ампулах по 2 мл, аэрозоль 10% во флаконах по 38 и 50 мл.
Бупивакаин (Bupivacaine, Anekain, Marcaine) Отличается от лидокаина рядом особенностей:
·  Превосходит по своей активности лидокаин. Отличается длительным действием, что обусловлено наличием анестезирующей активности не только у бупивакаина, но и у его метаболитов.
Превосходит по своей активности лидокаин. Отличается длительным действием, что обусловлено наличием анестезирующей активности не только у бупивакаина, но и у его метаболитов.
· В отличие от других анестетиков, бупивакаин в меньшей степени вызывает моторную блокаду, по сравнению с блоком проведения по афферентным нервам.
· Бупивакаин характеризуется выраженной кардиотоксичностью. В отличие от лидокаина, он способен блокировать Na+-каналы миокарда и нарушать проведение импульсовне только при тахиаритмиях, но и при нормальной частоте сердечных сокращений. Это связано с тем, что бупивакаин крайне медленно диссоциирует из связи с каналом и блокада сохраняется к моменту поступления очередного импульса. Бупивакаиновые аритмии очень устойчивы и с трудом поддаются лечению.
Показания к применению и режимы дозирования. В анестезиологической практике бупивакаин применяют для проведения инфильтрационной (0,25% раствор), проводниковой (0,25-0,5% растворы), эпидуральной (0,5-0,75% растворы) анестезии. Максимальная безопасная доза бупивакаина составляет 150 мг (при условии совместного применения с сосудосуживающими средствами).
ФВ: раствор 0,5% во флаконах по 20 мл.
Артикаин (Articaine, Ultracain, Citocartin, Ubistesin) По своим характеристикам занимает промежуточное положение между лидокаином и бупивакаином. Отмечается высокой активностью, длитель  ным действием и низкой токсичностью. Артикаин плохо проникает через гистогематические барьеры, что связано с его высокой константой ионизиации (при рН организма он ионизирован на 90%), поэтому его предпочитают использовать в акушерско гинекологической практике, т.к. он не проникает через плаценту в организм плода.
ным действием и низкой токсичностью. Артикаин плохо проникает через гистогематические барьеры, что связано с его высокой константой ионизиации (при рН организма он ионизирован на 90%), поэтому его предпочитают использовать в акушерско гинекологической практике, т.к. он не проникает через плаценту в организм плода.
Применение в медицинской практике и режим дозирования. Артикаин в медицинской практике в виде 0,25-0,5% растворов применяют для инфильтрационной и проводниковой анестезии при выполнении стоматологических и акушерских вмешательств. Иногда его используют для спинальной анестезии. Максимальная безопасная доза артикаина составляет 500 мг.
ФВ: раствор 4% в ампулах по 2 мл и картриджах по 1,7 мл с добавлением 0,06% или 0,12% раствора эпинефрина