Токсическое действие соединений бора, алюминия и таллия на живой организм
Избыток бора вреден для организма человека, так как угнетает ферменты амилазы, протеиназы, уменьшает активность адреналина (соединения фенольной природы), с которым борная кислота образует прочные комплексы. Употребление пищевых продуктов с большим содержанием бора нарушает в организме обмен углеводов и белков, что приводит к возникновению эндемических кишечных заболеваний – энтеритов. При попадании в организм через желудочно-кишечный тракт вызывает тошноту, оказывает вредное действие на ЦНС, симптомы которого описаны под названием «боризм». При отравлении появляются тетонические судороги, чувство страха.
Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветворении.
Для выведения из организма солей борной кислоты применяют жидкую магнезию (водная суспензия оксида магния МgO):
МgO + 2НС1 ® МgС12 + Н2О
МgС12 + Nа2В4О7 ® МgВ4О7 + 2NаС1
Противоядием при отравлении солями алюминия (Аl3+) является гидрофосфат натрия (Nа2НРО4):
Al3+ + Na2HPO4 ® AlPO4¯ + 2Na+ + H+
Таллий относится к очень токсичным элементам. Ион Тl+ образует прочные соединения с серусодержащими лигандами. Это приводит к подавлению активности ферментов, содержащих сульфгидрильные группы –SН. Образование прочных соединений объясняет теория Пирсона (ЖМКО): Тl+ − мягкая кислота реагирует с мягким основанием R–S–H
R–S–H + Tl+ ® R–S–Tl + H+
м.о. м.к.
Даже весьма незначительные количества соединений Тl+ при попадании в организм вызывают выпадение волос. В качестве противоядия при отравлении ионами Тl+ используют аминокислоту цистеин HS-CН2-СН-(NH2)-СООН:
Тl+ + HS–CН2–СН–(NH2)–СООН ® Tl–S–CН2–СН–(NH2)–СООН + H+
Для качественного обнаружения соединений бора, алюминия и таллия используются осадочные реакции или реакции получения продуктов с ярко-выраженной окраской.
Для бора:
Nа2B4О7 + Н2SО4 (конц.) + 5Н2О ® Nа2SО4 + 4Н3ВО3
Н3ВО3 + 3C2H5OH 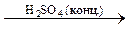 B(OC2H5)3 + 3H2O
B(OC2H5)3 + 3H2O
B(OC2H5)3 – борноэтиловый эфир при горении окрашивает пламя в зелёный цвет.
Для алюминия:
4Al(OH)3 + 2Co(NO3)2 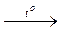 2Сo(AlO2)2 + 4NO2 + O2 + 6H2O
2Сo(AlO2)2 + 4NO2 + O2 + 6H2O
тенарова синь
Для таллия:
2TlCl + K2Cr2O7 ® Tl2Cr2O7¯ + 2KCl
Tl2Cr2O7 − осадок оранжево-красного цвета.
Предельно-допустимые концентрации (ПДК) алюминия и бора законодательством России не регламентированы. ПДК для бора ориентировочно находится в пределе 30 мг/л. Летальная доза соединений бора для взрослых составляет 15-20 г, а для детей 5-6 г. В опытах на белых крысах и кроликах безвредной для алюминия является доза 1 мг/кг веса или концентрация 20 мл/л в расчете на алюминий. Для наиболее токсичной соли Аl(NO3)3 летальная доза LД50 составляет 264 мг/кг.
ПДК для таллия в питьевой воде не установлена, учитывая его высокую токсичность не допускается присутствие следов соединений таллия. Летальная доза LД50 = 32 мг/кг в расчете на ион таллия.
Тема II. р-Элементы IV группы: углерод, кремний, олово, свинец