Донорлы- акцепторлы байланыс
ФГЗ жне химия кафедрасы
СЖ
Таырыбы:Органикалы осылыстарды химиялы байланыс трлері жне оларды негізгі сипаттамасы. Бір, екі, ш хиральды орталыы бар молекулаларды стереоизомерлері.
Орындаан: Келдібек А.
Тобы: 203 «Б» ФК
Шымкент 2015 ж
ЖОСПАР
І. Кіріспе
ІІ. Негізгі блім
1. Органикалы осылыстарды химиялы байланыс трлері жне оларды негізгі сипаттамасы.
2. Органикалы осылыстарды кеістіктегі рылысы (стереоизомерия)
3. Органикалы заттарды кеістіктегі рылысы мен биологиялы белсенділігіні арасындаы байланыс.
ІІІ. орытынды
ІV. Пайдаланылан дебиеттер
Кіріспе
Атомдар арасында химиялы байланысты туындауына байланысты олар молекулаа бірігеді. Ядроларды арасындаы кеістікте электронды блт тыыздыыны артуы ядроларды тартады, жаындатады жне электрондарды потенциалды энергиясын, бтіндей барлы жйені энергиясын да тмендетеді.
Химиялы байланыс молекулаларды орбиталдар тзе жретін екі немесе одан да кп атомды орбиталдарды рекеттесуі кезінде арастырылады.
Е арапайым, жай жадайда химиялы байланыс екі электронмен тзіледі, пайда болады немесе туындайды.
рылымды изомерлер- рамы бірдей, біра тізбекті немесе саинаны рылысы, ос немесе ш байланысты болуы, функционалды топтар мен радикалдар рылысыны згешелігіне байланысты болатын изомерлер.
Стереоизомерлер- рамы мен рылысы бірдей, біра атомдарды кеістіктегі орналасу айырмашылыы бар изомерлер.
Барлы стероизомерлер энантиомерлерге жэне диастереомерлерге блінеді.
Органикалы осылыстарды химиялы байланыс трлері жне оларды негізгі сипаттамасы.
Атомдар арасында химиялы байланысты туындауына байланысты олар молекулаа бірігеді. Химиялы байланыс пайда боланда энергия блінеді де жйе барынша кіші энергияа ие. А + В = АВ
Химиялы байланыса сйкес:
Ядроларды арасындаы кеістікте электронды блт тыыздыыны артуы ядроларды тартады, жаындатады жне электрондарды потенциалды энергиясын, бтіндей барлы жйені энергиясын да тмендетеді.
Химиялы байланыс молекулаларды орбиталдар тзе жретін екі немесе одан да кп атомды орбиталдарды рекеттесуі кезінде арастырылады.
Е арапайым, жай жадайда химиялы байланыс екі электронмен тзіледі, пайда болады немесе туындайды.
рекеттесуші реагенттері энергияларыны айырмасына туелділікте, тр- трпаты бойынша не реагенттер мен орбитальдар арасында орташа болатын, не реагенттерді біреуінде басымыра сас болатын молекулааралы орбитальды тзілуі ммкін. Сондытан да дипольды моментпен немесе полярлы шамасымен сипатталатын сан алуан химиялы байланыс трін ( ионды, коваленттік жне иондытан бастап коваленттікке дейінгі спектрді брі) кп болуы ммкін.
Электростатикалы тартылу есебінен иондар арасында тзілетін байланысты ионды деп атайды.
Негізінен органикалы иондар химиялы байланысты гетеролизі (бліміне ыдырауы, ажырасуы) нтижесінде тзіледі.
Коваленттік байланыс.
Коваленттік байланыс рекеттесуін атомдар здеріні электронын бірінен- бірі беріп, екеуіне бірдей, электрон жбын тзеді, мысалы А+ В = А – В.
Полюссіз ковалентті байланыс молекулалы орбитальдар дісі бойынша электрондарда бірдей энергия болатын атомдар рекеттескенде тзіледі.
Хлор молекуласыны тзілуі полюссіз коваленттік байланысты тзілуіне тн мысал болады: Cl + Cl Cl – Cl
Егер байланысты тзілуіне атынасатын электрондарды энергетикалы дегейі зара те болмай жне ол айырмашылы аса лкен емес, болмашы ана мысалы, арапайым жадайда электртерістілік (А В) сияты болса, онда электронды тыызды А мен В ядроларыны арасында бірдей тедікте таралмайды. Ол электртерістігі арты болатын атом жаына ыысады. Мндай жадайдаы химиялы байланыс дипольдік моментпен сипатталатын полюске айналады, яни байланыс полюсті болады. H + Cl = H 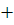 Cl
Cl 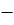
Байланысты полюстігі электронды тыыздыты бірдей, біркелкі, тедей таралмауымен байланысты.
Донорлы- акцепторлы байланыс.
Коваленттік байланыс пайда боланда рбір атом оны тзілуі шін бір электронын береді. Нтижесінде екі ядро рісінде жылжитын спиндері арсы баытта баытталан электрондар туындайды. Біра та химиялы байланыс баса жолмен де туындауы ммкін, айталы бір атомдар электронды жбы блінбеген , ал басасында бос радикал бар болан жадайда. Мндай байланысты донорлы- акцепторлы дейді. А: + В А- В ( Бос радикал).
NH3 + HCl [NH4]+Cl-
Сутектік байланыс.
Сутектік байланыс донорлы- акцепторлы байланысты бір трі. Электртерістілігі жоары атомдармен ( N, O, F) байланысан сутек атомында рашанда электрон жетіспегендктен, ол баса атомдардаы блінбегн жбымен рекеттесе алады.
2. Органикалы осылыстарды кеістіктегі рылысы
(стереоизомерия)
А.М.Бутлеровты химиялы рылыс теориясы (1861ж.) бойынша –рамы бірдей, біра рылысы ртрлі осылыстарды, сол себептен химиялы жне физикалы асиеттері ртрлі осылыстарды - изомерлер деп атайды. Изомерлер- рылымды жне стероизомерлер (кеістіктік) болып екіге блінеді.
рылымды изомерлер- рамы бірдей, біра тізбекті немесе саинаны рылысы, ос немесе ш байланысты болуы, функционалды топтар мен радикалдар рылысыны згешелігіне байланысты болатын изомерлер.
Стереоизомерлер- рамы мен рылысы бірдей, біра атомдарды кеістіктегі орналасу айырмашылыы бар изомерлер.

Конфигурация - а-байланыс бойындаы айналудан туындайтын згерістерді еске алмайтын, атомдарды кеістікте орналасу тртібі.

Кміртек атомыны стереохимиялы ерекшеліктеріне байланысты (Вант-Гофф, 1874) органикалы осылыстарды гибридтену трлері- тетраэдрлы, брышты жэне тузу конфигурация.™ болып блінеді.
Барлы стероизомерлер энантиомерлерге жэне диастереомерлерге блінеді.
Энантиомерлер- бір-бірімен беттеспейтін молекулаларды айнадаы бейнесі (оптикалы белсенді). Энантиомерлерді физикалы жэне химиялы асиеттері бірдей, тек ана оптикалы белсенділіктері р-трлі.
Бізді оршаан заттарды, оларды симметрия элементтеріні болу немесе болмауына байланысты -хиралды жэне ахиралды болып блінеді.
зіні айнадаы бейнесіне сэйкес келмейтін затты ерекшелігін -хиральдыц (грекше сеіг- ол) деп атайды. Хиралды молекулаларды симметрия жазыы жне орталытары болмайды, тек симметрия осі ана болады. Осы осьті 180° бранда молекула бастапы кйіне айта келеді.
Органикалы молекулаларды рамында бір немесе бірнеше хираль немесе ассимметриялыц орталытары болады. Затты оптикалы белсенділік крсетуіні бір белгісі молекуланы рамындаы ассимметриялы кміртегі атомдарыны болуына байланысты. Бір немесе бірнеше хираль орталыы боланмен де кейбір молекулаларда (мезошарап ышылы, цистин жне т.б.), симметрия жазытыы пайда болып, ол ахиралды болады.
Ассимметриялы кміртегі деп кміртек атомыны трт валенттілігі трт трлі орынбасарлармен байланысан атомды айтады. Ассимметриялы кміртегі) «ждцызшамен» белгіленеді - (С*).

Оптикалы белсенді молекулаларды конфигурациясын аныктау шін глицерин альдегидін лгі ретінде одцанады. Глицерин альдегидіні екінші кміртек (С-2) атомы асимметриялы, себебі ол трт трлі орынбасарлармен: -СНО, -СН2ОН, -ОН, -Н байланысан. Демек, глицерин альдегидіндегі С-2 атомы хиралды орталы болады. Хираль орталыыны санына арап, жалпы изомерлер санын N= 2° (п- хираль орталыыны саны) формуласы арылы аныталады. Глицерин альдегидіні екі оптикалы белсенді (D- жне L-) изомері бар. Кеістіктегі молекула бейнесін ааз бетіне кшіру шін Фишерді проекциялы формуласы олданылады. Фишер проекциясы бойынша -ОН тобы о жата орналасса - ол D- генетикалы атара, ал -ОН тобы сол жата орналасса (айнадаы бейнесі)- ол L - генетикалы атара жатады. Стрелка арылы оптикалы белсенді заттьвд ерітіндісінен тетін полярланан тіке сэулені баытыны згеруі крсетіледі, сэуле оа брылса (+), сола брылса (-) болып белгіленеді. Теориялы трде суле баытыньщ згеруін орынбасарларды кмегімен анытайды. Саат тілін кіші орынбасарлардан лкен орынбасара баыттайды.


Энантиомерлерді бірдей оспасын (D =L) рацематтар деп атайды. Рацематтар оптикалы белсенділік крсетпейді.
Энантиомерлерге жатпайтын стероизомерлерді диастереомерлер деп атайды (молекуланы айнадаы бейнесі емес стереоизомерлер). Диастереомерлерді физикалы жне химиялы асиеттері эр-трлі болады. Диастереомерлер екі маызды топа блінеді- а-диастереомерлер жне п-диастереомерлер.
ст-Диастереомерлер. Жай ант эритрозаны (2,3,4-шгидроксибутаналь) крамында бірнеше гидроксил тобы мен екі асимметриялы кміртегі (С-2, С-3) атомы бар. Эритрозада екі асимметриялык кміртегі болу себебінен, оны трт трлі изомері болады.
я-Диастереомерлерге- рамында я-байланысы бар конфигурациялы изомерлер жатады. я-диастереомерия алкендерге тэн (цис- жэне транс -изомерия).
Егер ос байланыспен байланысан кміртегі атомында бірнеше орынбасар болса, онда ол затты атау шін Е, Z- номенклатурасын олданады.
Е, Z - жйесі ос байланыстаы атомдармен байланысан орынбасарларды лкен-кішісі арылы аныталады, егерде лкен орынбасарлар ос байланысты бір бетінде орналасса Z - деп (яни немісше бірге деген сзді бас эріпі), ал екі жаында орналасса Е - деп (яни немісше арама-арсы деген сзді бас эріпі) аталады.

Конформация - а-байланыс бойындагы айналу нтижесінде туындайтын молекуланы геометриялы трлері. ст- байланыс бойындаы айналу брышын - торстьщ брыш деп атайды. Е кіші торсты брыш 60°.
Конформациялы молекулаларды рнектеу шін Ньюменні проекцияльщ формулаларын олданады.
Алифатты крсылыстарды конформациясы. и- байланыс бойындагы айналу нэтижесінде 1-Бромпропанны - тежелген, тасаланан жэне иылан конформациялары тзіледі. Конформацияларды Ньюмен проекциясы бойынша бейнелейді:


Ортала С-С байланыс тірегінде айналудан пайда болан 1-бромпропанны конформацияларыны арасында е энергетикалы тиімдісі немесе тратысы тежелген конформация.
Циклді осылыстарды конформациясы. Тек тетраэдрлік кміртегі атомынан ралан немесе рамында гетероатомдары бар бес, алты мшелі^ циклді осылыстар эртрлі конформациялы трде бола алады.
Мысалы: Цйклогексанны циклінде торсты кернеу болу салдарынан, оны молекуласы жазы бола алмайды. Сол себептен циклогексан екі конформациялы трде кездеседі: «орынды» жэне «астау». Е энергетикалы тиімді немесе траты конформация - орынды. р кміртек атомы бір аксиалды (о) жэне бір экваториалды (е) сутек атомымен байланысан, барлыы циклогександа алты аксиалды жэне сонша экваториалды сутегі атомы бар. Аксиалды сутегі симметрия осіне параллелді жоары жне тмен орналасан, экваториалды сутегі осы оске 109,5° орналасан.
Циклогексаннын «орынды» конформациясы


Циклогексаннын «астау» конформациясы

