Порядок проведення дослідження
9.1. Підготовлену відповідно до п 8. наважку досліджуваного продукту (гомогенату, змиву з поверхні) у кількості 25 г (см3) вносять в одне із середовищ для первинного збагачення в кількості 225 см3 (за п.п. 6.3.2.2, 7.2.3.). При необхідності дослідження інших мас продукту їх посів проводять у середовище також у співвідношенні 1:9 за об’ємом.
Посіви інкубують при (37±1)0С протягом (24±2) годин. (При використанні комерційних поживних середовищ термін та температура інкубації згідно інструкції до застосування). При рості лістерій на середовищах попереднього збагачення, які містять ескулін і цитрат заліза амонійного, спостерігається почорніння середовища за рахунок гідролізу глікозиду ескуліну до глюкози і ескулетину. Ескулетин реагує з іонами заліза, утворює комплекс чорного або маслинового кольору. На інших середовищах почорніння не відзначається.
9.2. Після термостатування продукту в середовищі для первинного збагачення 0,1 см3 суспензії пересівають у 10 см3 одного з рідких середовищ для вторинного збагачення за п.п. 6.3.2.2, 7.2.3. Посіви інкубують в термостаті при температурі (37±1)0С протягом (48±2) год. (При використанні комерційних поживних середовищ термін та температура інкубації згідно інструкції до застосування.) У середовищах з ескуліном відзначають почорніння як ознаку можливої присутності бактерій роду Listeria.
9.3. Із пробірок після термостатування, незалежно від наявності або відсутності ознак росту, і в т.ч. почорніння, роблять пересіви по 0,1 см3 на поверхню двох чашок Петрі з однієї з агаризованих диференційно-діагностичних середовищ за п.п. 6.3.2.3, 7.2.4, 7.2.5. Посівний матеріал розтирають стерильним шпателем. Допускається проводити пересівання петлею штрихом. Чашки із середовищами попередньо підсушують.
Посіви інкубують при температурі (37±1)0С протягом 24-48годин. (При використанні комерційних поживних середовищ термін та температура інкубації згідно інструкції до застосування.) Чашки з PALCAM-агаром краще інкубувати мікроаеробних умовах.
9.4. Проведення дослідження без етапу вторинного збагачення. При посіві продуктів з низьким вихідним рівнем мікробної контамінації і при відсутності ознак росту в рідкому середовищі (помутніння, почорніння й ін.) допускається проводити пересів на чашки з агаризованими диференційно-діагностичними середовищами відразу після етапу первинного збагачення за п. 9.1.
9.5. При відсутності росту на чашках з диференційно-діагностичними середовищами типу Оксфордського агару (Oxford agar) і PALCAM-агару дослідження припиняють і дають висновок про відсутність L. monocytogenes у дослідженій пробі продукту.
9.6. При виявленні характерного росту на чашках відбирають 3-5 колоній для їх подальшого вивчення.
На середовищах типу PALCAM-агару через 24 год. інкубації лістерії формують дрібні, сірувато-зелені або маслиново-зелені колонії з чорним ореолом, діаметром 0,5-1,0 мм, іноді з чорним центром. (Чашки, що інкубувалися в мікроаеробних умовах, необхідно витримати на повітрі протягом 1 години для відновлення кольору середовища). Через 48 год. колонії діаметром 1,0-2,0 мм набувають зеленого забарвлення з заглибленими центрами, оточеними чорним ореолом. Кокова мікрофлора (бактерії родів Staphylococcus, Enterococcus) утворює кольорові колонії (від жовтого до червоного) за рахунок ферментації маніту.
На Оксфордському агарі лістерії, вирощені протягом 24 год., дрібні (1 мм), сіруваті, оточені чорним ореолом. Через 48 год. - більш темні, можливо зеленуватий відтінок, близько 2 мм у діаметрі, з чорним ореолом і заглибленим центром.
При появі суцільного росту лістерій роблять пересів бактеріологічною петлею з зон найбільшого почорніння середовища штрихами на 2-3 чашки Петрі із селективним диференційно-діагностичним ПС (Оксфордський або PALKAM-агар) для одержання ізольованих колоній. Посіви термостатують аналогічно п.9.3.
9.7. Відібрані характерні колонії (не менше 5, а у випадку якщо на чашці виросло менше 5 колоній то всі), підозрілі на приналежність до Listeria monocytogenes, пересівають на середовища: МПА з 1 % глюкози (п. 7.2.1), триптон-соєвий агар із дріжджовим екстрактом (TSYEA) за п. 6.3.2.1 або 7.2.2 для одержання ізольованих колоній, які піддають подальшому вивченню.
Посіви інкубують в термостаті при температурі 300С протягом 24 годин.
9.8. Ідентифікація виділених культур. Для визначення належності виділених мікроорганізмів до роду Listeria отримані чисті культури фарбують за Грамом, мікроскопують, визначають наявність у них каталази, рухливості при двох температурах інкубації – 250С і 370С, здатності до ферментації маніту і ставлять реакцію редукції нітратів.
9.8.1. Фарбування за Грамом. Бактерії роду Listeria є грампозитивними тонкими короткими паличками, спор не утворюють.
9.8.2. Каталазну активність культур визначають відповідно до ГОСТ 30425 за здатністю каталази розкладати перекис водню з виділенням пухирців газу. Реакцію ставлять з охолодженою до кімнатної температури добовою культурою на стерильному предметному склі. Ізольовану колонію, узяту з поверхні ПС скляною паличкою або платиновою петлею розтирають на склі і піпеткою наносять краплю 3 % розчину перекису водню. При позитивній реакції через 30-60 сек. на склі з'являються пухирці газу. Паралельно ставлять контрольну пробу.
Бактерії роду Listeria є каталазопозитивними.
9.8.3. Рухливість культур визначають посівом уколом у середовища за п. 7.2.8 і інкубації при двох температурах – (25±1)0С і (37±1)0С протягом 48-72 год.
Бактерії роду Listeria рухливі при 250С (утворюють характерний, схожий на парасольку, ріст навколо лінії уколу) і нерухомі або слабко рухомі при (35-37)0С.
9.8.4. Для визначення здатності зброджувати вуглеводи, культури пересівають на середовища Гіса за п.п. 6.3.2.3 або 7.2.9. Посіви інкубують 7 діб при (37±1)0С, наявність ферментативної активності у відношенні вуглеводів виявляють за зміною кольору середовищ за рахунок утворення кислоти.
Більшість бактерій роду Listeria не утилізують маніт (за винятком L. grayi та L. grayi subsp. murrayi).
9.8.5. Постановку реакції нітратредукції проводять за ГОСТ 10444.8-88. Бактерії роду Listeria не відновлюють нітрати до нітритів (за винятком L. grayi і L. grayi subsp. murrayi).
Виявлення в посівах грампозитивних коротких тонких паличок, каталазопозитивних, що не відновлюють нітрати до нітритів, не утилізують маніт, рухливі при 250С и нерухомі при 370С, вказує на належність виділених культур з до роду Listeria.
Для підтвердження належності виділених лістерій до виду L.monocytogenes визначають здатність до ферментації рамнози, ксилози, наявність лецитиназної і β-гемолітичної активності і проводять постановку CAMP-тесту. Диференційні ознаки видів роду Listeria наведені в табл. 1.
Для видової диференціації виділених культур лістерій рекомендується використовувати біохімічні тест-системи API Listeria фірми “BioMerieux”. При їх застосуванні варто керуватися рекомендаціями виробника.
Таблиця 1
| Ознака | L. monocytogenes | L. ivanovii | L. seeligeri | L. innocua | L. grayi | L. welshimeri |
| Ферментація: • маніту | - | - | - | + | - | |
| • ксилози | - | + | + | - | - | + |
| • рамнози | + | - | - | V | - | V |
| β-гемоліз | + | + | (+) | - | - | - |
| CAMP-тест посилення гемолізу біля штриха S. aureus | + | - | (+) | - | - | - |
| Лецитиназна активність: • на середовищі з активованим вугіллям | + | + | - | - | - | - |
| • на середовищі без вугілля | - | + | - | - | - | - |
9.8.6. Здатність ферментувати рамнозу і ксилозу - визначають аналогічно п. 9.8.4. Бактерії L. monocytogenes утилізують рамнозу з утворенням кислоти і не утилізують ксилозу.
9.8.7. β-гемолітичну активність досліджуваних культур визначають за утворенням зон просвітління за рахунок розчинення еритроцитів навколо колоній, що виросли на поверхні кров'яного агару з дефібринованою кров’ю барана або кроля (п.п. 6.3.2.3, 7.2.6). Посіви інкубують при (37±1)0С протягом 24 год.
Listeria monocytogenes володіють гемолітичною активністю (утворюють вузькі чіткі зони просвітління навколо колоній).
9.8.8. Постановку САМР-тесту проводять для диференціації L.monocytogenes від інших видів лістерій, що мають β-гемолітичну активність.
1 варіант. Для проведення тесту 2-3-добові культури гемолітичних штамів S.aureus і R.equi засівають на кров'яний агар з еритроцитами барана двома паралельними штрихами на відстані 5,0-5,5 см, як показано на мал. 1.
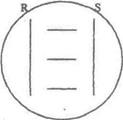
Мал.1. S - посів Staphylococcus aureus;
R - посів Rhodococcus equi.
Між вертикальними штрихами S. aureus і R.equi засівають паралельними штрихами досліджувані культури лістерій на відстані один від одного не менше 1 см і від вертикальних штрихів - 0,5 см. У якості контролю використовують тест-штами L. monocytogenes і L. ivanovii. Інкубують 18-24 години при (37±1)0С. Відзначають форму і розміри зон гемолізу біля вертикальних штрихів росту стафілокока і родокока.
Listeria monocytogenes дають невелике розширення зони гемолізу (до 2 мм) біля штриха S. aureus (позитивний САМР-тест) і має відсутність змін зони гемолізу поруч зі штрихом R. equi (негативний САМР-тест).
Listeria ivanovii дають широку (5-10 мм) смугу „стрілкоподібного” β-гемолізу біля штаму R. equi.
За відсутності тест-штаму R. equi, як виключення, дозволяється постановка САМР-тесту в наступній модифікації.
2-3-добову культуру гемолітичного штаму S.aureus засівають на кров'яний агар з еритроцитами барана вертикальним штрихом. Перпендикулярними до нього штрихами засівають досліджувані культури лістерій на відстані один від одного не менше 1 см і від вертикального штриха - 0,5 см. У якості контролю використовують тест-штами L. monocytogenes і L. ivanovii. Інкубують 24 години при (37±1)0С. Відзначають форму і розміри зон гемолізу біля вертикального штриха росту стафілокока.
L. monocytogenes дають розширення зони гемолізу біля штриха S. aureus (позитивний САМР-тест), L. ivanovii не дає такого розширення (негативний САМР-тест)
9.8.9. Для визначення лецитиназної активності дно двох чашок Петрі з поживним агаром з глюкозою, що містять: 1 чашка - жовток курячого яйця й активоване вугілля, 2 чашка - жовток курячого яйця без активованого вугілля – поділяють на кілька секторів або квадратів, досліджувані культури і контрольні штами лістерій пересівають паралельно короткими штрихами на відповідні сектори чашок, з вугіллям і без нього. Інкубують 48 год. при (37±1)0С. Чашки переглядають у проходячому світлі і визначають наявність активності в присутності й без активованого вугілля, порівнюючи з контрольними висівами музейних штамів. L. ivanovii дає щільну зону помутніння шириною 3-6 мм незалежно від наявності активованого вугілля. L. monocytogenes дає аналогічну зону помутніння в присутності активованого вугілля і не дає її на середовищі без вугілля. Інші види лістерій не дають зони помутніння.
9.9. Облік результатів. Результат оцінюють по кожній дослідженій пробі окремо. У зразку продукту констатують присутність Listeria monocytogenes, якщо при посіві на селективні середовища виділені короткі неспороутворюючі грампозитивні палички, каталазопозитивні, рухливі при (25±1)0С і нерухомі при (37±1)0С, які утилізують ескулін, зброджують з утворенням кислоти рамнозу і не зброджують маніт і ксилозу, не відновлюють нітрати до нітритів, володіють β-гемолітичною активністю, дають позитивну реакцію в САМР-тесті з S.aureus і негативну - з R.equi, виявляють лецитиназну активність на поживному агарі с додаванням жовтка курячого яйця й у присутності активованого вугілля.
Результати виявлення Listeria monocytogenes у визначеній наважці продукту записують: “Listeria monocytogenes виявлені в 25 г (см3) (у 50-100 г ~ для продуктів дитячого, лікувального і спеціалізованого харчування) продукту” чи “Listeria monocytogenes не виявлені в 25 г (см3) (у 50-100 г - для продуктів дитячого, лікувального і спеціального харчування) продукту”.