Определение осмотической концентрации и изотонического коэффициента раствора электролита
Цель: Приобрести навыки физико-химических измерений и обработки результатов эксперимента на примере криометрического определения осмотической концентрации и изотонического коэффициента 5%-ного раствора натрия сульфата.
Оборудование:Прибор для криометрических измерений. Термометр для измерения температуры в области ее отрицательных значений с ценой деления 0,1 К.
Реактивы: Дистиллированная вода, лед колотый (снег), натрий хлорид технический, исследуемый раствор.
Выполнение эксперимента: Получите у лаборанта прибор для криометрических определений.
Прибор (рис. 1) состоит из широкой стеклянной пробирки 1, закрытой пробкой, в которую вставлены термометр 2 и металлическая мешалка 3. Пробирку помещают в толстостенный стакан 4, в котором готовят охлаждающую смесь.
Приготовьте охлаждающую смесь из 3 ч. снега или льда и 1 ч. NaCl. Поместите смесь в сосуд 4. Измерьте термометром температуру охлаждающей смеси. Она должна быть около -5°С. Охлаждающая смесь должна заполнять стакан примерно на 3/4 его объема.
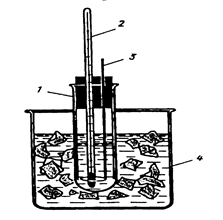 Рисунок 1
Рисунок 1
|
В пробирку 1 налейте такой объем дистиллированной воды, чтобы полностью покрыть резервуар термометра, закройте пробирку пробкой с термометром и мешалкой и поместите пробирку в стакан с охлаждающей смесью. Непрерывно помешивая воду мешалкой 3 (старайтесь не касаться мешалкой термометра), следите за изменением температуры. Следите, чтобы термометр не касался дна и стенок пробирки 1. Обычно температура опускается немного ниже точки замерзания воды, затем начинается кристаллизация, выделяется энергия и столбик ртути или спирта резко поднимается вверх и затем застывает на значении температуры кристаллизации воды (около 0°С). Отметьте температуру замерзания воды, запишите ее в журнал с точностью, которую позволяет зафиксировать используемый вами термометр. Выньте пробирку из охлаждающей смеси и, подогревая ее рукой, полностью растворите образовавшиеся кристаллы льда. Снова опустите пробирку в охлаждающую смесь и повторите определение температуры замерзания воды. Получите у преподавателя склянку с анализируемым раствором и запишите в журнал данные о растворе. Сполосните пробирку 1 анализируемым раствором и заполните ее раствором так же, как и при измерении температуры замерзания воды. Закройте пробирку пробкой, вставьте в нее термометр и мешалку (предварительно и то и другое должно быть сполоснуто анализируемым раствором). Определите температуру начала замерзания раствора, как определяли температуру замерзания воды. Все измерения запишите в лабораторный журнал. После работы разберите прибор для криоскопических измерений. Вылейте раствор из пробирки 1. Сполосните водопроводной и дистиллированной водой. Вымойте стакан 4.
Обработка результатов эксперимента:
1. Рассчитайте температуру понижения замерзания раствора по сравнению с чистым растворителем:
ΔТзам = ТН2О – Тр-ра
2. Рассчитайте моляльную концентрацию 5%-ного раствора (теоретическое значение bтеор).
3. Используя экспериментально найденную величину понижения температуры замерзания исследуемого раствора вычислите практическое значение моляльной концентрации (bпракт).
4. Определите изотонический коэффициент анализируемого раствора электролита.
5. Сравните полученное значение изотонического коэффициента с возможно максимальным для раствора данного вещества. Объясните вероятные причины отклонений.
Расчёты:
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы:
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы к защите работы:
1. Приведите примеры растворов, для которых изотонический коэффициент может иметь максимальное значение, равное 2 и 3.
______________________________________________________________________________________________________________________________________
2. При какой температуре будет закипать 5% раствор Na2S04?
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
3. Рассчитайте осмотическое давление анализируемого раствора при 37°С.
______________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
4. Какую цель преследуют, посыпая снег на тротуаре солью?
____________________________________________________________________________________________________________________________________
5. Почему при аллергических реакциях, сопровождающихся отёками тканей, в организм вводят высококонцентрированные растворы хлорида кальция (10%) и глюкозы (20%).
______________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.1.4.
ТЕМА: Протолитические реакции. Буферные растворы.
ЦЕЛЬ: На основе теории кислотно-основных равновесий уяснить сущность протолитических процессов, протекающих в организме, механизмов действия буферных систем организма, их взаимосвязь и роль в поддержании кислотно-основного гомеостаза.
Лабораторная работа №3