Вода як електроліт кислоти, буферні системи живих організмів
З хімічної точки зору вода - це слабкий електроліт, що зворотно розпадається на іони водню (Н+) і іони гідроксилу (ОН-). При цьому між недисоційованими молекулами води та іонами встановлюється рівновага:
Н2O± H+ + ОН-
Зворотна іонізація (дисоціація) води має дуже важливе значення у функціонуванні живої клітини. (Насправді вільних іонів водню у воді не існує. Як і більшість інших іонів, вони гідратовані, тобто оточені гідратною оболонкою. Гідратну форму іона Н+ називають іоном гідронію або гідроксонію і позначають H3O+ Для спрощення часто іони гідроксонію не вживають у реакціях).
Іонізація води відбувається дуже слабко. У будь-який момент при 25ºСіз 10 мільйонів молекул чистої води в дисоційованому стані знаходиться тільки одна. Проте, незважаючи на дуже слабку дисоціацію, іони Н+ і ОН-, що при цьому утворюються, відіграють винятково важливу роль у біологічних процесах. Тому необхідно знати кількісну сторону дисоціації води. З рівноваги зворотної реакції Н2О ↔Н+ + ОН- можна записати константу дисоціації води:
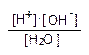 |
КД =
Концентрація недисоційованих молекул у воді дуже висока порівняно з дисоційованими (вона дорівнює числу грамів води в 1 літрі поділеному на молярну масу, тобто 1000׃ 18 = 55,5 М) і є сталою величиною відносно дуже низьких концентрацій іонів H+ і OH-. Чисельне значення КД Н2О при 25ºС дорівнює 1,8·10-16. Підставивши відповідні значення, одержимо:
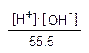
1,8·10-16= ,
(55,5)·(1,8·10-16) = [H+]·[OH-],
99,9·10-16 = [H+]·[OH-],
1,0·10-14 = [H+]·[OH-].
Величину 1·10-14 називають іонним добутком води. Вона означає, що добуток [H+]·[OH-] у чистій воді при 25°С завжди дорівнює строго визначеній величині, а саме 1·10-14. Оскільки [H+]=[OH-], що має місце в чистій воді, то такий розчин називають нейтральним. Виходячи з чисельного значення іонного добутку води, можна розрахувати концентрацію іонів H+ і OH- у воді.
Оскільки іонний добуток води є сталою величиною, то зрозуміло, що коли концентрація іонів H+ вища за 10-7 г-іон/л, то концентрація іонів OH- має бути менше 10-7 г-іон/л, і навпаки. Таким чином, коли концентрація іонів H+ дуже висока, як у розчинах кислот, концентрація іонів ОН- буде дуже низькою, оскільки їх добуток завжди має залишатися рівним 1·10-14. І, навпаки, якщо концентрація іонів ОН- дуже висока, наприклад, у розчині лугу, то концентрація іонів Н+ буде дуже низькою. Отже, знаючи концентрацію іонів ОН- , із чисельного значення іонного добутку води можна обчислити концентрацію іонів Н+ і навпаки.
Кількісні значення іонів Н+ дуже малі і проводити з ними розрахунки не зручно. Тому користуються логарифмічним виразом їх концентрацій, що позначають символом рН: рН= - lg [H+] (це обернений десятковий логарифм концентрації іонів Н+). У нейтральному розчині, де концентрація іонів Н+ становить 1,0·10-7, розмір рН при 25°С дорівнює:
pH= - lg 1,0·10-7 = - (lg 1,0 = lg 10-7)-(0=(-7))=7 або
pH= lg  = lg 1,0=lg 107 = 0=7 = 7
= lg 1,0=lg 107 = 0=7 = 7
Значення 7,0 одержано з чисельного значення іонного добутку води при 25°С. Розчини, що мають рН більше 7,0, є лужними, оскільки концентрація іонів ОН- у таких розчинах більше за концентрацію іонів H+. І, навпаки, розчини, що мають рН менше 7,0, — це кислі розчини.
Величину рН водних розчинів можна приблизно визначити за допомогою різних індикаторів, таких, як лакмус, метилоранж, фенолфталеїн. Точне значення рН визначають за допомогою приладу - рН-метра.
Від величини рН залежать структура й активність біологічних макромолекул, зокрема, активність ферментів. Так, активність пепсину шлункового соку максимальна при рН 1,5-2, каталази крові - при 7,0. Тканинні катепсини в нейтральному середовищі здійснюють синтез білків, у кислому - їх розщеплення. Зміна рН середовища призводить до зниження активності ферментів, порушення обміну речовин, зміни структури та осадження білків.
Значення рН використовують при діагностиці захворювань. Наприклад, у людей, що страждають важкою формою діабету, значення рН крові часто нижче порівняно з нормою. Такий стан називають ацидозом. При деяких інших захворюваннях величина рН може бути вище за норму. Такий стан називають алкалозом.
З властивостями води тісно пов’язані властивості кислот і основ. Розрізняють сильні кислоти і основи і слабкі. Сильні кислоти - це хлороводнева, сульфатна, нітратна. Сильні основи - натрій гідроксид, калій гідроксид. У водних розчинах вони повністю іонізовані, тому і належать до сильних.
У біологічних системах присутні слабкі кислоти і основи. Прикладом слабких кислот можуть бути оцтова, карбонатна, фосфатна, слабкої основи - аміак (амоніак).
У водному розчині кожна кислота намагається відщепити свій протон. Чим сильніша кислота, тим сильніше виражена ця тенденція. Здатність будь-якої кислоти НА відщеплювати протон і утворювати сполучену з нею основу А- характеризується константою рівноваги зворотної реакції:
 |
НА ↔ Н++А- , яка дорівнює
Суміші слабких кислот і спряжених з ними основ являють собою системи, що називають буферними. Вони мають дуже важливу властивість. При додаванні до такої суміші невеликих кількостей кислоти (Н+) або основи (ОН-) або при розведенні вони здатні підтримувати постійне значення рН. Прикладом буферної системи може служити суміш оцтової кислоти та ацетат-іона (солі оцтової кислоти).
При додаванні до такої системи іонів Н+ (кислоти) один із її компонентів, а саме спряжена основа - аніон СН3СОО-, зв’язується з протонами і перетворюється в оцтову кислоту, зменшуючи тим самим концентрацію іонів Н+. Якщо додати до такого розчину іони ОН- (луг), то частина вільної кислоти, звільняючи деяку кількість іонів Н+ нейтралізують ОН- іони з утворенням нейтральних молекул води. Важливо відзначити, що насправді значення рН буферних систем хоча і слабко, але все ж змінюється при додаванні невеликої кількості іонів H+ або ОН-. Проте ці зміни дуже незначні порівняно з тими змінами рН, які б мали місце при додаванні такої ж кількості іонів H+ або ОН- до чистої води або розчину, наприклад, NaCl, оскільки ні вода, ні розчини таких солей не мають буферних властивостей. За наведеною вище схемою працюють і інші буферні системи. Варто пам’ятати, що будь-яка буферна система успішно функціонує тільки за наявності в розчині слабкої кислоти (донора протонів) і спряженої з нею основи (акцептора протонів). Якщо до буферного розчину додати велику кількість сильної кислоти (або сильної основи), то весь наявний у ньому акцептор протонів (або їх донор) перетвориться в слабку кислоту (або сіль), і буферна система перестане існувати. Є таке поняття, як буферна ємність. Вона, природно, буде тим більшою, чим вищими будуть концентрації слабкої кислоти і спряженої з нею основи. Буферні розчини з високими концентраціями спряжених пар можуть утримувати постійне значення рН при додаванні значних кількостей кислоти або лугу.
У всіх живих організмів внутрішньоклітинні і позаклітинні рідини мають характерну і постійну величину рН, що підтримується в першу чергу буферними системами.
У людини і ссавців дві важливі буферні системи. Фосфатна підтримує рН внутрішньоклітинної рідини. Вона являє собою спряжену кислотно-основну пару:
Н2РО4-↔ Н+ + НРО42-
Ця система максимально ефективно функціонує біля рК 6,86, тому що значення рК іонів Н2РО4- дорівнює 6,86. Фосфатна буферна пара Н2РО4-- НРО42-- добре утримує рН в інтервалі між 6,1 і 7,7 і може забезпечувати буферну ємність внутрішньоклітинної рідини, значення якої лежить у межах 6,9-7,4.
Головною буферною системою плазми крові є бікарбонатна система. Вона являє собою спряжену кислотно-основну пару, яка складається з молекул карбонатної кислоти (Н2СО3), що виконує роль донора протона, і бікарбонат-іона (НСО3-), що виконує роль акцептора протона:
Н2СО3↔Н++СО3-
Це унікальна буферна система організму. Вона функціонує як ефективний фізіологічний буфер близько рН 7,4, тому що донор протона Н2СО3 у плазмі крові знаходиться в динамічній рівновазі з великим резервним обсягом газоподібної CO2 у повітряному просторі легенів. Тому за будь-яких умов, коли в кров з якихось причин потрапляє надлишок іонів ОН- і рН підвищується, частина карбонатної кислоти (Н2СО3), перетворившись в HCO3- в результаті взаємодії з іонами ОН-, дуже швидко відновлюється за рахунок великого запасу газоподібної СО2 в легенях. Остання, розчиняючись у крові, утворює розчинну СО2 , що вступає в реакцію з водою, утворюючи Н2СО3-
Якщо чомусь величина рН крові зменшується, деяка кількість НСО3 буферної системи зв’язується з надлишком іонів Н+. При цьому утворюється надлишок Н2СО3. Ця Н2СО3 розпадається, виділяючи розчинену СО2, яка в свою чергу переходить у газову фазу в легенях і видихається організмом. Таким чином, висока інтенсивність процесу дихання, тобто висока швидкість вдихання повітря і видихання СО2 обумовлює підтримання постійного значення рН у крові.