Измерение ферментативной активности
Понятие о ферментах
Ферментами (энзимами) называют растворимые или связанные с мембранами белки, наделенные каталитической активностью.(Кроме белков каталитическую активность в организме могут проявлять некоторые РНК (рибозимы) и антитела (абзимы), однако они в тысячи раз менее эффективны, чем ферменты.) Эти названия произошли от латинского «fermentatio» - брожение и греческого «en zym» - внутри закваски. Они напоминают о первых источниках ферментов. Биохимии, которая изучает ферменты, называется энзимология. На схемах и в уравнениях реакций молекулы ферментов обозначают - Е. Вещества, превращения которых катализируют ферменты, называют субстратами (S). Продуктыэнзиматической реакцииобозначают - Р. Так как ферменты являются белками, их получают в гомогенном виде теми же способами, что и другие белки. Для ферментов характерны физико-химические свойства, присущие белкам.
Отличие ферментов от неорганических катализаторов:
а) ускоряют реакции значительно эффективнее;
б) наделены высокой специфичностью действия;
в) подвергаются регуляции в физиологических условиях;
г) действуют в мягких условиях.
Строение ферментов
Ферментами могут являться как простые, так и сложные (конъюгированные) белки, в состав которых могут входить липиды, углеводы, ионы металлов, азотистые основания, производные витаминов. В организме ферменты могут функционировать как в растворимом состоянии, так и в виде нерастворимых комплексов или входить в состав биологических мембран.
Отличительной особенностью ферментов является наличие активного центра. Активный центр -это уникальная комбинация сближенных в пространстве аминокислотных остатков, которая обеспечивает:
а) узнавание молекулы субстрата,
б) связывание субстрата с ферментом,
в) осуществление каталитического превращения (в случае сложного фермента в акте катализа также принимает участие кофермент, входящий в состав активного центра).
Активный центр возникает в тот момент, когда белок сворачивается и принимает свою нативную (активную) конформацию. Структура активного центра может изменятся при взаимодействии с субстратом. По образному выражению Д. Кошланда субстрат подходит к активному центру как рука к перчатке.
Одна молекула фермента, особенно если она состоит из нескольких субъединиц, может содержать более одного активного центра.
В активном центре имеются два участка. Первый участок отвечает за узнавание и связывание субстрата. Он называется субстрат-связывающим участком или якорной площадкой. Второй участок называется каталитическим, в его состав входят аминокислотные остатки, принимающие участие в акте катализа.
Ферменты представляют белки, сильно различающиеся по молекулярной массе и сложности строения. Примером фермента с небольшой молекулой является рибонуклеаза, состоящая из одной субъединицы с молекулярной массой 13700 Дa. (У рибонуклеазы определена аминокислотная последовательность. В 1969 г. рибонуклеаза была синтезирована в лаборатории Б.Меррифилда в Нью-Йорке.) Многие ферменты состоят из нескольких субъединиц, например, лактатдегидрогеназа состоит из четырех субъединиц двух видов. К настоящему времени известно несколько мультиферментных комплексов, состоящих из десятков различных субъединиц и нескольких типов коферментов. Например, пируватдегидрогеназный комплекс состоит из 60 субъединиц трех типов и пяти типов кофакторов. Молекулярная масса такого комплекса составляет 2,3*106 - 10*106 Дa в зависимости от источника фермента. Молекула фермента может быть меньше, чем молекула субстрата. Например: молекулы ферментов амилазы и рибонуклеазы меньше, чем молекулы их субстратов – крахмала и РНК.
Белковая часть сложных ферментов каталитически неактивна и называется апоферментом. Связывание апофермента с небелковым компонентом приводит к образованию каталитически активного фермента (холофермента):

Многие ферменты содержат в своем составе ион металла, который может выполнять различные функции:
а) участвовать в связывании субстрата и процессе его каталитического превращения;
б) способствовать присоединению кофермента к молекуле фермента;
в) стабилизировать третичную структуру фермента (например Са2+ в амилазе);
г) связываясь с субстратом, образовывать истинный субстрат, на который действует фермент.
Многие коферменты являются производными витаминов, поэтому нарушение обмена веществ при витаминной недостаточности обусловлено снижением активности определенных ферментов.
Некоторые ферменты наряду с активным центром содержат аллостерический (регуляторный) центр -участок белковой глобулы,вне активного центра, где могут связываться вещества, регулирующие ферментативную активность. Эти вещества называют аллостерическими эффекторами (аллостерическими активаторами или ингибиторами). В результате связывания эффектора с аллостерическим центром происходит изменение структуры белка, приводящее к изменению пространственного расположения аминокислотных остатков в активном центре и, в итоге, к изменению ферментативной активности.
Ферменты, встречающиеся в одном организме и катализирующие одну и ту же химическую реакцию, но с различной первичной структурой белка, называются изоферментами. Изоферменты отличаются друг от друга по таким физико-химическим свойствам, как молекулярная масса, термостабильность, субстратная специфичность, электрофоретическая подвижность. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты или их субъединицы. Например, фермент лактатдегидрогеназа (ЛДГ), катализирующая обратимую реакцию окисления лактата до пирувата, имеет четыре субъединицы двух типов М и Н, комбинация этих субъединиц лежит в основе формирования пяти изоферментов ЛДГ (рис.1). Для диагностики заболеваний сердца и печени необходимо исследование изоферментного спектра ЛДГ в сыворотке крови, поскольку ЛДГ1 и ЛДГ2 активны в сердечной мышце и почках, а ЛДГ4 и ЛДГ5 - а скелетных мышцах и печени.
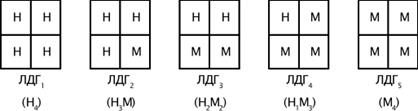
Рис.1 Строение различных изоферментов ЛДГ.
Измерение ферментативной активности
Определение активности ферментов осуществляется путем измерения скорости катализируемых реакций. Скорость ферментативных реакций измеряют по убыли концентрации субстрата или увеличению концентрации продукта за единицу времени:
v = -ΔСS/Δτ , v = ΔCP/Δτ ,
где ΔСS – изменение молярной концентрации субстрата (моль/л),
ΔCP - изменение молярной концентрации продукта реакции (моль/л),
Δτ - изменение времени (мин, сек).
Кинетические исследования желательно проводить при насыщающей концентрации субстрата, в противном случае фермент не будет иметь возможность проявить максимальную активность.
Единицы активности ферментов:
Международная единица фермента (U) - это такое количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту при температуре 25оС и оптимальном рН среды.
В системе СИ единицей фермента является катал (кат) –это такое количество фермента, которое катализирует превращение одного мольсубстрата за 1 секунду. Нетрудно подсчитать, что:
1 U = (1*10-6М)/60 с = 1,67*10-8 М с-1 = 1, 67 * 10-8кат = 16,7 нкат.
Часто определяют удельную активность препаратов фермента делением активности навески препарата фермента, выраженной в (U), на массу навески в миллиграммах:
Ауд = U/масса препарата (мг)
При очистке ферментов удельная активность увеличивается. По возрастанию удельной активности можно судить об эффективности стадий очистки и чистоте ферментного препарата.
Для оценки активности высокоочищенных, гомогенных препаратов ферментов делением числа международных единиц (U) фермента в образце на количество вещества фермента (мкмоль) в этом образце рассчитывают молярную активность (число оборотов). По физическому смыслу молярная активность - это число молекул субстрата, подвергающихся превращению на одной молекуле фермента за 1 минуту или за 1секунду. Например: для уреазы, ускоряющей гидролиз мочевины, молярная активность составляет 30000, трипсина - 102, глюкозоксидазы - 17000 циклов в секунду.
Свойства ферментов
4.1. Механизм действия.Ферменты не смещают равновесие катализируемых реакций в сторону образования продуктов, таким образом, константа равновесия реакции остается постоянной. Как и все катализаторы, ферменты лишь уменьшают время достижения этого равновесия. В большинстве случаев ферменты ускоряют реакции в 107 - 1014 раз. В основе эффективности ферментативного катализа лежит сильное снижение энергии активации реакции за счет превращения субстрата в продукт через переходные состояния.
4.2. Специфичность действия. Специфичность связывания с субстратом и пути протекания ферментативной реакции определяются апоферментом. Специфичность действия ферментов определяет направленный обмен веществ в организме.
О ферментах говорят, что они имеют узкую субстратную специфичность, если они действуют на очень небольшой круг субстратов. Иногда можно говорить об абсолютной субстратной специфичности,например, каталаза катализирует только одну реакцию - разложение пероксида водорода:

Для большинства ферментов характерна относительная (широкая, групповая) субстратная специфичность, когда они катализируют группу однотипных реакций. Например, алкогольдегидрогеназа катализирует превращения спиртов в альдегиды, причем в качестве субстратов могут выступать метанол, этанол, пропанол и другие спирты. Интересным является тот факт, что алкогольдегидрогеназа может окислять и нелинейные спирты, а также спиртовую группу, входящую в состав сложных молекул, в частности, этот фермент может катализировать превращение ретинола в ретиналь. Естественно, ферменты, наделенные широкой субстратной специфичностью, катализируют превращения субстратов с различной эффективностью.
Ферменты наделены также стереохимической специфичностью: их активный центр распознает молекулы субстратов по пространственной конфигурации. Например, оксидазы L-аминокислот активны только в отношении L-аминокислот и совершенно не действуют на их D-аналоги. Для окислительного дезаминирования D-аминокислот в живых организмах имеются оксидазы D-аминокислот, не действующие на L-аминокислоты. Именно способность активного центра связываться с определенными стереоизомерами субстрата лежит в основе функционирования таких ферментов, как рацемазы, которые превращают одни стереоизомеры в другие.
Специфичность путей превращения заключается в том, что один субстрат под действием разных ферментов может превращаться в продукты, различающиеся по структуре и роли в метаболизме.
Приведем пример: оксидазы L-аминокислот действуют на L-аминокислоты, превращая их в альфа-кетокислоты с образованием аммиака и пероксида водорода.

Декарбоксилазы L-аминокислот связываются с теми же субстратами, но катализируют другую реакцию: декарбоксилирование с образованием биогенных аминов и выделением углекислого газа.

Еще одним примером является возможность превращения глюкозо-6 фосфата под действием различных ферментов, по одному из возможных метаболических путей:

4.3. Термолабильность.
Как и многие белки, при повышении температуры ферменты подвергаются термической денатурации, что приводит к нарушению нативной конформации фермента и изменению структуры активного центра. Ферменты млекопитающих начинают заметно денатурировать при температурах выше 40оС.
В связи с вышесказанным, ферментные препараты желательно хранить при пониженных температурах. Одним из лучших путей сохранения ферментов является их лиофилизация (высушивание при температуре ниже -70оС в вакууме), переведение в частично денатурированное состояние с помощью солей аммония и помещение в холодильник.
4.4. Зависимость скорости реакции от температуры.Скорость ферментативных реакций, как и любых химических реакций, зависит от температуры. При повышении температуры на 10оС скорость реакции увеличивается в 2-4 раза согласно правилу Вант-Гоффа. Однако при температурах выше 40оС существенной становится денатурация ферментов, что приводит к уменьшению суммарной активности (рис. 2):

Рис. 2. Зависимость скорости ферментативной реакции от температуры.
4.5. Зависимость скорости реакции от рН. Зависимость скорости ферментативной реакции от рН имеет колоколообразный вид (рис. 3). Значения рН, при которых наблюдается наиболее высокая скорость ферментативной реакции, называют оптимальными (рН-оптимум). Характер кривых и значение рН-оптимума зависит от природы заряженных групп субстрата и заряженных групп фермента (особенно тех, которые входят в активный центр). Оптимум рН для большинства ферментов лежит в пределах от 6,0 до 8,0 (рис. 3).

Рис. 3. Зависимость скорости ферментативной реакции от рН.
Однако, есть и исключения, например, пепсин наиболее активен при рН 1,5 – 2,0, а щелочная фосфатаза при рН 10,0 – 10,5 (рис. 4)

Рис. 4. Зависимости скорости ферментативной реакции (v) от рН среды.
При экстремальных (очень низких или очень высоких) значениях рН происходит нарушение третичной структуры молекулы фермента, приводящее к потере ферментативной активности.