Отличительные признаки ферментативного и химического катализа
МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ
Кафедра химической технологии
высокомолекулярных соединений
КОНСПЕКТ ЛЕКЦИЙ
БИОЛОГИЧЕСКАЯ ХИМИЯ
для студентов специальностей
49 01 01, 49 01 02, 91 01 01
ФЕРМЕНТЫ-ВИТАМИНЫ
Могилев 2005
УДК 577.15.820
Рассмотрен и рекомендован к изданию кафедрой
химической технологии высокомолекулярных соединений
Протокол № __ от ___________ 2005 г.
Рассмотрен и рекомендован к изданию секцией выпускающих кафедр
Протокол № _ от ____________2005 г.
Составитель доцент Макасеева О.Н.
Оформление
графического материала доцент Баранов О.М.
Рецензент доцент Шуляк Т.Л.
Ó УО «Могилевский государственный университет продовольствия»
Содержание
1 Краткая история развития учения о ферментах. ..4
2 Общие свойства ферментов и химических катализаторов небелковой природы 4
3 Отличительные признаки ферментативного и химического катализа. 4
4 Строение ферментов. 5
5 Механизм действия ферментов. 7
6 Единицы ферментативной активности. 8
7 Специфичность ферментов. 8
8 Термолабильность ферментов. 10
9 Влияние кислотности среды.. 11
10 Концентрация фермента. 12
11 Концентрация субстрата. 13
12 Активаторы и ингибиторы ферментов. 14
13 Аллостерические ферменты.. 16
14 Изоферменты.. 17
15 Классификация и номенклатура ферментов. 18
16 Использование ферментных препаратов. 22
17 Иммобилизованные ферменты.. 22
18 Витамины.. 23
19 Классификация витаминов. 25
20 Жирорастворимые витамины.. 26
20.1 Витамины группы А.... 26
20.2 Витамины группы D (кальциферол). 28
20.3 Витамины группы Е... 30
20.4 Витамины группы К... 32
21 Водорастворимые витамины.. 34
21.1 Общая характеристика витаминов группы B... 34
21.1.1 Витамин B1 (тиамин; антиневритный). 34
21.1.2 Витамин B2 (рибофлавин). 36
21.1.3 Витамин B3 (пантотеновая кислота). 38
21.1.4 Витамин B6. 39
21.1.5 Витамин B12. 42
21.2 Витамин РP (ниацин). 44
21.3 Витамин C... 46
21.4 Биотин (витамин H). 48
21.5 Витамин P (Цитрин). 49
21.6 Фолиевая кислота. Витамин Bc птероилглутаминовая кислота.. 50
21.7 Витамин U.... 51
22 Витаминоподобные вещества. 52
22.1 Парааминобензойная кислота.. 52
22.2 Витамин В15. 53
22.3 Инозит.. 53
22.4 Холин.. 54
22.5 Антивитамины... 55
Рекомендуемая литература. 56
Краткая история развития учения о ферментах
Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений.
Первые данные, указывающие на то, что в живых клетках содержатся вещества, катализирующие определённые реакции, были получены в 1897г. немецким учёным Э.Бухнером. В 1814г. К.С. Кирхгоф впервые получил препарат фермента (в виде раствора), вызывающего превращение крахмала в более простые сахара.
В 30-х годах XX в. некоторые ферменты были получены в кристаллическом состоянии. Так, в 1926 г. Самнер сообщил о выделении из бобов фермента уреазы, предположительно имеющего белковую природу. Однако отнесение уреазы к белкам сочли вначале нелепым. Последующие исследования Самнера и независимо Нортропа и Стенли привели к выделению ещё нескольких ферментов, и, наконец, в 1935 г. белковая природа ферментов стала общепризнанной. Большое значение этого открытия, в частности, отражено в факте присуждения Нобелевской премии в1946 г. Самнеру, Нортропу и Стенли.
Дальнейшие исследования подтвердили, что по химической природе ферменты являются белками.
Общие свойства ферментов и химических катализаторов небелковой природы
1. Ферменты не входят в состав конечных продуктов реакции и не расходуются в процессе катализа, выходя из реакции в неизменном виде, т.е. освобождаясь, могут снова реагировать с новыми молекулами субстрата.
2. Ферменты только ускоряют реакции, протекающие и без них, они не могут возбудить реакции, противоречащие законам термодинамики.
3. Ферменты не смещают положение равновесия, а лишь ускоряют его достижение.
Отличительные признаки ферментативного и химического катализа
1. Скорость ферментативного катализа намного выше, чем небиологического. Например, энергия активации реакции разложения перекиси водорода
H2O2 → H2O + ½O2
равна 75,3 кДж/моль, поэтому самопроизвольное разложение протекает настолько медленно, что выделяющийся кислород визуально незаметен. При добавлении неорганического катализатора – железа или платины – энергия активации снижается до 54,1 кДж/моль, реакция ускоряется в тысячи раз и становится заметной по выделению пузырьков кислорода. Фермент катализа, разлагающий перекись водорода, снижает энергию активации более чем в 4 раза и ускоряет реакцию разложения в миллиард раз. Реакция протекает настолько бурно, что раствор от выделяющегося кислорода буквально вскипает. Наконец, одна-единственная молекула фермента может катализировать при обычной температуре превращение от тысячи до миллиона молекул вещества в минуту. Эта скорость катализа недостижима для небиологических катализаторов.
2. Ферменты обладают высокой специфичностью, направляя превращение вещества в строгое русло.
3.Ферментативные процессы не дают побочных реакций, для них характерен 100 %-ный выход целевого продукта.
4. Ферменты катализируют реакции в мягких условиях (физиологических), т.е. при обычном давлении, небольшой температуре и значениях pH, более близких к нейтральным, однако весьма чувствительна к сдвигам pH среды и изменению температуры.
5. Ферменты регулируемы. То есть они могут изменять свою активность под воздействием ряда факторов, изменяя количественные выходы продуктов. Регуляция ферментативных систем лежит в основе координации всех процессов метаболизма во времени и пространстве, что обеспечивает воспроизведение живой материи и стабилизацию внутриклеточной среды.
6. Скорость ферментативных реакций прямо пропорциональна количеству фермента, поэтому недостаток фермента в организме означает низкую скорость превращения какого-либо соединения, и наоборот, одним из путей приспособления организма является увеличение количества требуемого фермента.
Строение ферментов
Как и другие белки, ферменты имеют первичную, вторичную, третичную и четвертичную структуры. Им присущи все физико-химические свойства белков, и лишь одна отличительная особенность у них – это способность катализировать химические реакции.
Все ферменты делятся на две большие группы – однокомпонентные и двухкомпонентные. Однокомпонентные ферменты состоят из одного белка, обладающего каталитическим действием. Двухкомпонентные состоят из белковой части – называемой апоферментом, и небелковой части, называемой кофактором. Оба компонента в отдельности лишены ферментативной активности.
Апофермент и кофактор образуют холофермент, т.е. функционально действенный энзим. Прочность связи между кофактором и апоферментом может быть различной. Если эта связь прочная и постоянная, то такой кофактор называют простетической группой. Если связывание белка и кофактора происходит в момент катализа, то такой кофактор называется коферментом.
Роль кофактора сводится либо к изменению трёхмерной структуры белка, способствующей лучшему связыванию фермента с субстратом, либо к непосредственному участию в реакции в качестве ещё одного субстрата. Соединение в холофермент осуществляется любыми типами связей, кроме ковалентных.
Роль кофактора выполняет какой-либо ион (Zn+2, Mg+2, Mn+2, Fe+2, Cu+2, K+, Na+) или органическое соединение, чаще всего производное витаминов.
Таблица 1–Некоторые кофакторы
| Кофактор | Общая функция | Витамин-предшественник |
| NAD+, NADF+ | Перенос водорода (протонов и электронов) | Никотиновая кислота – витамин PP |
| FAD | Перенос водорода (протонов и электронов) | Рибофлавин – витамин B2 |
| Коэнзим А | Активация и перенос ацильных групп | Пантотеновая кислота – витамин B3 |
| Пиридоксальфосфат | Перенос аминогрупп | Пиридоксин – витамин B6 |
| Тиаминпирофосфат | Декарбоксилирование кетокислот | Тиамин – витамин B1 |
Как правило, именно коферменты выступают в качестве дополнительных субстратов. Они обычно играют роль промежуточных переносчиков, электронов или химических групп, которые в результате ферментативной реакции переносятся от одного соединения на другое.
Кофакторы термостабильны, тогда как белковая часть фермента денатурирует при нагревании. Кофактор ответственен за каталитическую активность фермента, белковая же часть усиливает каталитическое действие и определяет специфичность фермента. Один и тот же кофактор может функционировать в составе разных ферментов. Например, одна и таже NAD+ (никатинамидадениндинуклеотид) является коферментом многих дегидрогеназ (окислительно-восстановительных ферментов), отличие – в апоферментной части (белке).
При изучении взаимодействия фермента и субстрата было обращено внимание на то, что молекула фермента по размеру во много раз больше молекул субстрата. Это дало основание полагать, что субстрат взаимодействует не со всей молекулой фермента, а с каким-то небольшим участком, расположенным на его поверхности. Этот участок называется активным центром. Он находится в углублении поверхности белковой молекулы. У однокомпонентных ферментов активный центр образуется при формировании третичной структуры белка в результате сближения и определённой ориентации аминокислотных остатков, расположенных в различных концах полипептидной цепи. В двухкомпонентных ферментах активный центр представляет собой комплекс кофактора и нескольких примыкающих к нему аминокислотных остатков.
Чаще всего в активном центре содержатся остатки аминокислот гистидина, глутамина, аспарагина, цистеина, треонина. В активном центре фермента условно различают место, к которому прикрепляется субстрат – связующий или субстратный центр и каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом. Сказанное может быть представлено в следующей общей форме:
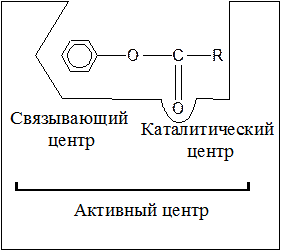
Рисунок 1 – Строение активного центра фермента
Структура активного центра комплементарна структуре его субстрата. Поэтому данный фермент из множества веществ находящихся в клетке, присоединяет только свой субстрат. У ферментов, имеющих четвертичную структуру, число активных центров может быть равно числу субъединиц.