Кінетика ферментативного каталізу
Будь-яка хімічна реакція характеризується, крім принципової можливості її протікання (обумовленої законами термодинаміки), швидкістю процесу.
Швидкість ферментативної реакції – зміна концентрації [S] або [P] за одиницю часу. Вимірявши її швидкість, тобто швидкість у присутності ферменту, ми повинні виміряти швидкість реакції й у відсутності ферменту (спонтанно протікає реакція). Саме ця різниця і характеризує роботу ферменту.
Вимірюючи швидкість реакції, завжди треба вимірювати початкову швидкість процесу, тобто швидкість ферментативної реакції, у досить короткий проміжок часу, коли концентрація субстрату змінюється, так, щоб це відбилося на швидкості процесу.
Одиниці виміру швидкості реакції можуть бути різними. Краще користуватися молярними одиницями, а час – виражати в хвилинах або секундах. Тому швидкість реакції може виражатися, наприклад, у мкмоль/хв. або ммоль/година.
Величина швидкості визначається за законом діючих мас. У загальному випадку швидкість хімічної реакції пропорційна добуткові концентрації реагуючих речовин.
У випадку ферментативної кінетики – одна з реагуючих речовин – фермент, концентрація якого на багато порядків менша, ніж концентрація субстрату. Це визначає деякі особливості кінетики ферментативного каталізу.
V = k+2 × [E] ×[S] (1)
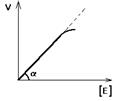
Залежність швидкості ферментативної реакції від концентрації ферменту [E] при постійній і досить великій концентрації субстрату ([S]>>[E], [S]=const) має такий вид:
|
Відхилення від лінійності графіка при дуже високій концентрації ферменту виникає через недостаню кількість субстрату, тому знижується швидкість надходження субстрату на активний центр ферменту. Визначати швидкість ферментативної реакції треба тільки в тому діапазоні концентрацій ферменту у якому графік у вигляді лінії.
Лінійність цього графіка дозволяє виразити його однією цифрою – тангенс кута нахилу до осі абсцис. Цей тангенс являє собою величину активності ферменту. Робота (ефективність) кожного ферменту кількісно характеризується величиною його активності, тобто величиною швидкості ферментативної реакції в розрахунку на одиницю кількості ферменту.
Залежність швидкості ферментативної реакції від концентрації субстрату при [E] = const і [S] >> [E].
Зі збільшенням концентрації субстрату збільшується швидкість реакції. Ця залежність гіперболічна.

Граничне значення, до якого прагне гіпербола – Vmax даної реакції – характеризує максимальну роботу ферменту (2):
Vmax = k+2 × [E] (2)
Таким чином, Vmax –це межа, до якої прагне швидкість реакції при нескінченному підвищенні концентрації субстрату.
Км – це константа Міхаеліса. Вона чисельно дорівнює концентрації субстрату, при якій швидкість реакції складає половину від максимального значення.
Ця крива описується рівнянням Міхаеліса-Ментен (3):
V =Vmax × ([S] / Km + [S]) (3)
Фізичний зміст Км. КМ − це константа рівноваги між двома реакціями, що приводять до розпаду фермент-субстратного комплексу і тією реакцією, що веде до утворення цього комплексу (4).
Km = k-1 + k+2 / k+1 (4)
Оскільки значення k+2 завжди набагато нижче, ніж k-1, тоді (5):
Km » k-1 / k+1 = Ks (5)
Ks – субстратна константа. Характеризує константу рівноваги 1-го етапу ферментативної реакції. Отже, Км теж досить близька до Кs.
Отже, Км, як і Кs, характеризує спорідненість субстрату до даного ферменту. Але експериментально визначити k-1 і k+2 дуже важко, тому важко визначити і Кs.
За допомогою Км можна охарактеризувати спорідненість даного фермента до даного субстрату. Чим менша Км, тим більша спорідненість ферменту до даного субстрату, а значить тим більша рівновага першого етапу ферментативної реакції зміщена вправо –в сторону утворення фермент-субстратного комплексу. Отже, будуть створені найкращі умови для протікання і другого етапу ферментативного процесу. За таких умов для досягнення ефективного перетворення субстрату потрібна мала концентрація субстрату. Vmax теоретично може бути досягнута при малих кількостях субстрату.
Якщо Км висока, то це означає, що спорідненість ферменту до такого субстрату низька і реакція при невеликих концентраціях субстрату протікає неефективно.
Км і Vmax – це дві кінетичні константи, за допомогою яких можна характеризувати ефективність роботи ферменту, у тому числі і in vivo.
За мірою підвищення концентрації субстрату швидкість буде зростати до тих пір, доки не відбудеться насичення ферменту субстратом. При подальшому підвищенні концентрації субстрату початкова швидкість вже не буде зростати.
Концентрація субстрату, при якій швидкість складає половину максимальної, позначається через КМ та має назвуконстанти Міхаелісу.Її можна визначати з графіку залежності V від [S].
|

Рівняння Міхаеліса-Ментена описує поведінку багатьох ферментів при зміні концентрації субстрату:
| |||
| |||