МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
ФЕРМЕНТЫ
Ферменты, или энзимы - вещества белковой природы, обладающие каталитической активностью. Явления брожения и переваривания известны давно. Термин «энзим» (от греч. en zyme- в дрожжах), так же как и «фермент» (от лат. fermentatio - брожение). Учение о ферментах выделено в самостоятельную науку энзимологию.
Хотя уже осуществлен лабораторный синтез ряда ферментов — рибонуклеазы, лизоцима, единственный способ получения ферментов — это выделение их из биологических объектов. Для выделения ферментов из клеточного содержимого необходимо тонкое измельчение, вплоть до разрушения субклеточных структур. Все операции проводят в условиях, исключающих денатурацию белка (использование защитных добавок, низкая температура). Используют специальные приемы - экстракция глицерином, метод ацетоновых порошков, метод ионообменной хроматографии, метод молекулярных сит, электрофорез, афинная хроматография,где адсорбентом служит вещество, с которым фермент взаимодействует избирательно.
Содержание ферментов в различных субклеточных структурах неодинаково. Ферменты гликолиза сосредоточены преимущественно в цитоплазме, ферменты цикла Кребса - в митохондриях.
Доказательства белковой природы ферментов:
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и др. факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты оказывают высокоспецифическое действие.
Прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента - рибонуклеазы, осуществленный в 1969 г. в лаборатории Б. Меррифилда в Нью-Йорке. В н. 80-х годов XX в. была открыта способность низкомолекулярных рибонуклеиновых кислот выполнять каталитическую функцию. Эти соединения назвали рибозимами.
Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др. Большинство природных ферментов - сложные белки. Их небелковые компоненты называются кофакторамии необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД+, ФАД); фосфорные эфиры некоторых моносахаридов, ионы металов (Zn2+, Mg2+, Mn2+, Fe2+).
Кофермент- небелковый фактор, который легко отделяется от белковой части - апоферментапри диссоциации. Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента. В апоферменте есть участок, избирательно связывающий кофермент. Это кофермент связывающий домен. Его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, сходна. Весь фермент вместе с простетической группой назыывают холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
Активный центр - специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе (слайд 5).Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных участках полипептидной цепи. Поэтому активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют роль промежуточных переносчиков атомов или групп.
Активный центр у ферментов располагается на дне щели при двухъядерной структуре, например у лизоцима, или на дне глубокой впадины, как у химотрипсиногена и трипсина. В активном центре различают два участка.
Субстратный (связывающий) центр - участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие аминокислоты, как серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
Молекула субстрата также содержит функционально различные участки: специфическую связь или группу атомов, подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом. В связывании фермента и субстрата большую роль играют силы гидрофобных взаимодействий и водородные связи, возникающие между радикалами аминокислотных остатков субстратного центра фермента и соответствующими группировками в молекуле субстрата.
Аллостерический центр - участок молекулы фермента вне его активного центра, который способен связываться слабыми типами связей с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и изменяется каталитическая активность фермента. Это т. н. аллостерическая регуляциякаталитической активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими. Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров.
Некоторые из ферментов являются полифункциональными,т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Единая цепь образует несколько доменов,каждый из которых характеризуется своей каталитической активностью. Например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков, участвует в метаболизме ряда нейромедиаторов, гормонов.
Изоферменты- это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам - сродству к субстрату, активности, электрофоретической подвижности.
Существуют ферменты, молекулы которых состоят из двух и более субъединиц, т.е. являющиеся мультимерами. Если молекулы мультимера составлены из субъединиц двух типов, то в зависимости от соотношения протомеров разных типов фермент может существовать в виде нескольких изомеров - изозимов.Классический пример - фермент лактатдегидрогеназа, ускоряющий в мышцах превращение лактата в пируват и обратно. Его молекула состоит из четырех субъединиц двух типов - Н (от англ. heart — сердце)и М (muscle — мышцы):
НННН НННМ ННММ НМММ ММММ
В зависимости от возраста, физиологического состояния и других причин в организме устанавливается то или иное соотношение изозимов, Это используется для диагностики болезней в медицине.
Особую группу ферментов составляют мультимолекулярные ферментные комплексы, в состав которых входят разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Примеры: пируватдегидрогеназный комплекс, состоящий из трех видов ферментов, катализирующий реакцию окислительного декарбоксилирования пировиноградной кислоты, НАДФН-оксидаза. При ассоциации отдельных ферментов в единый комплекс сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов. В результате мультиэнзимы с огромной скоростью осуществляют превращение субстратов.
В тех случаях, когда мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий и др..
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Фермент Е обратимо соединяется с субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р.

Эти представления легли в основу теории «ключа-замка» Э. Фишера (1890), которую иногда называют теорией «жесткой матрицы». Структура активного центра комплементарна молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи.
Д. Кошлендом была разработана теория «индуцированного соответствия» (1958). Пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом («перчатка — рука»). Субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию. Т.е. фермент только в момент присоединения субстрата будет находиться в активной (напряженной) Т-форме (tensile) в отличие от неактивной R-формы (relaxe). Конформационные перестройки в ферменте в процессе изменения его активности Кошленд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат). Между ферментом и субстратом существует пространственная или геометрическая комплементарность и электростатическое соответствие. Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Присоединение субстрата к активному центру фермента в случае их комплементарности приводит к формированию активного комплекса. В противном же случае формируется неактивный комплекс.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия.Сохраняя основные положения теории «индуцированного соответствия», она объясняет специфичность действия ферментов узнаванием той части субстрата, которая не изменяется при катализе. Предполагается индуцирование изменений в молекуле субстрата при его взаимодействии с ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Как катализируемая ферментом, так и не катализируемая им реакция имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Однако ферментативная реакция имеет более низкую энергию активации. Действуя на скорость реакции, ферменты не изменяют положения равновесия между прямой и обратной реакциями, а лишь ускоряют его наступление.
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (V) измеряют по убыли количества субстрата или приросту продукта за единицу времени.
При ферментном катализе фермент (Е) обратимо соединяется с субстратом (S), образуя нестойкий фермент-субстратный комплекс (ES), который в конце реакции распадается с освобождением фермента (Е) и продуктов реакции (Р):
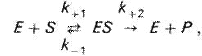
График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы.
При низкой концентрации субстрата скорость реакции прямо пропорциональна его концентрации (участок а графика) иопределяется уравнением:

При высокой концентрации субстрата, когда все молекулы фермента находятся в форме фермент-субстратного комплекса, достигается полное насыщение активных центров фермента субстратом, а скорость реакции становится максимальной (Vmax) (участок в).
При полунасыщении, когда половина молекул фермента находится в форме ES, скорость реакции равна половине максимальной (участок б).
Скорость химической реакции, ускоряемой ферментом (как и скорость обычной химической реакции),

v+1 = k+1 [А][В]; v−1 = k−1 [С][D].
K-1 – константа скорости обратной реакции,
K+1 – константа скорости прямой реакции.
В состоянии равновесия v+1 = v−1, тогда k+1[А][В] = k−1[С] [D].

Константа диссоциации фермент-субстратного комплекса KS – величина, обратная константе равновесия.

Ksзависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение Ks, тем выше сродство фермента к субстрату.
Л. Михаэлис и М. Ментен вывели уравнение, названное уравнением Михаэлиса – Ментен. Оно выражает количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:

Vmax — величина, постоянная для каждого фермента, которая позволяет оценить эффективность его действия.
Уравнение Михаэлиса-Ментен не учитывает влияние на скорость ферментативного процесса продуктов реакции.
Поэтому было предложено уравнение Бриггса – Холдейна:

где Кm – экспериментально определяемая константа Михаэлиса:

Кривая этого уравнения – гиперболическая зависимость V от концентрации S.
Константа Михаэлиса численно равна концентрации субстрата, при которой скорость ферментативной реакции составляет половину от Vmax. Кm показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство. Экспериментальные значения Кmдля большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М.
Изоферменты могут различаться по значению Кm. Для изоферментов глюкокиназы и гексокиназы, катализирующих реакцию фосфорилирования глюкозы, значение Кm различается в 50 раз.
Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции. Например, карбоангидраза для СО2 имеет Кm, равную 1,2.10-2 М, а для НСО3- Кm больше и равна 2,6.10-2 М.
В случае множественных форм ферментов и аллостерической природы фермента кинетическая кривая имеет не гиперболическую форму, а сигмоидный характер. Это означает, что связывание одной молекулы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т. е. имеет место кооперативное взаимодействие (кислород с гемоглобином).
Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса – Холдейна и получили уравнение прямой линии: у = ах + b.

Метод Лайнуивера – Берка дает более точный результат.
СВОЙСТВА ФЕРМЕНТОВ
Ферменты отличаются от обычных катализаторов рядом свойств.
Термолабильность, или чувствительность к повышению температуры.
При температуре, не превышающей 45–50°С, скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С (правило Вант-Гоффа). При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса. Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия. При температуре 100°С почти все ферменты утрачивают свою активность (исключение составляет фермент мышечной ткани миокиназа, которая выдерживает нагревание до 100°С).
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40°С. Существуют ферменты с более высоким температурным оптимумом: у бактерий, живущих в горячих источниках, он может превышать 70 °С. Именно такие ферменты используются в качестве добавок к стиральным порошкам для стирки в горячей воде.
При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля.