ДЛЯ ГОСУДАРСТВЕННОГО ПЕРЕВОДНОГО ЭКЗАМЕНА
ТЕСТЫ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
1. На чем основано разделение катионов по кислотно-основной классификации?
-1. на различной растворимости фосфатов в воде, кислотах, щелочи, водном растворе NH3;
+2. на различной растворимости хлоридов, сульфатов и гидроксидов в воде, растворе щелочи, водном растворе аммиака;
-3. на различной растворимости сульфидов, карбонатов в воде;
-4. на различной растворимости сульфидов в воде, сильных кислотах и сульфиде аммония;
-5. нет правильного ответа.
2. На сколько групп делятся катионы в кислотно-основной схеме анализа?
-1. на 3 группы;
-2. на 4 группы;
-3. на 5 групп;
+4. на 6 групп;
-5. нет правильного ответа.
3. Какой из приведенных реагентов используют для отделения Pb2+, Ag+, Hg22+ по кислотно-основной схеме анализа?
+1. 2 М HCl;
-2. 2 М H2SO4;
-3. 6 M NaOH + H2O2;
-4. 6 M NH3;
-5. 2 M (NH4)CO3.
4. Как проводят отделение VI группы катионов от V группы по кислотно-основной схеме?
-1. добавление 6 М раствора NaOH и H2O2;
-2. действием избытка концентрированного NaOH и 3% H2O2;
+3. действием водного 6 М раствора аммиака;
-4. действием раствора карбоната аммония;
-5. нет правильного ответа.
5. Какой групповой реактив используют для обнаружения данной группы анионов: SO42-, SO32-, S2O32-, CO32-, C2O42-, PO43-, AsO33-, AsO43-, BO2-?
-1. раствор HCl;
+2. BaCl2 в нейтральной среде;
-3. AgNO3 в азотнокислой среде;
-4. KMnO4 в нейтральной среде;
-5. нет правильного ответа.
6. Раствор нитрата серебра в азотнокислой среде используют для обнаружения следующих ионов:
-1. SO42-, SO32-, S2O32-;
+2. Cl-, Br-, I-, SCN-, S2-, IO3-, BrO3-;
-3. NO2-, CO32-, SO32-, S2O32-;
-4. CH3COO-, NO2-, NO3-;
-5. нет правильного ответа.
7. Предварительное обнаружение анионов-окислителей проводят с помощью следующего реагента:
-1. BaCl2 в нейтральной среде;
-2. AgNO3 в азотнокислой среде;
-3. I2 в нейтральной среде;
-4. KMnO4 в нейтральной среде;
+5. KI в нейтральной среде.
8. Как избирательно осадить SO42- -ионы из смеси анионов SO32-, S2O32-, SO42- , PO43-?
-1. солями лития;
-2. солями стронция;
+3. солями бария и обработать HCl;
-4. восстановить Zn в кислой среде;
-5. нет верного ответа.
9. Известны систематические методы анализа:
-1. фторидный;
-2. перхлоридный;
+3. кислотно-основный;
-4. сульфатный;
-5. никелево-литиевый.
10. В какой строке перечислены катионы, для отделения которых в виде осадков в кислотно-основном систематическом методе используется 2 М H2SO4?
+1. Ca2+, Ba2+, Sr2+;
-2) Cu2+, Co2+, Cr3+;
-3) Ni2+, Hg2+, Hg22+;
-4) Mn2+, Mg2+, Ag+;
-5) Zn2+, Al3+, Sr2+.
11. Какие общие свойства имеют хлорид, бромид и иодид-ионы?
-1. образуют осадки с ионом бария в нейтральной среде;
+2. образуют осадки с ионом серебра в кислой среде;
-3. обладают выраженными окислительными свойствами;
-4. образуют осадки с ионами натрия в кислой среде;
-5. не склонны вступать в окислительно-восстановительное взаимодействие.
12. Величины ступенчатых констант образования для комплекса MeL3 составляют К1=1·102, К2=1·103, К3=1·105. Общая константа образования данного комплекса равна:
-1. 1·105;
+2. 1·1010;
-3. 1·109;
-4. 1·103;
-5. 1·102.
13. Для каких соединений ионная сила раствора равна молярной концентрации?
-1. хлорид магния;
+2. бромид калия;
-3. сульфат меди;
-4. ацетат меди;
-5. нитрат алюминия.
14. Уравнение материального баланса по серебру для раствора [Ag(NH3)2]NO3 имеет вид:
+1. CAg = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+];
-2. CAg = [Ag+] + [NH3] ;
-3. CAg = [Ag+] + [Ag(NH3)+] + 2[Ag(NH3)2+];
-4. CAg = [Ag+] + [NO3-];
-5. CAg = [Ag(NH3)+] + [Ag(NH3)2+].
15. Чему равна ионная сила раствора с концентрацией MgSO4 0,1 моль/л:
-1. 0,1;
-2. 0,2;
-3. 0,3;
+4. 0,4;
-5. 0,6.
16. Какое значение рН 0.1 М раствора HCl?
+1. 1;
-2. 2;
-3. 7;
-4. 14;
-5. 12.
17. Найдите рН раствора с рОН = 10:
-1. 1;
+2. 4;
-3. 7;
-4. 8;
-5. 0.
18. Величина рН 0,01 М HCl составляет:
-1. 1,0;
-2. 3,0;
-3. 7,0;
-4. 10,0;
+5. 2,0.
19. Величина рН 0,001 М HCl составляет:
-1. 1,0;
+2. 3,0;
-3. 5,0;
-4. 7,0;
-5. 9,0.
20. Укажите буферные растворы:
+1. смесь СH3COOH и СH3COONa;
-2. смесь СH3COOH и HCl ;
-3. смесь СH3COOK и СH3COONa;
-4. смесь СH3COOH и HNO3;
-5. нет правильного ответа.
21. Какие из перечисленных ниже кислот обладают в водном растворе слабыми кислотными свойствами:
-1. хлороводородная кислота;
-2. хлорная кислота;
-3. азотная кислота;
-4. серная кислота;
+5. угольная кислота.
22. Какая из кислот сильнее всего ионизирована в водном растворе при одинаковой концентрации?
-1. этановая кислота (рКа = 4,75);
+2. метановая кислота (рКа = 3,80);
-3. катион аммония (рКа = 9,25);
-4. циановодородная кислота (рКа = 9);
-5. степень ионизации одинакова.
23. Какое из оснований является самым слабым в водном растворе при одинаковой концентрации?
-1. гуанидин (рКBH+ = 13,6);
-2. аммиак (рКBH+ = 9,25);
-3. пиридин (рКBH+ = 5,18);
+4. анилин (рКBH+ = 4,63);
-5. новокаин (рКBH+ = 8,8).
24. В 1 л раствора содержится 0,01 моль HCl. Каково значение рН данного раствора?
-1. рН = 3;
-2. рН = 7;
+3. рН = 2;
-4. рН = 5;
-5. рН = 1.
25. К 1 л воды добавили 0,01 моль NaOH. Каково значение рН образовавшегося раствора?
+1. рН = 12;
-2. рН = 13;
-3. рН = 10;
-4. рН = 6;
-5. рН = 9.
26. Водный раствор какого из перечисленных веществ (концентрация 0,1 моль/л) имеет наименьшее значение рН?
-1. муравьиная кислота (pKa=3,8);
-2. уксусная кислота (pKa=4,8);
-3. хлорид аммония (pKa=9,3);
+4. фтороводородная кислота (pKa=3,2);
-5. хлорноватистая кислота (pKa=7,6).
27. У какого из перечисленных растворов величина рН максимальна?
-1. 0,1 М NaCl;
-2. 0,1 М NaHCO3;
-3. 0,1 М Na2CO3;
+4. 0,2 М NaOH;
-5. 0,1 M CH3COONa.
28. Какие из перечисленных веществ являются амфолитами?
-1. ацетат натрия;
-2. натрия хлорид;
+3. аминоуксусная кислота;
-4. 2-гидроксипропановая кислота;
-5. хлорид алюминия.
29. При рН =4,75 молярная концентрация ацетат-ионов в 0,1 М CH3COONa (рКа =4,75) составляет:
-1. 0,01 М;
-2. 0,03 М;
+3. 0,05 М;
-4. 0,09 М;
-5. 0,1 М.
30. Показатель константы кислотности иона аммония равен 9,25. При каком значении рН равновесная концентрация иона аммония равна половине общей концентрации аммиака в растворе?
-1. 7,25;
-2. 8,25;
+3. 9,25;
-4. 10,25;
-5. 11,25.
31. К 100 мл 0,1 М NH3 прибавляют 0,1 М NH4Cl. При добавлении какого объёма раствора NH4Cl буферная ёмкость полученного буферного раствора будет максимальной?
-1. 25 мл;
-2. 50 мл;
-3. 75 мл;
+4. 100 мл;
-5. 200 мл.
32. В каких случаях при смешивании указанных ниже растворов будут образовываться кислотно-основные буферные системы?
-1. 10 мл 0,1 М HCl + 10 мл 0,1 М NaOH;
-2. 10 мл 0,1 М NH4Cl + 10 мл 0,1 М NaCl;
-3. 10 мл 0,1 М NH3 + 10 мл 0,1 М NaOH;
-4. 10 мл 0,1 М CH3COOH + 10 мл 0,1 М NaOH;
+5. 10 мл 0,1 М CH3COOH + 10 мл 0,1 М CH3COONa.
33. В 1 л воды может раствориться 10-5 моль AgCl. Каково произведение растворимости данного соединения?
-1. 10-5;
+2. 10-10;
-3. 10-15;
-4. 10-20;
-5. нет правильного ответа.
34. Через какие величины выражают концентрационную константу растворимости (Ks)?
-1. активности ионов осадка;
+2. равновесные концентрации ионов осадка;
-3. общие концентрации ионов-осадителей;
-4. концентрации ионов, вызывающих электростатическое взаимодействие;
-5. нет правильного ответа.
35. Укажите осадки, расворимые в растворе NH3:
+1. AgCl;
-2. Fe(OH)3;
-3. Mn(OH)2;
-4. BaSO4;
-5. нет верного ответа.
36. Назовите физический смысл явления, называемого «солевым эффектом»:
-1. увеличение растворимости осадка под действием комплексующего агента;
-2. уменьшение растворимости под действием одноименного иона;
+3. увеличение растворимости осадка под действием посторонних сильных электролитов;
-4. увеличение растворимости осадка за счет образования малодиссоциирующего электролита;
-5. нет правильного ответа.
37. Как влияет 1.5-кратный избыток осадителя (NaCl) на полноту осаждения AgCl?
+1. растворимость уменьшается;
-2. растворимость увеличивается;
-3. растворимость не изменяется;
-4. образования осадка не происходит;
-5. нет правильного ответа.
38. Какое из веществ обладает наибольшей растворимостью в воде:
-1. BaCO3 (Ks = 4,0×10-10);
-2. BaC2O4 (Ks = 1,1×10-7);
-3. BaCrO4 (Ks = 1,2×10-10) ;
-4. BaMoO4 (Ks = 4,0×10-8);
+5. BaSO3 (Ks = 8,0×10-7).
39. Укажите осадки, растворимые в разбавленной HNO3:
-1. AgCl ;
-2. CaSO4;
+3. Cu(OH)2 ;
-4. BaSO4;
-5. Ag2S.
40. Какое из веществ обладает наименьшей растворимостью в воде:
-1. AgCl (Ks = 1,8×10-10);
-2. AgBrO3 (Ks = 5,7×10-5);
-3. AgIO3 (Ks = 3,1×10-8) ;
-4. AgBr (Ks = 5,2×10-13);
+5. AgI (Ks = 8,3×10-17).
41. Если растворимость AgCNS в насыщенном водном растворе составляет 10-6 моль/л, то чему будет равно Ks AgCNS?
-1. 10-11;
+2. 10-12;
-3. 10-33;
-4. 10-22;
-5. нет правильного ответа.
42. Какое соединение первым выпадет в осадок, если к раствору с одинаковой концентрацией NaCl, NaBrO3, NaIO3, NaBr, NaI прибавляют постепенно AgNO3:
-1. AgCl (Ks = 1,8×10-10);
-2. AgBrO3 (Ks = 5,7×10-5);
-3. AgIO3 (Ks = 3,1×10-8) ;
-4. AgBr (Ks = 5,2×10-13);
+5. AgI (Ks = 8,3×10-17).
43. Произведение растворимости сульфата бария равно 1·10-10. Определите концентрацию сульфат-ионов в насыщенном растворе над осадком.
-1. 1·10-11 моль/л;
-2. 1·10- 22 моль/л;
-3. 1·10-7 моль/л;
+4. 1·10-5 моль/л;
-5. 1·10-3 моль/л;
44. Что из перечисленного сильнее всего увеличит растворимость оксалата кальция?
-1. повышение температуры раствора с 20 до 50 ºС;
-2. повышение ионной силы раствора с ~ 0 до 0,1;
-3. прибавление к 1 л раствора 0,1 моль оксалата натрия;
-4. прибавление к 1 л раствора 0,1 моль NaOH;
+5. прибавление к 1 л раствора 0,1 моль HNO3.
45. Для каких веществ уменьшение рН от 7 до 2 приведёт к заметному изменению растворимости?
+1. карбонат кальция;
-2. сульфид серебра;
-3. сульфат бария;
-4. хлорид ртути (I) ;
-5. иодид серебра.
46. Что такое смешаннолигандные комплексы?
-1. комплексы, включающие 2 центральных атома;
-2. координационно-ненасыщенные комплексы;
+3. комплексы, включающие 2 и более вида лиганда;
-4. комплексы, координационно-насыщенные;
-5. комплексы с полидентатными лигандами.
47.Координационное число и степень окисления железа в комплексе [Fe(CN)5NO]2-равны:
-1. 4 и +2;
-2. 6 и +2;
+3. 6 и +3;
-4. 4 и +3;
-5. 5 и +3.
48. Что является комплексообразователем в данном соединении - Na[Cr(NH3)2(CNS)4] ?
-1. Na+;
-2. NH3;
+3. Cr3+;
-4. CNS-;
-5. нет верного ответа.
49. Чем определяется максимальное координационное число комплексообразователя:
+1. природой центрального атома;
-2. природой лиганда;
-3. строением органического реагента;
-4. условиями опыта;
-5. нет верного ответа.
50. Что такое «хелаты»?
-1. комплексы с донорно-акцепторной связью металл -лиганд;
+2. комплексы, у которых центральный атом включен в циклическую структуру за счет взаимодействия с несколькими функционально-аналитическими группировками лиганда;
-3. соединения с неорганическими реагентами;
-4. комплексы со смешанной координационной сферой;
-5. нет правильного ответа.
51. Что такое функционально-аналитическая группировка органического реагента, участвующего в реакции комплексообразования?
-1. группировка атомов, включающая подвижные ионы H+;
+2. группировка атомов органического реагента, включающая атомы с неподеленной парой электронов;
-3. группировка атомов, обуславливающая ионообменный механизм взаимодействия реагента с ионами металлов;
-4. группировка атомов, предоставляющая свободную орбиталь;
-5. нет правильного ответа.
52. Что такое дентатность лиганда?
-1. число молекул воды, вытесняемых из аква-комплекса металла;
+2. число связей лиганда с комплексообразователем, определяющееся числом координационных мест занимаемых лигандом во внутренней координационной сфере;
-3. число атомов, образующих функционально-аналитические группировки;
-4. число атомов, присоединяемых во внешней координационной сфере;
-5. нет верного ответа.
53. Какой из лигандов является полидентатным?
-1. NH3;
-2. F-;
+3. этилендиаминтетраацетат;
-4. CNS-;
-5. нет верного ответа.
54. Укажите, какие из перечисленных циклических структур наиболее устойчивы при образовании хелатов:
-1. четырехчленные циклы;
-2. трехчленные циклы;
-3. десятичленные циклы;
+4. шестичленные циклы;
-5. семичленные циклы.
55. Какие из перечисленных лигандов являются бидентатными?
-1. молекула аммиака;
-2. хлорид-ион;
-3. тетраанион этилендиаминтетрауксусной кислоты;
-4. бромид-ион;
+5. молекула этилендиамина.
56. Какие из перечисленных соединений при взаимодействии с катионами металлов образуют внутрикомплексные соединения?
+1. ЭДТА;
-2. хлороформ;
-3. бензол;
-4. фенол;
-5. этанол;
57. Что такое окислитель?
-1. соединение, отдающее протоны в реакции;
+2. соединение, принимающее электроны в реакции;
-3. соединение, определяющее рН среды;
-4. соединение, выпадающее в осадок;
-5 нет верного ответа.
58. На что указывает большое положительное значение E0Ce4+/Ce3+:Ce4++ ē =Ce3+?
+1. на сильные окислительные свойства Ce4+;
-2. на сильные восстановительные свойства Ce3+;
-3. на сильные окислительные свойства Ce3+;
-4. на возможность окисления фторид-ионов до фтора (E0 F2 / 2F- =+2,87B);
-5. нет верного ответа.
59. На что указывает отрицательное значение ЭДС реакции?
+1. реакция не может самопроизвольно протекать в прямом направлении;
-2. реакция протекает самопроизвольно в прямом направлении;
-3. реакция протекает очень медленно;
-4. реакция протекает быстро;
-5. нет верного ответа.
60. Можно ли на основании величины E0 окислителя или восстановителя судить о скорости установления равновесия?
-1. можно;
+2. нельзя;
-3. можно, если ЭДС достаточно высока;
-4. можно, если реакция идет с участием протонов;
-5. нет верного ответа.
61. При каких условиях водородный электрод является стандартным?
+1. а(Н+)=1 моль/л, РН2=1 атм, Т любая;
-2. а(Н+)=0,1 моль/л, РН2=8 атм, Т=200С;
-3. а(Н+)=1 моль/л, РН2=0,1 атм, Т=1000С;
-4. а(Н+)=13 моль/л, РН2=1 атм, Т=25К;
-5. нет верного ответа.
62. Какие факторы влияют на величину реального окислительного потенциала IO3- : 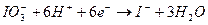 ?
?
-1. добавление ионов никеля;
+2. рН раствора;
-3. не влияет ни один фактор;
-4. добавление NaF;
-5. нет верного ответа.
63. На что указывает большое численное значение константы равновесия окислительно-восстановительной реакции?
+1. равновесие смещено вправо и реакция идет практически до конца;
-2. реакция протекает с выделением тепла;
-3. реакция протекает очень быстро;
-4. реакция протекает очень медленно;
-5. нет верного ответа.
64. Назовите самый сильный окислитель из следующего ряда:
-1. Br2 (E0(Br2/2Br-)=+1,09 B);
-2. KMnO4 (E0(MnO4-/Mn2+)=+1,51 B);
+3. NaBiO3 (E0(BiO3-/BiO+)=+1,80 B);
-4. Сl2 (E0(Cl2/2Cl-)=+1,36 B);
-5. Н2О2 (Е0(Н2О2/2ОН-)=+1,77 В).
65. Назовите самый сильный восстановитель из данного ряда:
-1. Zn (E0(Zn2+/Zn)= -0,76 B);
+2. Mg (E0(Mg2+/Mg)= - 2,37 B);
-3. H2 (E0(2H+/H2)= 0 B);
-4. Na2S2O3 (E0(S4O62-/2S2O32-)= +0,09 B);
-5. Na2SO3 (E0(SO42-/SO32-)= +0,17 B).
66. Как определить направление протекания окислительно-восстановительной реакции?
-1. по E0окислителя;
-2. по Е0восстановителя;
+3. по ЭДС = E0окислителя -Е0восстановителя;
-4. по концентрации восстановителя и окислителя;
-5. нет верного ответа.
67. Какое из перечисленных веществ является при стандартных условиях самым сильным окислителем?
-1. иод E0(I2/2I-)=+0,53 B;
-2. бром E0(Br2/2Br-)=+1,09 B;
-3. хлор E0(Cl2/2Cl-)=+1,36 B;
-4. периодат калия E0(IO4-/I-)=+1,28 B;
+5. перманганат калия E0(MnO4-/Mn2+)=+1,51 B.
68. Какие из перечисленных окислителей могут быть использованы при стандартных условиях для окисления ионов Mn2+ до перманганат-ионов (E0(MnO4-/Mn2+)=+1,51 B)?
-1. бром E0(Br2/2Br-)=+1,09 B
-2. хлор E0(Cl2/2Cl-)=+1,36 B
-3. дихромат калия E0(Cr2O7-/2Cr3+)=+1,33 B
+4. висмутат натрия E0(BiO3-/ BiO+)=+1,80 B
-5. иодат калия E0(IO3-/I-)=+1,08 B.
69. Как изменится реальный потенциал редокс-пары 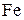
 , если к раствору добавить NaF?
, если к раствору добавить NaF?
+1. уменьшится;
-2. увеличится;
-3. сначала уменьшится, потом увеличится;
-4. сначала увеличится, потом уменьшится;
-5. не изменится.
70. Каким выражением определяется фактор разделения?
+1. D1/D2;
-2. C1(o)/C2(o);
-3. C2(o)/C2(в);
-4. C1(в)/C2(o);
-5. C2(o)/C1(o).
71. Квартование – это один из способов:
-1. отбора генеральной пробы гомогенных жидкостей;
-2. отбора генеральной пробы гетерогенных жидкостей;
+3. усреднения генеральной пробы твёрдых веществ;
-4. разложения пробы, сопровождающийся протеканием окислительно-восстановительных реакций;
-5. разложения пробы, не сопровождающийся протеканием окислительно-восстановительных реакций.
72. Какие методы пробоподготовки относят к методам минерализации?
-1. растворение в этиловом спирте;
-2. растворение в 2 М HCl;
+3. разложение под действием концентрированных серной и азотной кислот;
-4. растворение в хлороформе;
-5. растворение в воде.
73. Какие из перечисленных методов разделения относят к методам, основанным на различиях в распределении веществ между фазами?
-1. электрофорез;
-2. осаждение;
-3. отгонка;
-4. электродиализ;
+5. экстракция.
74. Реэкстракцией называется:
-1. процесс извлечения вещества из водной фазы в органическую;
+2. процесс извлечения вещества из органической фазы в водную;
-3. процесс разделения смеси веществ с помощью полупроницаемой мембраны;
-4. процесс выделения вещества с помощью сорбентов;
-5. процесс разделения смеси веществ, основанный на их различной скорости перемещения в электрическом поле.
75. При экстракции 100 мкг вещества А из 10 мл водной фазы в 10 мл хлороформа перешло 90 мкг этого вещества. Чему равна степень однократной экстракции вещества А?
+1. 90%;
-2. 18%;
-3. 45%;
-4. 9%;
-5. 0,9%.
76. При каком значении рН экстракция органической кислоты НА (рКа=5) неполярным органическим растворителем будет максимальной?
+1. 3;
-2. 4;
-3. 5;
-4. 6;
-5. 7.
77. Вещество экстрагируют хлороформом из 10 мл водной фазы. При использовании какого объема хлороформа степень однократной экстракции вещества будет максимальной?
-1. 5 мл;
-2. 10 мл;
-3. 20 мл;
-4. 30 мл;
+5. 40 мл.
78. Что такое воспроизводимость результатов анализа?
-1. правильность результатов анализа;
-2. величина систематической погрешности.
+3. мера близости результатов между собой;
-4. доверительный интервал среднего;
-5. нет верного ответа.
79. Что такое правильность результатов анализа?
+1. мера соответствия результатов анализа истинному значению;
-2. мера рассеяния результатов анализа, характеризуемая S;
-3. число степеней свободы выборки;
-4. среднее значение серии результатов анализа;
-5. нет верного ответа.
80. Какие методы анализа являются безэталонными?
-1. атомно-абсорбционная спектроскопия
-2. спектрофотометрия;
+3. гравиметрия;
-4. экстракционная фотометрия;
-5. потенциометрическое титрование.
81. Метод одного стандартного раствора можно использовать для определения концентрации вещества, если:
+1. зависимость аналитического сигнала от концентрации является линейной;
-2. зависимость аналитического сигнала от концентрации не является линейной;
-3. градуировочный график параболический;
-4. градуировочный график не проходит через начало координат;
-5. коэффициент корреляции для градуировочной зависимости меньше, чем 0,500.
82. При взаимодействии с восстановителями в кислой среде иодат-ион:
-1. 1 электрон;
-2. 2 электрона;
-3. 4 электрона;
-4. 5 электронов;
+5. 6 электронов.
83. Какие приемы используют для оценки правильности результата анализа?
-1. проведение нескольких параллельных измерений аналитического сигнала;
-2. вычисление дисперсии результата;
+3. способ «введено-найдено» ;
-4. вычисление относительного стандартного отклонения результата;
-5. проведение двух серий анализа и сравнение их дисперсий.
84. Экспериментальное значение F- критерия равно отношению:
-1. большего среднего значения к меньшему;
-2. меньшего среднего значения к большему;
+3. большей дисперсии к меньшей;
-4. меньшей дисперсии к большей;
-5. большего стандартного отклонения к меньшему.
85. Какие условия требуется соблюдать, чтобы выпал крупнокристаллический осадок?
-1. быстро добавлять осадитель;
+2. медленно добавлять осадитель;
-3. осаждать из холодных растворов;
-4. добавить десятикратный избыток осадителя;
-5. фильтровать сразу после осаждения.
86. Какова основная причина потерь при промывании аморфных осадков водой?
-1. солевой эффект;
+2. пептизация;
-3. ионизация вещества в растворе;
-4. коагуляция;
-5. нет правильного ответа.
87. Чем следует промывать аморфные осадки во избежание пептизации?
+1. раствором сильного электролита;
-2. холодной водой;
-3. горячей водой;
-4. раствором осадителя;
-5. нет правильного ответа.
88. Какой из приемов промывания осадка приведет к наиболее эффективной очистке осадка от адсорбированных примесей?
-1. однократное промывание большим объемом промывной жидкости;
+2. многократное промывание малыми объемами промывной жидкости;
-3. однократное промывание декантацией;
-4. однократное промывание малым объемом раствора осадителя;
-5. нет правильного ответа.
89. Чем следует промывать кристаллические осадки, чтобы избежать потерь от растворения их в промывной жидкости?
-1. раствором постороннего электролита;
-2. холодной водой;
-3. горячей водой;
+4. разбавленным раствором осадителя;
-5. нет правильного ответа.
90. Магний определяют в образце MgO. Образец растворяют в разбавленной HCl, осаждают, прокаливают до Mg2P2O7. Что является гравиметрической формой?
-1. Mg;
-2. MgO;
-3. MgNH4PO4×6H2O;
-4. MgNH4PO4;
+5. Mg2P2O7.
91. Процесс осаждения примесей на поверхности осадка называется:
+1. адсорбцией;
-2. окклюзией;
-3. инклюзией;
-4. изоморфным соосаждением;
-5. последующим осаждением;
92.Что из перечисленного приведёт к уменьшению количества примесей, адсорбируемых на осадке?
-1. охлаждение;
-2. уменьшение размера частиц осадка;
+3. промывание осадка раствором нитрата аммония;
-4. оставление аморфного осадка в маточном растворе для «старения» ;
-5. нет верного ответа.
93. 10,00 мл водного раствора NaOH неизвестной концентрации титровали 0,1000 М HCl в присутствии фенолфталеина. Как называют данный способ титрования?
-1. косвенное титрование,
-2. заместительное титрование,
-3. обратное титрование,
+4. прямое титрование,
-5. нет верного ответа
94. В качестве первичных стандартных веществ используют соединения, обладающие следующими требованиями:
+1. состав соединения строго соответствует формуле;
-2. соединение нерастворимо в воде;
-3. соединение летуче;
-4. соединение гигроскопично;
-5. соединение термоустойчиво.
95. Для того чтобы приготовить 25,00 мл 2,000 М NaCl, необходимо взять точную навеску хлорида натрия и далее:
-1. поместить её в химический стакан и добавить из бюретки 25,00 мл воды;
-2. поместить её в мерный цилиндр и добавить воду до соответствующего уровня;
-3. отмерить с помощью мерной колбы 25,00 мл воды, перелить её в химический стакан и растворить в ней взятую навеску хлорида натрия;
+4. поместить её в мерную колбу вместимостью 25,00 мл, растворить в воде и довести объём полученного раствора до метки;
-5. поместить её в любую подходящую ёмкость и добавить с помощью мерного цилиндра 25 мл воды.
96. Титр раствора гидроксида натрия равен 0,0040 г/мл. Чему равна молярная концентрация NaOH в данном растворе? М(NaOH)=40г/моль
+1. 0,10 моль/л;
-2. 0,013 моль/л;
-3. 0,028 моль/л;
-4. 0,21 моль/л;
-5. 0,54 моль/л.
97. Во сколько раз нужно разбавить 1 М NaCl для получения 0,1 М NaCl ?
+1. в 10 раз;
-2. в 20 раз;
-3. в 50 раз;
-4. в 100 раз;
-5. в 1000 раз.
98. 0,1 М раствор вещества А содержит 10,0 г вещества А в 1л. Какова молярная масса вещества А?
-1. 25,0 г/моль;
-2. 50,0 г/моль;
+3. 100,0 г/моль;
-4. 0,5 г/моль;
-5. 1,0 г/моль .
99. Какую массу вещества Х необходимо взять для приготовления 100 г раствора с массовой долей вещества 10%?
-1. 4,0 г ;
+2. 10,0 г;
-3. 40,0 г;
-4. 1,2;
-5. для расчета нужна молярная масса вещества Х .
100. Какой объем 0,1 М HCl нужен для нейтрализации 10 мл 0,1 М NaOH?
-1. 9,0 мл;
-2. 8,0 мл;
+3. 10,0 мл;
-4. 1,0 мл;
-5. 15,0 мл.
101. Во сколько раз нужно разбавить 1 М HCl для получения 0,001 М HCl ?
-1. в 10 раз;
-2. в 20 раз;
-3. в 50 раз;
-4. в 100 раз;
+5. в 1000 раз.
102. Какой объем 1 М NaOH необходим для нейтрализации 10 мл 0,1 М HCl?
+1. 1,0 мл;
-2. 0,2 мл;
-3. 15,0 мл;
-4. 5,0 мл;
-5. 2,0 мл.
103. В 100 г раствора вещества А содержится 0,5 г вещества А. Какова массовая доля вещества А в растворе (процентная концентрация)?
-1. 0,3%;
+2. 0,5 %;
-3. 1,5 %;
-4. 3,0 %;
-5. 3,5 %.
104. До какого объема необходимо разбавить 1 мл 1 М раствора NaOH , чтобы получить 0,01 М NaOH?
-1. до 10 мл;
-2. до 50 мл;
+3. до 100 мл;
-4. до 500 мл;
-5. до 1000 мл.
105. Что такое титр раствора?
-1. количество вещества (моль) в 1 мл раствора;
-2. количество вещества (моль эквивалента) в 1 мл раствора;
+3. масса вещества (г) в 1 мл раствора;
-4. масса вещества (г) в 500 мл раствора;
-5. количество вещества (моль) в 1000 мл раствора.
106. В качестве первичных стандартных веществ при стандартизации раствора HCl могут быть использованы:
-1. гидроксид калия;
-2. гидроксид натрия;
+3. карбонат натрия;
-4. гидрофталат калия;
-5. хлорид аммония.
107. Какие из перечисленных кислотно-основных индикаторов являются азосоединениями?
-1. п-ксиленоловый фиолетовый;
-2. феноловый красный;
+3. метиловый оранжевый;
-4. тимолфталеин;
-5. фенолфталеин.
108. Скачок титрования при титровании муравьиной кислоты 0,1 М раствором NaOH составляет 5,8-9,7. Какие индикаторы можно использовать для определения конечной точки такого титрования?
-1. метиловый оранжевый (рТ=4)
-2. метиловый красный (рТ=5)
-3. бромкрезоловый зеленый (рТ=4,5)
+4. фенолфталеин (рТ=9)
-5. нет верного ответа
109. К 100,0 мл 0,1 М HCl прибавили 100,0 мл 0,1 М KOH. Степень оттитрованности HCl равна:
-1. 0,1;
-2. 0,2;
-3. 0,5;
-4. 0,7;
+5.1,0.
110. При какой величине степени оттитрованности 0,01 М NaOH 0,01 М раствором HCl рН титруемого раствора будет равен 7,0?
-1. 0;
-2. 0,5;
-3. 0,9;
+4. 1,0;
-5. 1,5.
111. При титровании каких соединений стандартным раствором гидроксида натрия точка эквивалентности будет совпадать с точкой нейтральности?
-1. борная кислота;
-2. муравьиная кислота;
-3. уксусная кислота;
+4. хлороводородная кислота;
-5. нет верного ответа.
112. При определении азота в органических соединениях методом Кьельдаля разрушение органической части молекулы определяемого вещества проводят с помощью:
+1. конц. серной кислоты;
-2. конц. фосфорной кислоты;
-3. конц. азотной кислоты;
-4. смеси азотной и серной кислот (1:1) ;
-5. конц. хлорной кислоты.
113. Какое вещество используют в качестве титранта при определении веществ в среде безводной уксусной кислоты?
+1. хлорная кислота (в безводной уксусной кислоте);
-2. хлороводородная кислота (спиртовой раствор);
-3. хлороводородная кислота (водный раствор);
-4. хлорная кислота (водный раствор) ;
-5. уксусная кислота (водный раствор).
114. Какая кислота обычно используется для приготовления титранта в ацидиметрии?
-1. CH3COOH;
+2. HCl;
-3. HNO3;
-4. H2S;
-5. H2C2O4.
115. Какое основание обычно используется для приготовления титранта в алкалиметрии?
+1. NaOH;
-2. Ba(OH)2;
-3. Al(OH)3;
-4. NH3;
-5. Ca(OH)2.
116. По какой формуле следует рассчитать молярную массу эквивалента Na2CO3 , если Na2CO3 оттитрован HCl в присутствии фенолфталеина?
+1. MЭ= М. Na2CO3;
-2. MЭ =1/2 М Na2CO3;
-3. MЭ =1/3 М Na2CO3;
-4. MЭ =1/4 М. Na2CO3;
-5. MЭ =3/2 М Na2CO3 .
117. В каких координатах обычно строят кривую титрования кислоты HCl 0,1 М раствором NaOH?
+1. pH - VNaOH , мл;
-2. pH - VHCl , мл;
-3. [H+] - VHCl , мл;
-4. [OH-] - VNaOH , мл;
-5. [OH-] - VHCl , мл;
118. От каких факторов преимущественно зависит величина скачка на кривой титрования слабой кислоты титрованным раствором NaOH?
-1. от температуры;
-2. от начального объема раствора;
+3. от исходной концентрации кислоты;
-4. от природы применяемого индикатора;
-5. нет правильного ответа.
119. В каком случае точка эквивалентности совпадает с точкой нейтральности, если титрование проводят в водном растворе?
-1. при титровании слабой кислоты сильным основанием;
+2. при титровании сильной кислоты сильным основанием;
-3. при титровании слабого основания сильной кислотой;
-4. во всех перечисленных случаях;
-5. нет правильного ответа.
120. Сколько скачков титрования на кривой титрования Na2CO3 раствором 0,1 М HCl?
-1. пять;
+2. два ;
-3. четыре;
-4. нет скачка титрования;
-5. нет правильного ответа.
121. Какой индикатор следует брать при титровании 0,1 М CH3COOH 0,1 М раствором NaOH ( скачок титрования от рН 7,7 до рН 10,0)?
-1. лакмус рТ=7;
-2. бромфеноловый синий рТ=4;
+3. фенолфталеин рТ=9;
-4. метиловый красный рТ=5;
-5. нет верного ответа.
122. Какое действие оказывает безводная уксусная кислота на слабые основания?
+1. усиливает основные свойства;
-2. уменьшает основные свойства;
-3. не оказывает влияния на основные свойства;
-4. дифференцирует силу оснований;
-5. нет верного ответа.
123. Какой метод не относится к окислительно-восстановительному титрованию?
-1. хлориодометрия;
-2. иодатометрия;
-3. цериметрия;
+4. гравиметрия;
-5. иодометрия.
124. Ферроин – это хелатное соединение иона железа и:
-1. фенола;
-2. антрацена;
+3. фенантролина;
-4. дифениламина;
-5. пиперидина.
125. В иодометрическом методе титрования для приготовления стандартного раствора иода навеску титранта растворяют в:
-1. в воде;
-2. в хлороформе;
-3. в разбавленной серной кислоте;
-4. в растворе гидроксида натрия;
+5. в растворе иодида калия.
126. Какие из перечисленных веществ содержат «активный хлор»?
-1. хлорид натрия;
-2. дихлорэтан;
-3. хлороформ;
-4. хлорбензол;
+5. хлорамин.
127. Смесь Na2CO3 b NaOH титруют HCl (индикатор фенол-фталеин). Что при этом оттитровывают:
-1. NaOH;
-2. Na2CO3;
-3. NaOH и Na2CO3;
+4. NaOH и Na2CO3 до NaHCO3.
-5. нет верного ответа.
128. Конечную точку прямого броматометрического титрования хлорида сурьмы (III) можно обнаружить по:
+1. обесцвечиванию метилового оранжевого;
-2. изменению окраски метилового оранжевого от жёлтой до красной;
-3. исчезновению синей окраски иодкрахмального комплекса;
-4. исчезновению жёлтой окраски титруемого раствора;
-5. появлению синей окраски в присутствии крахмала.
129. В конечной точке прямого цериметрического титрования ионов железа (+2):
-1. раствор крахмала синеет;
+2. появляется окраска от избытка титранта;
-3. исчезает окраска метилового оранжевого;
- 4. изменяется температура раствора;
-5. появляется малиновая окраска хлороформного слоя.
130. В каких координатах строят кривую окислительно-восстановительного титрования?
-1. Е – А;
-2. Е - время, сек;
+3. Е - V титранта, моль/л;
-4. Ео - V окислителя, мл;
-5. Ео - V восстановителя, мл.
131. Чем определяется величина скачка титрования на кривой титрования при окислительно-восстановительном титровании
+1. разностью стандартных (или формальных) окислительных потенциалов реагирующих веществ;
-2. объемом титруемого раствора;
-3. скоростью протекания окислительно-восстановительных реакций;
-4. скоростью установления равновесия в системе;
-5. нет правильного ответа.
132. Чему равна молярная масса эквивалента натрия тиосульфата (Na2S2O3) в реакции с иодом, используемой для стандартизации раствора натрия тиосульфата?
-1. Мэ = М/2;
+2. Mэ = М;
-3. Мэ = М/4;
-4. Мэ = 2М;
-5. Мэ = М/6.
133. Какие соединения могут быть использованы для стандартизации натрия тиосульфата?
+1. I2;
-2. KCl;
-3. NaCl;
-4. Na2C2O4;
-5. Na2B4O7 × 10 H2O.
134. Как определяют точку эквивалентности в иодометрическом титровании?
+1. с помощью 5% раствора крахмала;
-2. с помощью дифениламина ;
-3. с помощью кислотно-основных индикаторов;
-4. с помощью металлохромных индикаторов;
-5. нет верного ответа.
135. Какие соединения можно определить броматометрически?
-1. NaCl;
+2. фенол;
-3. NaOH;
-4. KF;
-5) все перечисленные соединения.
136. Как готовят раствор иода для иодометрического титрования?
-1. растворяют навеску иода в воде.
+2. растворяют навеску иода в концентрированном растворе калия иодида и разбавляют водой;
-3. используют этиловый спирт как растворитель;
-4. используют хлороформ как растворитель;
-5. нет верного ответа.
137. Как рассчитать молярную массу эквивалента титранта нитритометрии - NaNO2?
-1. Мэ = М/5;
-2. Mэ = М/4;
-3. Мэ = М/3;
-4. Мэ = М/2;
+5. Мэ = М
138. Какие индикаторы используют в нитритометрии?
-1. крахмал;
+2. иодкрахмальная бумага;
-3. метиловый оранжевый;
-4. кристаллический фиолетовый;
-5. метиленовый синий.
139. Какие соединения можно определить нитритометрически?
-1. салициловая кислота;
-2. фенол;
-3. барбитал;
+4. новокаин;
-5. все перечисленные соединения.
140. Что является титрантом цериметрии?
-1. раствор CeCl4;
-2. Ce (порошок);
+3. раствор Ce(SO4)2;
-4. раствор Ce(OH)2;
-5. нет верного ответа.
141. В каких условиях проводят цериметрическое титрование?
+1. в присутствии H2SO4;
-2. в присутствии NaCl;
-3. в присутствии HNO3;
-4. в щелочной среде;
-5. в нейтральной среде.
142. Какой индикатор используют в иодатометрии?
-1. метиловый оранжевый;
-2. безындикаторное титрование;
+3. крахмал;
-4. кислотный хром темно-синий;
-5. нет верного ответа.
143. Что является титрантом в хлориодиметрии?
-1. раствор KCl и KI;
-2. раствор KCl и I2;
+3. раствор монохлорида йода (ICl);
-4. раствор KIO3 и KCl;
-5. нет верного ответа.
144. Как стандартизируют титрант в хлориодиметрии?
-1. перманганатометрически;
+2. иодометрически;
-3. нитритометрически;
-4. броматометрически;
-5. нет верного ответа.
145. В каком стехиометрическом соотношении реагируют катионы металлов с ЭДТА в водном растворе?
-1. 1:5;
-2. 1:3;
-3. 1:4;
+4. 1:1;
-5. 1:6.
146. Кривая комплексонометрического титрования ионов цинка, которое проводится при рН 10 в аммиачном буферном растворе, представляет собой зависимость:
-1. рZn от pH;
+2. pZn от величины Vтитранта;
-3. равновесной концентрации ионов цинка от величины степени оттитрованности;
-4. pZn от равновесной концентрации NH3;
-5. pH от величины степени оттитрованности.
147. Конечную точку титрования в комплексонометрии можно обнаружить:
-1. по появлению окраски при добавления избытка ЭДТА;
-2. по исчезновению окраски раствора при добавлении избытка ЭДТА;
+3. по изменению окраски металлохромных индикаторов;
-4. микрокристаллоскопическим способом;
-5. по изменению окраски крахмала;
148. В качестве титранта в комплексонометрическом титровании заместителя используют:
+1. ЭДТА;
-2. сульфат магния;
-3. сульфат цинка;
-4. комплексонат магния;
-5. хлорид бария.
149. В каких стехиометрических соотношениях взаимодействует Ca2+ и Mg2+ с ЭДТА? (
-1. 1 : 2;
+2. 1 : 1;
-3. 1 : 4;
-4. 1 : 3.
-5. нет правильного ответа.
150. Какие функционально-аналитические группировки присутствуют в молекуле ЭДТА?
-1. карбонильная группа и первичная аминогруппа;
+2. карбоксильная группа и третичная аминогруппа;
-3. гидроксигруппа и азогруппа;
-4. гидроксигруппа и четвертичный азот;
-5. нет правильного ответа.
151. Какие методы анализа относятся к осадительному титрованию?
-1. алкалиметрия;
-2. комплексонометрия;
+3. аргентометрия;
-4. цериметрия;
-5. фторидометрия.
152. Какое из перечисленных соединений можно использовать в качестве стандарта при установлении концентрации раствора серебра нитрата?
+1. NaCl;
-2. NaNO3;
-3. (NH4)SO4;
-4. AgNO3;
-5. все перечисленные вещества.
153. Какой индикатор используют в тиоцианатометрии?
-1. K2CrO4;
-2. дифенилкарбазон;
-3. флуоресцеин;
-4. эозин;
+5. железоаммонийные квасцы.
154. Какие методы анализа можно отнести к физическим методам?
-1. алкалиметрический метод анализа;
+2. прямой кондуктометрический метод анализа;
-3. цериметрический метод анализа;
-4. гравиметрический метод анализа;
-5. перманганатометрический метод анализа.
155. Электромагнитное излучение с длиной волны 250 нм относится к:
+1. УФ-излучению;
-2. видимому излучению;
-3. ИК-излучению;
-4. рентгеновскому излучению;
-5. микроволновому излучению.
156. Электромагнитное излучение с длиной волны 400-750 нм используется:
-1. в УФ-спектроскопии;
-2. в рентгеновской спектроскопии;
+3. в спектрофотометрии в видимой области;
-4. в ЯМР-спектроскопии;
-5. в микроволновой спектроскопии.
157. Величина какого параметра пряма пропорциональна концентрации вещества в растворе при постоянной длине волны света и постоянной толщине слоя раствора?
+1. оптическая плотность;
-2. пропускание раствора;
-3. интенсивность света, вышедшего из раствора;
-4. интенсивность света падающего на раствор;
-5. молярный коэффициент поглощения.