Обобщение и подведение итогов урока
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
УРОКА ПО БИОЛОГИИ
НА ТЕМУ:
«Ферменты»
АВТОР:
Шилкина И.В.,
преподаватель биологии и географии
2010 год
Урок № 8
Группа: специальность «Технология продукции общественного питания»
Тема урока: Ферменты
Цель урока: сформировать представления о ферментах, их строении, механизме действия, свойствах, применении в промышленности (и особенно – пищевой) и значении в пищеварении человека
Задачи урока:
образовательные: познакомить учащихся с современными представлениями о химической природе, основными принципами взаимодействия с субстратом и практическим использованием специфических каталитических белков – ферментов (энзимов)
воспитательные: воспитание бережного отношения к окружающей среде
развивающие: развитие профессионального интереса учащихся
Тип урока: изучения нового материала
Методы и методические приемы обучения: беседа, проблемное обучение, лекция, работа с таблицами и рисунками, лабораторная работа
Средства обучения (оборудование): Рисунки «Строение фермента», «Схема гипотезы «ключа и замка», «Схема гипотезы «руки и перчатки»; таблицы «Классификация ферментов»; «Использование ферментов в промышленности»; руководство и все необходимое для проведения лабораторной работы
План урока
- Оргмомент – 2 мин
- Контроль достижений обучающихся – 5 мин
- Актуализация приобретаемых знаний, целеполагание – 3 мин
- Изучение нового материала – 15 мин
- Закрепление изученного – 15 мин
- Обобщение и подведение итогов урока – 3 мин
- Домашнее задание – 2 мин
Ход урока
Оргмомент
Приветствие, проверка присутствующих. Настрой на рабочий лад
Контроль достижений обучающихся
Фронтальная беседа о строении, свойствах и функциях белков (особенное внимание – каталитической)
Актуализация приобретаемых знаний, целеполагание
Пероксид водорода без катализаторов разлагается медленно:
2Н2О2 2 Н2О + О2
В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет до 100 тыс. молекул Н2О2
Почему это происходит?
Учащиеся высказывают свои предположения
Давайте поработаем сегодня и попытаемся в конце урока найти ответ на этот вопрос
Изучение нового материала
§ Определение ферментов
Ферменты – это белки, обладающие каталитической активностью, т.е ускоряющие протекание реакций.
Впервые высокоочищенный кристаллический фермент был выделен в 1926 г. американским биохимиком Дж.Самнером. Этим ферментом была уреаза, которая катализирует расщепление мочевины. К настоящему времени известно более 2 тыс. ферментов, и их количество продолжает расти. Многие из них выделены из живых клеток и получены в чистом виде.
В клетке постоянно идут тысячи реакций. Если смешать в пробирке органические и неорганические вещества точно в тех же соотношениях, что и в живой клетке, но без ферментов, то почти никаких реакций с заметной скоростью идти не будет. Именно благодаря ферментам реализуется генетическая информация и осуществляется весь обмен веществ.
Для названия большинства ферментов характерен суффикс -аза, который чаще всего прибавляется к названию субстрата – вещества, с которым взаимодействует фермент.
§ Свойства ферментов:
- все ф. – глобулярные белки (полипептидные цепи свернуты в компактные глобулы).
- ф. увеличивают скорость реакции, но сами в ней не расходуются.
- присутствие ф. не влияет ни на природу, ни на свойства конечного продукта реакции.
- очень малое количество ф. вызывает превращение больших количеств субстрата.
- активность ф. меняется в зависимости от рН, температуры, давления и от концентрации как субстрата, так и самого фермента.
- катализируемая реакция обратима.
- ф. обладают специфичностью, т.е. один ф. катализирует обычно только одну реакцию.
§ Особенности строения
Несмотря на большое количество и разнообразие ферментов, все их по особенностям строения молекул можно разделить на две группы…

 Ферменты
Ферменты
Простые Сложные
Состоят только состоят из белковой части-
из белка апофермента и небелковой
части – кофактора
Учащиеся зарисовывают схему
В молекуле однокомпонентного белка выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков (от 3 до 12), располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента, который взаимодействует с молекулой субстрата с образованием фермент-субстратного комплекса.
Демонстрируется рисунок «Строение фермента»»
§ Механизм действия фермента
Гипотеза «ключа и замка».
Гипотеза «руки и перчатки»
§ Факторы, влияющие на работу ферментов
Вопрос: Какие факторы, действующие на скорость химических реакций, вы знаете из химии?
Перечисляются факторы:
1. рН
2. температура
3. ионный состав среды
4. концентрация субстрата и среды.
Именно эти факторы влияют и на действие ферментов
§ Классификация ферментов
Рассматривают, анализируют таблицу «Классификация ферментов», частично перерисовывают ее в тетрадь
§ Применение ферментов
Задание: Выбрать из таблицы сведения о ферментах, используемых в пищевой промышленности.
Выбирают необходимые сведения
Закрепление изученного
Проведение лабораторной работы «Расщепление пероксида водорода ферментом каталазой»
Обобщение и подведение итогов урока
Итак, давайте вспомним вопрос, который прозвучал в начале урока.
Почему вещество каталаза расщепляет пероксид водорода очень быстро?
Примерный ответ: Каталаза – фермент, т.е. вещество, ускоряющее скорость химической реакции в организме.
7. Домашнее задание:
1. Повторить записи в тетради
2. Подготовить сообщения о значении ферментов.
3. (опережающее) Подумать, каково значение ДНК для живых организмов
Строение фермента

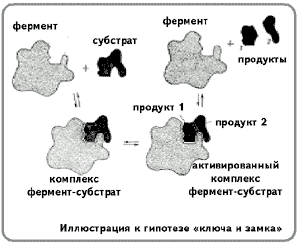

Иллюстрация к гипотезе «Руки и перчатки»
Классификация ферментов
| Группы ферментов | Катализируемая реакция | Примеры ферментов |
| 1. Оксидоредуктазы | Перенос атомов Н и О или электронов от одного вещества к другому | Дегидрогеназа, оксидаза. |
| 2. Трансферазы | Перенос определенной группы атомов от одного вещества к другому | Трансминаза, киназа |
| 3. Гидролазы | Реакции гидролиза, при которых из субстрата образуются два продукта | Липаза, амилаза, пептидаза |
| 4. Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов | Декарбоксилаза, фумараза, альдолаза |
| 5. Изомеразы | Внутримолекулярная перестройка | Изомераза, мутаза |
| 6. Лигазы | Соединение двух молекул в результате образования новых связей, сопряженных с распадом АТФ | Синтетаза |
Использование ферментов в промышленности
| Фермент | Отрасль промышленности | Использование |
| Амилазы (расщепляют крахмал) | Пивоваренная Текстильная Хлебопекарная | Осахаривание содержащегося в солоде крахмала. Удаление крахмала, наносимого на нити во время шлихтования. Крахмалглюкоза. Дрожжевые клетки, сбраживая глюкозу, образуют углекислый газ, пузырьки которого разрыхляют тесто и придают хлебу пористую структуру. |
| Протеазы Папаин Пепсин Трипсин Ренин Бактериальные протеазы | Пивоваренная Мясная Фармацевтическая Пищевая Фармацевтическая Пищевая Сыроделие Стирка белья Кожевенная Пищевая | Этапы процесса пивоварения, регулирующие количество пены. Мягчение мяса. Добавки к зубным пастам для удаления зубного налета. Производство «готовых» каш. Препараты, способствующие пищеварению. Производство продуктов для детского питания. Свертывание молока (получение сгустка казеина). Стиральные порошки с энзимными добавками. Отделение волоса – способ, при котором не повреждаются ни волос, ни шкура. Смягчение кожи после дубления. Получение белковых гидролизатов. |
| Глюкозооксидаза | Пищевая | Удаление глюкозы или кислорода. |
| Каталаза | Пищевая Резиновая | Удаление пероксида углерода. Получение кислорода, необходимого для превращения латекса в губчатую резину. |
| Целлюлазы Пектиназы | Пищеая | Осветление фруктовых соков. |
Лабораторная работа
Расщепление пероксида водорода ферментом каталазой
Цель работы: выяснить роль фермента каталазы листа элодеи в расщеплении пероксида водорода.
Оборудование:
- Микроскоп
- Элодея
- Предметные и покровные стекла
- Пероксид водорода
Ход работы:
- Прочитайте теоретический материал о ферменте каталаза
Каталаза (Н2О2:Н2О2— оксидоредуктаза)
фермент, катализирующий реакцию разложения перекиси водорода на воду и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2Н2О. Биологическая роль каталазы заключается в деградации перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.), и обеспечении эффективной защиты клеточных структур от разрушения под действием перекиси водорода. Каталаза широко распространена в тканях животных, в т.ч. человека, растений и в микроорганизмах (однако фермент полностью отсутствует у некоторых анаэробных микроорганизмов). В клетках К. локализуется в специальных органеллах — пероксисомах.
«Медицинская энциклопедия»