Кислотно-лужна система аналізу катіонів
Кислотно-лужна система аналізу катіонів базується на відношенні катіонів до хлоридної, сульфатної кислот, розчинів лугів та амоніаку.
За цією системою катіони поділяють на шість аналітичних груп.
Основними перевагами цієї системи аналізу катіонів над сульфідною є те, що реагенти являють собою порівняно малотоксичні сполуки, не застосовується токсичний гідроген сульфід, аналіз проводиться набагато швидше, ніж за сульфідним методом. Як недолік слід відмітити недостатню чіткість умов осадження та розділення гідроксидів катіонів четвертої та п’ятої аналітичних груп.
За кислотно-лужною системою аналізу катіонів до першої аналітичної групи відносять катіони Na+, K+, NH4+. Ця група катіонів групового реагенту не має. Їх хлориди, сульфати, гідроксиди розчинні у воді. У водному розчині ці катіони знаходяться у розчині.
До другої аналітичної групи відносять катіони Ag+, Hg22+, Pb2+. Груповим реагентом є розчин хлоридної кислоти с( 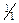 HCl)=2,0моль/дм3. Під дією групового реагенту катіони цієї групи випадають в осад у вигляді відповідних малорозчинних хлоридів.
HCl)=2,0моль/дм3. Під дією групового реагенту катіони цієї групи випадають в осад у вигляді відповідних малорозчинних хлоридів.
ДР(AgCl)=1,76·10–10; ДР(Hg2Cl2)=1,3·10–18; ДР(PbCl2)=1,6·10–5.
Найменшу розчинність має Hg2Cl2, а найбільшу – PbCl2. Вказані хлориди не тільки малорозчинні у воді, але також нерозчинні в кислотах. Досить непогана розчинність PbCl2, особливо у гарячих розчинах, може бути причиною того, що в гарячих розчинах йони Pb2+ можуть не повністю бути переведені в осад. Розчинність PbCl2 у гарячій воді використовують для відділення цих йонів від йонів Ag+,та Hg22+.
Другу аналітичну групу називають хлоридною.
До третьої аналітичної групи відносять катіони Ba2+, Sr2+, Ca2+ та Pb2+. Груповим реагентом на цю групу катіонів є розчин сульфатної кислоти с(  H2SO4)=2,0моль/дм3. Під дією групового реагенту катіони цієї аналітичної групи випадають в осад у вигляді відповідних сульфатів:
H2SO4)=2,0моль/дм3. Під дією групового реагенту катіони цієї аналітичної групи випадають в осад у вигляді відповідних сульфатів:
ДР(BaSO4)=1,1·10–10; ДР(SrSO4)=3,2·10–7; ДР(CaSO4)=2,5·10–5;
ДР(PbSO4)=1,6·10–8,
нерозчинних також і в кислотах.
Найбільш розчинним у воді є кальцій сульфат і за певних умов йони Ca2+ можуть не повністю видалятися з розчину під дією групового реагенту, що створює труднощі при проведенні аналізу.
Віднесення йона Pb2+ до третьої аналітичної групи катіонів цілком закономірно, оскільки PbSO4 набагато менш розчинний, ніж PbCl2, доцільніше було б віднести йон Pb2+ до третьої аналітичної групи, ніж до другої.
Третя аналітична група катіонів називається сульфатною.
Четверта аналітична група включає катіони Al3+, Cr3+, Zn2+, Sn2+, As3+, а також йони, до складу яких входять SnIV, AsV. До цієї групи включають також катіон п’ятої аналітичної групи Sb3+.
Груповим реагентом на катіони цієї групи є у надлишку розчин NaOH чи KOH з с( 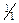 )=4,0 моль/дм3. Під дією групового реагенту утворюються гідроксиди вказаних хімічних елементів, які проявляють амфотерні властивості і тому розчиняються у надлишку лугу з утворенням гідроксокомплексів:
)=4,0 моль/дм3. Під дією групового реагенту утворюються гідроксиди вказаних хімічних елементів, які проявляють амфотерні властивості і тому розчиняються у надлишку лугу з утворенням гідроксокомплексів:
Al3+ +3OH– → Al(OH)3; Al(OH)3 + 3OH– → [Al(OH)6]3–;
Cr3+ +3OH– → Cr(OH)3; Cr(OH)3 + 3OH– → [Cr(OH)6]3–;
Zn2+ +2OH– → Zn(OH)2; Zn(OH)2 + 2OH– → [Zn(OH)4]2–;
Sn2+ +2OH– → Sn(OH)2; Sn(OH)2 + 2OH– → [Sn(OH)4]2–.
При нагріванні гідроксокомплекси втрачають воду і в розчині з’являються йони AlO2–, CrO2–, ZnO22–, SnO32–, AsO33–, (SbO33–).
Четверта аналітична група катіонів називається амфолітною.
До п’ятої аналітичної групи відносять катіони Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, а також SbV.
Груповим реагентом цієї групи катіонів є розчин амоніаку з масовою часткою у розчині NH3 25%.
При дії групового реагенту утворюються малорозчинні у воді відповідні гідроксиди, які не розчиняються у надлишку лугу і не утворюють комплексних амоніакатів:
ДР(Mg(OH)2)=7,1·10–12; ДР(Mn(OH)2)=1,9·10–13; ДР(Bi(OH)3)=4,3·10–31;
ДР(Fe(OH)2)=7,2·10–16; ДР(Fe(OH)3)=6,3·10–38; ДР(H3SbO3)≈4·10–42.
П’ята аналітична група називається гідроксидною.
Шосту аналітичну групу складають катіони Сu2+, Сo2+, Сd2+, Ni2+, Hg2+.
Груповим реагентом є водний розчин амоніаку з масовою часткою NH3 25%.
У надлишку розчину амоніаку утворюються комплексні катіони: [Cu(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+. Амоніакатні комплекси катіонів шостої аналітичної групи дуже добре розчинні у воді, деякі мають забарвлення:
[Cu(NH3)4]2+ – інтенсивно синє; [Co(NH3)6]2+ – жовте;
[Ni(NH3)6]2+, – блакитне. Комплекси [Cd(NH3)4]2+ та [Hg(NH3)4]2+ – безбарвні.
Шоста аналітична група катіонів називається амоніакатною.
Класифікація аніонів
Загальноприйнятої класифікації аніонів не існує. Найбільш вживаною є класифікація, згідно з якою всі аніони поділяють на три аналітичні групи по відношенню їх до катіонів Ba2+ та Ag+.
До першої аналітичної групи відносять аніони SO42–, SO32–, CO32–, PO43–, SiO32–, C2O42–, CrO42–, S2O32– та інші, які з катіоном Ba2+ утворюють малорозчинні солі:
ДР(BaSO4)=1,1·10–10; ДР(BaSO3)=8,0·10–7; ДР(BaCO3)= 4,0·10–10;
ДР(Ba3(PO4)2)=6,0·10–39; ДР(BaC2O4)=1,1·10–7; ДР(BaCrO4)= 1,2·10–10;
ДР(BaS2O3)= 6,4·10-5.
Груповим реагентом на дану групу аніонів є нейтральний або слабколужний розчин барій хлориду.
До другої аналітичної групи відносять аніони Cl−, Br−, I−, S2– та інші, які з катіоном Ag+ утворюють малорозчинні у воді та нерозчинні у нітратній кислоті осади:
ДР(AgCl)=1,78·10–10; ДР(AgBr)=5,3·10–13; ДР(AgI)= 8,3·10–17;
ДР(Ag2S)=6,3·10–50
Слід зазначити, що різні автори по-різному нумерують ці групи аніонів, надаючи їм свій порядковий номер.
У третю аналітичну групу включають аніони, які не утворюють малорозчинних сполук ні з катіоном Ba2+, ні з катіоном Ag+.
Сюди відносять аніони NO3−, NO2−, CH3COO− та інші.
Групового реагенту дана група аніонів не має.