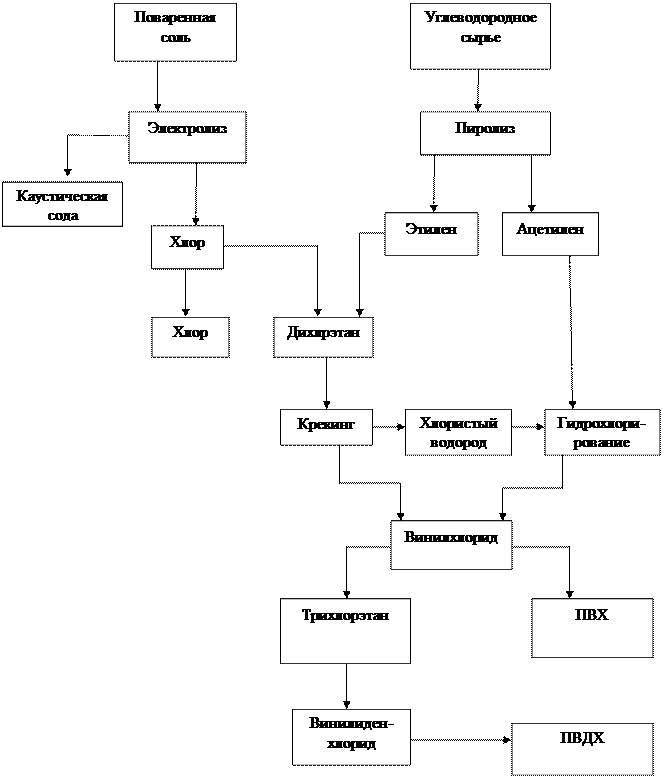
Производственная схема получения ПВХ и ПВДХ
Винилиден хлорид.
Винилиденхлорид-один из наиболее часто используемых мономеров при сополимеризации с другими различными мономерами, в частности с винилхлоридом. Последней сополимер эффективно используется для изготовления упаковочных пленок, в частности, пленок для дозревания сыров. Эти пленки способны пропускать углекислый газ, но не пропускают кислород, что позволяет получать сыр более хорошего качества.
Растущий в мире спрос на сополимер, а также жесткие требования к его качеству, приводят к возрастанию спроса на винилиденхлорид, не содержащий примесей.
Винилиден хлорид получают [1] элименированием хлороводорода из молекулы 1,1,2- трихлорэтана действием основания. Данный процесс идет в сторону образования винилиденхлорида, а не 1,2-дихлорэтилена, поскольку реакция идет по Е1сВ механизму, в котором лимитирующей стадией является отрыв протона от углерода, связанного с двумя хлорами. Этот протон является значительно более «кислым» из трех имеющихся. Это позволяет селективно получать винилиденхлорид из 1,1,2-трихлорэтана.
Другим способом получения [1] винилиденхлорида является термо-каталитическое дегидрохлорирование 1,1,2-трихлрэтана.
Трихлорэтан.
Очевидно, что так же огромное значение имеет получение 1,1,2-трихэлор этана. Известно большое число способов (см. [2]- [8])его промышленного получения, опишем наиболее эффективные из них, а так же используемые при переработке отходов [8].
Хлорирование 1,2-дихлорэтана. 1,2-дихлорэтан является довольно доступным сырьем, которое может быть легко получено прямым хлорированием этилена и очищено от таких примесей как различные три- и тетрахлорэтаны, ацетальдегид, бензол, хлорбензол и др. путем ректификации. Переход от 1,2-дихлорэтана к 1,1,2-трихлорэтану может быть осуществлен двумя различными способами- фотохимически и каталитически.
У каждого из этих методов есть свои преимущества и недостатки. Для фотохимического превращения основным преимуществом является то, что не требуется закупать дорогих и довольно вредных реактивов, таких как радикальные инициаторы (АИБН, перекись бензоила, хлорид ртути (II), и др.). Для каталитического превращения значительным преимуществом является простота устройства реактора, а так же легкость его обслуживания.
Сырец трихлорэтана (полученный в присутствии хлорида магния и хлорида ртути (II)) подвергают разгонке, в результате чего получают 59,52—65,3 % 1,1,2-трихлорэтана, 25,2—33,48 % дихлорэтана и 5,1—9,9 % полихлоридов.
Хлорирование винилхлорида. Другим удобным методом получения 1,1,2- трихлорэтана является хлорирование винилхлорида. Обычно его хлорирование ведут в присутствии катализатора FeCl3. Без катализатора реакция идет довольно медленно, поскольку у двойной связи имеется сильный электроноакцептор, сильно понижающий электронную плотность при двойной связи. Катализатор же, являясь кислотой льюиса средней силы, увеличивает электрофильность атакующего хлора, способствуя образованию гипотетической частицы «Сl+».
СН2=СНСl + Сl2 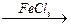 СН2Сl-CHCl2 + 210 кДж/моль
СН2Сl-CHCl2 + 210 кДж/моль
При этом способе выход 1,1,2-трихлорэтана не превышает 94 %, конверсия по винилхлориду 97,3 %, селективность по целевому компоненту 96 %.
Гидрохлорирование 1,2-дихлорэтилена. Ещё одним методом получения 1,1,2- трихлорэтана является хлорирование 1,2- дихлорэтилена. Это исходное соединение, конечно, является менее доступным, чем 1,2-дихлорэтан и винилхлорид, однако оно нередко получается как побочное соединение в различных процессах хлорирования углеводородов, и данная реакция позволяет использовать «отходы» производства как сырьё для получения ценных продуктов. Гидрохлорирование проводят в присутствии FeCl3 как катализатора и ведут при температуре 25-50°С.
Хлорирование кубовых остатков винилхлорида в среде кубовых остатков 1,2-дихлорэтана. Ещё одним процессом, позволяющим вернуть ценные реагенты в синтез и минимизировать выброс отходов в окружающую среду является хлорирование винилхлорида в среде 1,2-дихлорэтана. Кубовые остатки ректификации ВХ имеют следующий состава, мас. % :
- винилхлорид – 39,5;
- альфа-метилвинилхлорид – 4,0;
- этилхлорид – 3,5;
-1,2-дихлорэтан – 52,0.
Хлорирование ведут при температуре 45-80°С в присутствии перекисных соединений или FeCl3. Присутствие безводного хлорида железа (III) катализирует реакции присоединения по двойной связи, что не дает развиваться реакциям заместительного хлорирования, протекающим с выделением хлористого водорода, не желательным в данном процессе.