Обратимые и необратимые процессы
Определение эндо- и экзотермических реакций.
Тепловой эффект реакции записывается рядом с уравнением как изменение
энтальпии ΔH. Если ΔH < 0, то реакция идет с выделением теплоты и на-
зывается экзотермической. Если ΔH > 0, то реакция идет с поглощением
теплоты и называется эндотермической.
Процессы, протекающие с выделением тепла, называются экзотермическими.
Процессы, протекающие с поглощением тепла, называются эндотермическими.
Сленствия закона Гесса.
Закон Гесса — основной закон термохимии.
Закон Гесса формулируется следующим образом: тепловой эффект
химической реакции не зависит от пути ее протекания, а зависит
лишь от природы и физического состояния (энтальпии) исходных
веществ и продуктов реакции.
В основе большинства термохимических расчетов лежат два следствия из за-
конов Гесса:
Следствие 1. Тепловой эффект реакции равен разности сумм теп-
лот образования продуктов реакции и теплот образования исход-
ных веществ с учетом их стехиометрических коэффициентов.
Так, для уравнения реакции aA + bB = cC + dD тепловой эффект ΔH равен:
ΔH = (cΔHC + dΔHD) − (aΔHA + bΔHB).
Следствие 2. Если известны тепловые эффекты ряда реакций, то
можно определить тепловой эффект другой реакции, в которую
входят вещества и соединения, входящие в уравнения, для которых
тепловой эффект известен. При этом с термохимическими уравне-
ниями можно производить самые различные арифметические дей-
ствия (сложение, вычитание, умножение, деление) как с алгебраи-
ческими уравнениями.
Условие равновесного состояния термодин. системы.
Равновесный — это такой процесс, при котором система непрерывно проходит
последовательный ряд равновесных состояний.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды.
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
1. равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы — локальное равновесие,
2. неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе — частичное равновесие,
3. имеют место как локальное, так и частичное равновесие.
В неравновесных системах происходят изменения потоков материи или энергии, или, например, фаз.
Устойчивость термодинамического равновесия
Состояние термодинамического равновесия называется устойчивым, если в этом состоянии не происходит изменения макроскопических параметров системы.
Критерии термодинамической устойчивости различных систем:
· Изолированая (абсолютно не взаимодействующая с окружающей средой) система — максимум энтропии.
· Замкнутая (обменивается с термостатом только теплом) система — минимум свободной энергии.
· Система с фиксированными температурой и давлением — минимум потенциала Гиббс.
· Система с фиксированными энтропией и объёмом — минимум внутренней энергии.
· Система с фиксированными энтропией и давлением — минимум энтальпии.
Само- и несамопроизвольные процессы.
Самопроизвольные процессы – это такие процессы, протекающие без затраты энергии из вне (за счет своих внутренних ресурсов).
Несамопроизвольные процессы - это процессы обратные самопроизвольным, требующие затраты энергии.
Обратимые и необратимые процессы.
Обратимый процесс — это равновесный процесс, который можно провести
в прямом и обратном направлении так, что во внешней среде не останется ни-
каких изменений в форме работы или тепла.
Особенностью обратимых реакций является то, что они идут не до конца.
3H2+N2↔2NH3
Необратимый процесс — это процесс, проведение которого связано с передачей системой окружающей среде (или, наоборот, от среды к системе) энергии в форме теплоты, работы и т. д.
Если при химических взаимодействиях, хотя бы одно из веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.
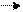 KCLO3 KCL+ 3/2O2
KCLO3 KCL+ 3/2O2