Тема: Основи титриметричного (об’ємного) аналізу
Актуальність теми: Титриметричний аналіз ґрунтується на точному вимірюванні об’єму розчину хімічного реагента з відомою концентрацією, витраченого на взаємодію з певним об’ємом досліджуваного розчину.
Метод титриметричного аналізу застосовуються в медико-біологічних і санітарно-гігієнічних дослідженнях біологічних рідин, питної і стічної води, харчових продуктів, ліків і інших.
В об’ємному аналізі процес повільного приливання розчину реагента з відомою концентрацією до розчину визначуваної речовини до моменту еквівалентності називається титруванням, а метод – титриметричним.
Основою розрахунків в об’ємному аналізі є закон еквівалентів: речовини вступають в хімічні реакції і утворюються в результаті реакцій в кількостях, пропорційних їхнім еквівалентам.
Навчальні цілі:
Знати: Основні вимоги до хімічних реакцій, які використовуються в об’ємному аналізі.
Вміти: Виконувати розрахунки по приготуванню робочих і стандартних розчинів, готувати їх і проводити визначення за їх участю в об’ємному аналізі.
Самостійна позааудиторна робота студентів
- Суть (принцип) об’ємного аналізу.
- Які типи реакцій використовують в об’ємному аналізі:
а). залежно від типу хімічних реакцій;
б). за способом проведення аналізу.
4. Основні вимоги до хімічних реакцій, які використовуються в об’ємному аналізі.
5. Дати визначення поняттю «робочий розчин» (титр ант, титрований розчин).
6. Способи вираження концентрації «робочих» розчинів (молярна концентрація еквіваленту, титр).
7. Дати визначення поняттю «стандартний розчин». Вимоги до речовин з яких готують «стандартні» розчини.
8. Що таке точка еквівалентності?
9. Закон еквівалентів і його застосування в об’ємному аналізі.
10. Індикатори. Їх роль в об’ємному аналізі.
11. В 300 мл розчину соди міститься 3 г Na2CO3. Розрахуйте молярну концентрацію еквіваленту соди в розчині і
титр, одержаного розчину.
(Відповідь: 0,188 моль-екв/л; 0,01г/мл).
Контрольні питання
- Принцип методу нейтралізації, на чому він ґрунтується?
- Робочі і стандартні розчини методу нейтралізації.
- Криві титрування. Точка нейтралізації.
- Індикатори методу нейтралізації.
- Визначення моменту еквівалентності при кислотно-основному титруванні.
- Прикладне значення методу нейтралізації в медицині.
- Визначення кислотності шлункового соку.
Самостійна робота на занятті
Виконати лабораторні роботи:
1. Визначення молярної концентрації еквіваленту соляної кислоти за стандартним розчином бури.
2. Визначення концентрації лугу за титрованим розчином соляної кислоти.
Методика виконання лабораторної роботи
Робота1 Визначення молярної концентрації еквіваленту соляної кислоти за стандартном розчином бури.
В колбочку для титрування відміряють піпеткою точно 5 мл стандартного розчину тетраборату натрію, додають 2 краплі індикатора метил-оранжу, від чого розчин стає жовтого кольору. В бюретку наливають досліджуваного розчину соляної кислоти (невідомої концентрації) і титрують нею розчин в колбочці до моменту зміни забарвлення у блідо-рожеве. Титрування повторюють ще 2 рази. Дані записують у таблицю:
| № проби | Vбури, мл | Сбури | VHCl | Розраховано | |
| С(HCl) | T(HCl) | ||||
| 0,05 | |||||
| 0,05 | |||||
| 0,05 | |||||
| Середнє | 0,05 |
За середнім значенням V(HCl) витраченого на титрування розраховують молярну концентрацію еквіваленту соляної кислоти в розчині та титр розчину.
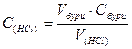
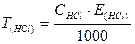
Робота 2. Визначення концентрації лугу за титрованим розчином соляної кислоти.
В колбочку для титрування відміряють 5 мл досліджуваного розчину лугу (невідомої концентрації), додають 2 краплі індикатора метил-червоного і титрують із бюретки тією ж соляною кислотою, що в роботі №1 до моменту переходу забарвлення від жовтого до блідо-рожевого. Титрування повторюють ще 2 рази. Результати записують у таблицю:
| № проби | V(NaOH), мл | С(HCl) | V(HCl), мл | Розраховано | |
| С(NaOH) | T(NaOH) | ||||
| Середнє |
За середнім значенням V(HCl) витраченого на титрування та С(HCl), визначеної в роботі №1, розраховують молярну концентрацію еквіваленту лугу в розчині та титр досліджуваного розчину:


За одержаними даними аналізу зробити відповідні висновки.
Література
- Клименко А.О., Мельник М.В., Павлюк В.М., Нечитайло Л.Я., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія, Вінниця, «Нова книга», 2006.
- Павлюк В.М. Методичні вказівки з хімії «Основи титриметричних (об’ємних) методів аналізу». Івано-Франківськ, 1999.
Підготував: доцент кафедри Павлюк В.М.
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 28.08.20012р.
Зав. кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
Заняття 7
Тема: Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
Актуальність теми:Біохімічні процеси в організмі людини проходять у водних розчинах. При цьому водне середовище може бути нейтральним, кислим чи основним. Організм успішно справляється з кислотно-основною рівновагою і рН біологічних рідин залишається сталим, що забезпечує його нормальний життєвий рівень. Знання рН біологічних рідин дозволяє виявити патологічні зміни в організмі, попереджувати хвороби.
Навчальні цілі:
Знати: Значення рН шлункового соку, слини і інших біологічних рідин, від чого залежить значення рН різних розчинів.
Вміти: Визначати рН розчинів за допомогою індикаторів. Розраховувати теоретичне значення рН різних розчинів.
Самостійна позааудиторна робота студентів.
1. Сильні і слабкі електроліти. Ступінь і константа дисоціації.
2. Закон розведення Оствальда.
3. Протолітична теорія кислот і основ
4. Електролітична дисоціація води. Іонний добуток води.
5. Водневий показник розчинів (рН).
6. рН біологічних рідин (крові, жовчі, сечі, слюни),їхзначення в здоровому організмі.
7. Кислотно-основні індикатори. Універсальний індикатор.
8. Межі рН для питної води, їх визначення.
9. Роль концентрації водневих іонів в біологічних процесах.
Контрольні питання.
1.Як визначити ступінь дисоціації?
2.Що таке константа дисоціації? Напишіть її вираз для карбонатної кислоти.
3.Закон розведення Оствальда.
4.Напишіть рівняння і константу дисоціації води.
5.Що таке йонний добуток води?
6.Що таке водневий показник розчину?
7.Які значення рН в кислих, лужних і нейтральних розчинах?
8.Що таке активність розчину?
9.Як визначити йонну силу розчину?
10.Який зв’язок між активністю і йонною силою розчину?
11.Дайте визначення кислот і основ з точки зору протонної теорії.
12.Напишіть рівняння гідролізу соди.
13.Концентрація водневих йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище.
14.Концентрація гідроксильних йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище.
15.Обчисліть рН розчину оцтової кислоти, хлоридної кислоти та гідроксиду амонію з молярною концентрацією еквівалентів 0,01 моль/л.
Самостійна робота на занятті.
Виконати лабораторні роботи:
1. Визначити рН різних розчинів за допомогою індикаторів.
2. Обчислення рН розчинів різних електролітів.
Методика виконання роботи
Робота 1. Приблизне визначення рН розчинів за допомогою індикаторів.
В три пробірки окремо налити по 1 мл води, розчинів кислоти і лугу. Дані розчини окремо випробувати універсальним індикатором, фенолфталеїном і метилоранжем, приливаючи в кожну пробірку по 2-3 краплі індикатора. Спостереження внести в таблицю, вказуючи зміну забарвлення індикатора.
| електроліти | індикатори | |
| універсальний | фенолфталеїн | метилоранж |
Робота 2. Визначення рН розчинів і білогічних рідин за допомогою універсального індикатора.
В окремі пробірки внести по 1 мл даних розчинів кислот, основ, сироватки крові, шлункового соку і визначити універсальним індикатором величинурН.
Одержані дані внести в таблицю:
| Біологічні рідини і розчини електролітів | рН | середовище |
| кисле | лужне | нейтральне |
Робота 3. Обчислення рН розчинів різних електролітів.
В чотири пробірки налити по 4,5 мл води і в кожну із них прилити по 0,5 мл 0,1н розчинів соляної, оцтової кислот, гідроксидів натрію і амонію. За допомогою універсального індикатора визначити рН кожного розчину. Теоретично обчислити концентрацію водневих іонів даних розчинів і їх значення звірити з практично визначеними. Дані оформити у вигляді таблиці:
| Електроліти | Сн | рН | |
| теоретичне | експериментальне | ||
| НСІ | |||
| СН3СООН | |||
| NaOH | |||
| NH4OH |
Записати висновки по кожній роботі.
Література
- Клименко А.О., Мельник М.В., Павлюк В.М., Нечитайло Л.Я., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія, Вінниця, «Нова книга», 2006.
Підготувала: асистент кафедри Нечитайло Л.Я.
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 28.08.20012р.
Зав. кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
Заняття 8