Виявлення ферментів у біологічних об’єктах. Вивчення впливу
Температури та рН середовища на активність ферментів.
Завдання 1. Виявити у слині фермент α-амілазу, який гідролізує крохмаль до дисахариду мальтози та декстринів.
α-Амілаза слини (α-1,4-глюкан-4-глюканогідролаза; КФ 3.2.1.1), яка має відносну групову специфічність, розщеплює α-1,4-глікозидні зв’язки у полісахаридах і не діє на дисахариди.
Принцип. Про активність ферменту судять за його дією на субстрат: зникненням субстрату або появою продуктів його розщеплення. Розщеплення крохмалю виявляють за негативною реакцією з реактивом Люголя.
Хід роботи. У пробірку вносять 0,5–1 мл слини, додають 3–5 мл 1% розчину крохмалю, перемішують і ставлять у термостат при 37 °С на 15–20 хв. Після цього у пробірку вносять 3-4 краплі реактиву Люголя (розчин J2 в КJ).
Завдання 2. Перевірити термолабільність амілази.
Принцип:той же.
Хід роботи. У пробірку вносять 0,5–1 мл слини, додають 1 мл дистильованої води, кип’ятять у полум’ї горілки й охолоджують; потім доливають 3–5 мл 1% розчину крохмалю, перемішують і ставлять у термостат при 37 °С на 15–20 хв. Після цього вносять у пробірку 3–4 краплі реактиву Люголя.
Завдання 3. Перевірити вплив рН середовища на активність амілази.
Принцип:той же.
Хід роботи. У дві пробірки вносять по 0,5–1 мл слини; в першу додають 1 мл 0,4% розчину NaOH, у другу – 1 мл 0,4% НС1; у дві пробірки додають по 3–5 мл 1% розчину крохмалю і ставлять у термостат при 37 °С на 15–20 хв. Враховуючи, що NaOH реагує з J2 (NaOH+J2 ® NaJ+Н2О), перед додаванням реактиву Люголя у пробірку з NaOH вносять 1 мл 0,4% HCI для нейтралізації лугу.
Оформлення роботи:заповнити таблицю.
| № пробірки | Фермент | Субстрат | Умови досліду | Результати реакції | Висновки |
Практичне значення.Вивчення загальних властивостей необхідно для підбирання оптимальних умов дії ферментів при визначенні їх активності в наукових та клінічних дослідженнях. Невірно підібрані стандартні умови призводять до помилок при діагностуванні захворювань та контролі за якістю ферментативних лікарських засобів.
ЛІТЕРАТУРА
1. Губський Ю.І. Біологічна хімія / Ю.І. Губський. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 86–89, 106.
2. Губський Ю.І. Біологічна хімія: підручник / Ю.І. Губський. – Київ-Вінниця: Нова книга, 2007. – С. 115–128, 137–138.
3. Гонський Я.І. Біохімія людини: підручник / Я.І. Гонський, Т.П. Максимчук, М.І. Калинський. – Тернопіль: Укрмедкнига, 2002. – С. 66–78.
4. Біологічна хімія / Л.М. Вороніна та ін. – Харків: Основа, 2000. – С. 109–117.
5. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 114-129, 139-143.
6. Биохимия: учебник / под ред. Е.С. Северина. – М.: ГЭОТАР-МЕД, 2003. – С. 75–83.
7. Николаев А.Я. Биологическая химия / А.Я. Николаев. – М.: ООО Медицинское информационное агентство, 1998. – С. 53–73.
8. Бышевский А.Ш., Терсенов О.А. Биохимия для врача / А.Ш. Бышевский, О.А. Терсенов. – Екатеринбург: Уральский рабочий, 1994. – С. 34–36.
9. Практикум з біологічної хімії / Д.П. Бойків, О.Л. Іванків, Л.І. Кобилянська та ін.; за ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 51–59.
10. Лабораторні та семінарські заняття з біологічної хімії: навч. посібник для студентів вищих навч. закл. / Л.М. Вороніна, В.Ф. Десенко, А.Л. Загайко та ін. – Харків: Вид-во НФаУ; Оригінал, 2004. – С. 82–84.
ЗМІСТКОВИЙ МОДУЛЬ 6
ЗАНЯТТЯ 3 (2години)
Тема: Механізм дії ферментів і кінетика ферментативних реакцій. Визначення активності ферментів.
Актуальність.У сучасній біохімії широко застосовують методи визначення активності ферментів у біологічних рідинах та тканинах. Це дозволяє встановити патогенез багатьох захворювань і запропонувати методи їх лікування з використанням сучасних лікарських засобів.
Мета. Вміти аналізувати механізми дії ферментів та кінетику ферментативних реакцій. Ознайомитися з методами якісного та кількісного визначення активності ферментів у біологічних об’єктах, що дозволяють вивчити властивості ферментів і особливості їхньої дії та регуляції, а також складають основу діагнозу та прогнозу багатьох захворювань. Визначити специфічність дії ферментів α-амілази слини та сахарази дріжджів.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
ПІД ЧАС ПІДГОТОВКИ ДО ЗАНЯТТЯ
ТЕОРЕТИЧНІ ПИТАННЯ
1. Сучасні положення про механізм дії ферментів: поняття про енергію активації реакції; утворення фермент-субстратного комплексу і механізми отримання продуктів ферментативної реакції (ковалентний та кислотно-лужний каталіз). Значення робіт Е. Фішера і Д. Кошленда.
2. Кінетика ферментативних реакцій: вплив концентрації субстрату і ферменту на швидкість ферментативної реакції (графічні залежності). Рівняння Міхаеліса-Ментен. Константа Міхаеліса, її визначення і значення.
3. Активність ферментів. Одиниці виміру активності та кількості ферментів: міжнародні одиниці, катал, питома активність.
4. Фактори, що впливають на активність ферментів: концентрація субстрату, ферменту та продуктів реакції, температура, рН середовища.
5. Методи виділення ферментів із біооб'єктів, їх фракціонування (ультрацентрифугування, гель- та іонообмінна хроматографія, афінна хроматографія, електрофорез) і аналіз активності ферментів.
6. Методи визначення активності ферментів: за кількістю продукту, який утворюється під дією ферменту за одиницю часу; за кількістю витраченого субстрату за одиницю часу. Спектрофотометричні методи визначення активності ферментів та візуалізація результатів ферментативної реакції.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Константа Міхаеліса для ферменту визначає:
А. Ступінь спорідненості ферменту до продукту реакції.
В. Ступінь спорідненості ферменту до субстрату.
С. Ступінь спорідненості ферменту до інгібітору.
D. Середню швидкість ферментативної реакції.
Е. Максимальну швидкість ферментативної реакції.
2. Продовжіть фразу "Незначна зміна рН середовища впливає на молекулу ферменту, змінюючи…"
А. Структурний рівень організації молекули ферменту.
В. Ступінь поляризації амінокислотних радикалів в активному центрі.
С. Товщину гідратної оболонки ферменту.
D. Оптичні властивості ферменту.
Е. Біологічну функцію ферменту.
3. Назвіть показник, який використовують при визначенні питомої активності ферменту, коли відома його загальна активність.
А. Концентрація даного ферменту в досліджуваній пробі.
В. Концентрація білка в досліджуваній пробі.
С. Концентрація субстрату в досліджуваній пробі
D. Константа Міхаеліса для даного ферменту.
Е. Максимальна швидкість досліджуваної ферментативної реакції.
4. Укажіть прізвище вченого, який запропонував гіпотезу "індукованої відповідності".
| А. Г. Кребс. | В. Д. Кошленд. | С. М. Ментен. | D. Ф. Крик. | Е. К. Функ. |
5. Виберіть фактор, який не впливає на значення константи дисоціації фермент-субстратного комплексу.
А. Концентрація субстрату.
В. Хімічна природа ферменту.
С. Концентрація ферменту.
D. Концентрація фермент-субстратного комплексу.
Е. Ступінь спорідненості ферменту до субстрату.
6. Що відбувається у ході ферментативного каталізу при утворенні фермент-субстратного комплексу?
А. Змінюється конформація субстрату.
В. Змінюється конформація ферменту.
С. Встановлюється індукована комплементарна відповідність між ферментом і субстратом.
D. Зближуються функціональні групи, що беруть участь у каталізі.
7. Яка з перелічених властивостей ферментів лежить в основі їх якісного та кількісного визначення у біологічних об’єктах?
А. Здатність проявляти максимальну активність при визначеному рівні рН середовища.
В. Залежність від присутності у середовищі різноманітних активаторів та інгібіторів.
С. Специфічність.
D. Термолабільність.
Е. Гальмування реакції її продуктами.
8. У пробірку з невідомим субстратом додали екстракт із дріжджів. Після 15 хв інкубації суміш у пробірці дала позитивну реакцію Фелінга. Який субстрат був у пробірці?
| А. Крохмаль. | В. Сахароза. | С. Лактоза. | D. Глікоген. | Е. Целюлоза. |
9. Що лежить в основі механізму дії ферментів?
А. Зближення груп, які входять до активного центру ферменту.
В. Утворення фермент-субстратного комплексу.
С. Зміна електричного заряду ферменту.
D. Зміна просторової конфігурації.
Е. Гідроліз ферменту.
10. Укажіть метод досліджень, який використовують для виділення ферментативних систем окремих субклітинних фракцій із гомогенату тканини
| А. Діаліз. | D. Диференційне центрифугування. |
| В. Ізоелектричне фокусування. | Е. Рентґеноструктурний аналіз. |
| С. Якісний аналіз. |
11. Назвіть одиницю активності ферменту, яка визначається кількістю ферменту, що перетворює 1 моль субстрату за 1 с за оптимальних умов.
| А. Катал. | D. Число оборотів. |
| В. Стандартна міжнародна одиниця. | Е. Молярна активність. |
| С. Умовна одиниця. |
ПРАКТИЧНА РОБОТА
Визначення специфічності дії ферментів α-амілази слини
(α-1,4-глюкан-4-глюканогідролази; КФ 3.2.1.1) та сахарази дріжджів (β-D-фруктофуранозидфруктогідролази; КФ 3.1.1.26)
Завдання 1. Приготувати екстракт із дріжджів, який містить фермент сахаразу.
Хід роботи. Розтерти у ступці шматочок дріжджів із 10–15 мл дистильованої води та профільтрувати.
Завдання 2. Перевірити дію амілази на крохмаль і сахарозу.
Принцип. Про активність ферменту судять за його дією на субстрат: за зникненням субстрату або появою продуктів його розщеплення. Розщеплення крохмалю виявляють за негативною реакцією з реактивом Люголя. Розщеплення сахарози виявляють за позитивною реакцією з реактивом Фелінга, яку дають продукти гідролізу сахарози (глюкоза і фруктоза), але не дає сахароза.
Хід роботи. У дві пробірки вносять по 0,5–1 мл слини: у першу додають 3–5 мл 1% розчину крохмалю, у другу – 3–5 мл 1% розчину сахарози, добре перемішують і ставлять у термостат при 37°С на 15–20 хв. Після цього у першу пробірку додають 3–4 краплі реактиву Люголя і переконуються в гідролізі крохмалю; зі вмістом другої пробірки проводять реакцію Фелінга і переконуються у відсутності гідролізу сахарози.
Техніка реакції Фелінга: до1–2 мл досліджуваного розчину додають однаковий об’єм реактиву Фелінга (CuSО4 + NaOH) та кип’ятять у полум’ї горілки. За наявності у розчині моносахаридів випадає осад червоного кольору (Сu2О), який утворюється в результаті відновлення міді завдяки окисленню карбонільних груп моносахаридів.
Завдання 3. Перевірити дію сахарази на крохмаль і cахарозу.
Принцип:той же.
Хід роботи. У дві пробірки вносять по 0,5–1 мл екстракту дріжджів; у першу додають 3–5 мл 1% розчину крохмалю, у другу – 3–5 мл 1% розчину сахарози, добре перемішують і ставлять у термостат при температурі 37 °С на 15–20 хв. Після цього у першу пробірку додають 3–4 краплі реактиву Люголя і переконуються у відсутності гідролізу крохмалю; зі вмістом другої пробірки проводять реакцію Фелінга і переконуються у наявності гідролізу сахарози.
Оформлення роботи:заповнити таблицю.
| № пробірки | Фермент | Субстрат | Умови досліду | Результати реакції | Висновки |
Практичне значення. Ферменти, що мають абсолютну субстратну специфічність, використовуються у клініці як аналітичні реагенти для визначення речовин, що є їх субстратами. Наприклад, уреазу застосовують для визначення сечовини в біологічному матеріалі та лікарських препаратах; глюкозооксидазу – для визначення кількості глюкози в крові та сечі. Ферменти з абсолютною та відносною груповою субстратною специфічністю мають меншу вибірковість дії на субстрати і, як правило, беруть участь у гідролізі поживних речовин або перетворенні чужорідних сполук. Наприклад, α-амілаза і сахараза проявляють специфічність не до структури субстрату в цілому, а до типу глікозидних зв’язків, що мають місце у відповідних вуглеводах.
ЛІТЕРАТУРА
1. Губський Ю.І. Біологічна хімія / Ю.І. Губський. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 87, 98–108.
2. Губський Ю.І. Біологічна хімія: підручник / Ю.І. Губський. – Київ-Вінниця: Нова книга, 2007. – С. 129–137.
3. Гонський Я.І. Біохімія людини: підручник / Я.І. Гонський, Т.П. Максимчук, М.І. Калинський. – Тернопіль: Укрмедкнига, 2002. – С. 78–86, 100.
4. Біологічна хімія / Л.М. Вороніна та ін. – Харків: Основа, 2000. – С. 122–137.
5. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 129–145, 157–159.
6. Биохимия: учебник / под ред. Е.С. Северина. – М.: ГЭОТАР-МЕД, 2003. – С. 92–102.
7. Николаев А.Я. Биологическая химия / А.Я. Николаев. – М.: ООО Медицинское информационное агентство, 1998. – С. 73–77, 81–84.
8. Бышевский А.Ш. Биохимия для врача / А.Ш. Бышевский, О.А. Терсенов. – Екатеринбург: Уральский рабочий, 1994. – С. 36–43.
9. Практикум з біологічної хімії / Д.П. Бойків, О.Л. Іванків, Л.І. Кобилянська та ін.; за ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 51–66.
10. Лабораторні та семінарські заняття з біологічної хімії: навч. посібник для студентів вищих навч. закл. / Л.М. Вороніна, В.Ф. Десенко, А.Л. Загайко та ін. – Харків: Вид-во НФаУ; Оригінал, 2004. – С. 84–88.
ЗМІСТКОВИЙ МОДУЛЬ 6
ЗАНЯТТЯ 4 (2години)
Тема: Регуляція ферментативних процесів. Інгібітори та активатори ферментів. Медична ензимологія. Кількісне визначення активності α-амілази та лактатдегідрогенази у сироватці крові.
Актуальність. Досягнення ензимології (науки про ферменти) широко впроваджуються в медицину. Розвиток медичної ензимології відбувається у трьох головних напрямках (ензимопатологія, ензимодіагностика та ензимотерапія), що дозволяє вирішувати проблеми патогенезу ензимопатій, застосовувати ферментні тести для діагностики органічних і функціональних розладів органів та тканин, а також використовувати ферменти і модулятори їхньої дії як лікарські засоби. Так, підвищення активності лужної фосфатази у сироватці крові спостерігається при рахиті, пухлинах кісткової тканини, гіперпаратиреозі, механічній жовтяниці, вірусному гепатиті, а зниження – при гіпотиреозі, гіповітамінозі С та ін. Активність лактатдегідрогенази збільшується у хворих із пошкодженням міокарда, скелетних м’язів, нирок, а також при анеміях, пухлинах, гострому гепатиті. Ферменти – пепсин, трипсин, гіалуронідаза та інші – використовуються як лікувальні препарати, а також у клініко-біохімічних лабораторіях як аналітичні реактиви (глюкозооксидаза, уреаза та ін.).
Мета. Вивчити та вміти аналізувати механізми регуляції ферментативних процесів як основи обміну речовин в організмі в нормі та при патологіях; зміни перебігу ферментативних процесів та накопичення проміжних продуктів метаболізму при вроджених (спадкових) та набутих вадах метаболізму – ензимопатіях; зміни активності індикаторних ферментів плазми крові при патологіях певних органів та тканин; застосування ферментів та їх модуляторів як фармакологічних препаратів при певних патологічних станах. Ознайомитися з методами кількісного визначення активностей α-амілази і лактатдегідрогенази у сироватці крові та їх клініко-діагностичним значенням.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
ПІД ЧАС ПІДГОТОВКИ ДО ЗАНЯТТЯ
ТЕОРЕТИЧНІ ПИТАННЯ
1. Регуляція ферментативних процесів, її шляхи та механізми: алостеричні взаємодії у ферментах, ковалентна модифікація ферментів, дія регуляторних білків-ефекторів (кальмодуліну, протеїназ, протеїназних інгібіторів). Циклічні нуклеотиди як регулятори ферментативних реакцій та біологічних функцій клітини.
2. Інгібітори та активатори ферментів. Типи інгібування ферментів: оборотне (конкурентне, неконкурентне, безконкурентне) і необоротне. Приклади.
3. Основні аспекти сучасної ензимодіагностики. Індикаторні, секреторні та екскреторні ферменти. Ізоферменти в ензимодіагностиці, тканинна специфічність розподілу ізоферментів. Зміни активності ферментів плазми та сироватки крові як діагностичні показники розвитку патологічних процесів в органах і тканинах.
4. Порушення перебігу ферментативних процесів: природжені (спадкові) та набуті ензимопатії, природжені вади метаболізму, їх клініко-лабораторна діагностика.
5. Ензимотерапія – використання ферментів як лікарських засобів. Фармакологічне застосування ферментів шлунково-кишкового тракту, згортальної та фібринолітичної систем крові, калікреїн-кінінової та ренін-ангіотензинової систем. Інгібітори ферментів як лікарські засоби.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Назвіть активатор амілази слини.
| А. Хлорід натрію. | С. Сульфат міді. | Е. Глюконат кальцію. |
| В. Сульфат амонію. | D. Хлорид магнію. |
2. Укажіть тип інгібування, при якому інгібітором ферменту є продукт реакції.
| А. Конкурентне. | С. Безконкурентне. | Е. Ретроінгібування. |
| В. Неконкурентне. | D. Стереохімічне. |
3. Позначте фермент, активність якого слід визначати в сечі пацієнта при гострому панкреатиті.
| А. Амілаза. | D. Лейцинамінопептидаза. |
| В. Протеїнкіназа. | Е. Лужна фосфатаза. |
| С. Холінестераза. |
4. Укажіть патологію, при якій значення активності амілази крові зростає в 10 і більше разів.
| А. Вірусний гепатит. | D. Інфаркт міокарда. |
| В. Гострий панкреатит. | Е. Цукровий діабет. |
| С. Хронічний холецистит. |
5. Назвіть фермент, активність якого визначають у плазмі крові пацієнтів із патологією кісткової тканини.
| А. Пепсин. | С. Амілаза. | Е. Лужна фосфатаза. |
| В. Трипсин. | D. Кисла фосфатаза. |
6. Для оцінки ступеню поразки паренхіми печінки у пацієнтів визначають:
А. Концентрацію ізоформ ЛДГ1 і ЛДГ2 плазми крові.
В. Концентрацію ізоформ ЛДГ4 і ЛДГ5 плазми крові.
С. Активність амілази сечі.
D. Активність кислої фосфатази.
Е. Концентрацію ізоформи ЛДГ3 плазми крові.
7. Укажіть ізоформи ЛДГ, концентрація яких збільшується у плазмі крові пацієнтів з інфарктом міокарда.
| А. ЛДГ1 і ЛДГ2. | С. Тільки ЛДГ3. | Е. Тільки ЛДГ5. |
| В. ЛДГ3 і ЛДГ4. | D. ЛДГ4 і ЛДГ5. |
8. Назвіть фермент плазми крові, який використовують у терапевтичній практиці для зниження кров’яного тиску.
| А. Ізоформа ЛДГ1. | С. Хімотрипсин. | Е. Калікреїн. |
| В. Трипсин. | D. Холінестераза. |
9. Який механізм інгібування синтезу фолієвої кислоти сульфаніламідними препаратами?
| А. Конкурентний. | D. Неконкурентний. |
| В. Необоротний. | Е. Зв’язування з алостеричними центрами ферментів. |
| С. Денатурація ферменту. |
ПРАКТИЧНА РОБОТА
Кількісне визначення активності α-амілази у сироватці крові
за методом Каравея
Завдання. Визначити активність α-амілази у сироватці крові за методом Каравея.
Принцип методу. α-Амілаза (α-1,4-глюкан-4-глюканогідролаза; КФ 3.2.1.1) каталізує гідролітичне розщеплення крохмалю з утворенням кінцевих продуктів, які не дають забарвлення з йодом. Про активність ферменту судять за надлишком крохмалю, який визначають спектрофотометричним методом за зміною забарвлення йодо-крохмального розчину.
Хід роботи. Визначення активності α-амілази у сироватці крові провести за наступною схемою.
| Хімічний посуд | Об’єм піпетки, мл | Реактиви | Проба, мл | Контроль, мл | Етапи |
| Хімічні пробірки | субстратно-буферний розчин | перед-інкубація | |||
| Інкубувати 5 хв при температурі 37 °С | |||||
| 0,1 | сироватка крові | 0,02 | - | ||
| змішати, інкубувати протягом 7,5 хв при температурі 37 °С (ферментативна реакція) | |||||
| робочий розчин йоду | кольорова реакція | ||||
| 0,1 | сироватка крові | - | 0,02 | ||
| дистильована вода | до 10 | до 10 | |||
| змішати, виміряти Епр і Ек при довжині хвилі 630–690 нм у кюветі (10 мм) проти дистильованої води протягом 5 хв (фотометрія) |
Активність α-амілази у сироватці крові розрахувати за наступною формулою:
активність α-амілази г/л∙год = 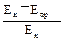 × 160×К,
× 160×К,
де Ек – екстинкція контролю, Епр – екстинкція проби, 160 – коефіцієнт розрахунку, який враховує кількість крохмалю, введеного в пробу і контроль, на 1 л біологічної рідини за 1 год інкубації при температурі 37 °С; К – коефіцієнт розбавлення досліджуваної сироватки крові.
Клініко-діагностичне значення. У нормі активність α-амілази в сироватці крові становить 12–32 г/(год×л). При захворюваннях підшлункової залози спостерігають її підвищення у крові та сечі. При гострому панкреатиті активність α-амілази підвищується в 10–30 разів, стає максимальною на першу добу хвороби, а на другу-шосту - швидко нормалізується. Гіперамілаземія також трапляється при гострому апендициті, перфоративній виразці шлунка та дванадцятипалої кишки, холециститі, розриві жовчного міхура, опіках, травматичному шоку, пневмонії, простатиті, уремії. Підвищенню активності α-амілази сприяють лікарські препарати (кортикостероїди, катехоламіни, фуросемід, антикоагулянти), наркотики, алкоголь. Зниження її активності спостерігають при гепатиті, цирозі, злоякісних утвореннях печінки, цукровому діабеті, гіпотиреозі, кахексії.
Кількісне визначення активності лактатдегідрогенази (КФ 1.1.1.27)
у сироватці крові за Севелом і Товареком
Завдання. Визначити активність лактатдегідрогенази (ЛДГ) у сироватці крові за Савелом і Товареком.
Принцип методу. Під впливом ЛДГ L-лактат за наявності нікотинамідаденіндинуклеотиду (НАД) окислюється до пірувату. Кількість утвореного пірувату визначають фотометрично за кольоровою реакцією з 2,4-динітрофенілгідразином, в якій утворюється 2,4-динітрофенілгідразон, що має червоно-буре забарвлення в лужному середовищі, його інтенсивність прямо пропорційна вмісту кетокислоти.
ЛДГ
СН3-СН(ОН)-СООН + НАД+ → СН3-СО-СООН + НАДН(Н+)
лактат піруват
Хід роботи. В одну пробірку вносять 0,1 мл розведеної у 3 рази сироватки крові, 0,3 мл свіжовиготовленого розчину 0,02 моль/л НАД+ і ставлять на 5 хв на водяну баню при 37 °С для нагрівання суміші. У другу пробірку вносять 0,8 мл розчину 0,03 моль/л натрію пірофосфату, 0,2 мл розчину 0,45 моль/л натрію лактату і нагрівають на водяній бані при 37 °С. Виливають вміст другої пробірки в першу, швидко перемішують скляною паличкою, не виймаючи пробірки з бані, й відзначають час початку інкубації. Через 25 хв реакцію припиняють додаванням 0,5 мл 0,2% розчину 2,4-динітрофенілгідразину в розчині 1 моль/л хлоридної кислоти і залишають пробірку на 20 хв при кімнатній температурі для утворення гідразону. До суміші додають 5 мл розчину 0,4 моль/л натрію гідроксиду, перемішують скляною паличкою і через 10 хв вимірюють екстинкцію дослідної проби проти контрольної на ФЕК при довжині хвилі 520-560 нм у 10 мм кюветах. Контрольну пробу готують так само як і дослідну, але розведену сироватку додають після інкубації. Активність ферменту розраховують за калібрувальним графіком, умови побудови якого наведені в таблиці.
| № пробірки | Робочий стандартний розчин натрію пірувату, мл | Розчин 0,03 моль/л натрію пірофос-фату, мл | Дист. вода, мл | Вміст пірувату в пробі, мкмоль | Одиниці активності ЛДГ ммоль/л×год | Екс-тинкція |
| 0,1 | 0,8 | 0,5 | 0,01 | 1,2 | ||
| 0,2 | 0,8 | 0,4 | 0,02 | 2,4 | ||
| 0,4 | 0,8 | 0,2 | 0,04 | 4,8 | ||
| 0,6 | 0,8 | - | 0,06 | 7,2 | ||
| 0,8 | 0,8 | - | 0,08 | 9,6 |
На осі ординат відкладають значення екстинкції, а на осі абсцис – відповідні їм одиниці активності ЛДГ, виражені в ммоль/л∙год.
Клініко-діагностичне значення. Визначення активності ЛДГ використовують у клініко-біохімічних лабораторіях для діагностики захворювань, а також як тест на одужання. У нормі активність ферменту в сироватці крові становить 0,8–4,0 ммоль/л×год. Вона підвищується при ушкодженні міокарда, лейкозі, хворобі нирок, гемолітичній та серпоподібноклітинній анемії, тромбоцитопенії, інфекційному мононуклеозі, а також прогресуючій м’язовій дистрофії. При хворобах, які супроводжуються некрозом тканин (інфаркт міокарда, некротичні ураження нирок, гепатит, панкреатит, пухлини) спостерігають різке підвищення активності ЛДГ у сироватці крові. При гострому гепатиті вона підвищується в перший тиждень жовтяничного періоду, при легких та середньої важкості формах хвороби швидко нормалізується. У хворих із гострим інфарктом міокарда спостерігається підвищення загальної ЛДГ та ЛДГ1 у сироватці крові через 8–18 год після початку нападу, яке досягає максимуму через 24–72 год. Активність ферментів залишається високою протягом першого тижня і нормалізується на 6–10-й день. Також має значення визначення співвідношення ЛДГ1/ЛДГ2, яке у нормі складає 0,4–0,74, а при гострому інфаркті міокарда зростає у 5–10 разів. При стенокардії активність ЛДГ у сироватці крові не підвищується.
ЛІТЕРАТУРА
1. Губський Ю.І. Біологічна хімія / Ю.І. Губський. – Київ-Тернопіль: Укрмедкнига, 2000. –С. 106–114.
2. Губський Ю.І. Біологічна хімія: підручник / Ю.І. Губський. – Київ-Вінниця: Нова книга, 2007. – С. 140–147.
3. Гонський Я.І. Біохімія людини: підручник / Я.І. Гонський, Т.П. Максимчук, М.І. Калинський. – Тернопіль: Укрмедкнига, 2002. – С. 86–93, 98–102.
4. Біологічна хімія / Л.М. Вороніна та ін. – Харків: Основа, 2000. – С. 137–160.
5. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 145–157, 163–168.
6. Биохимия: Учебник / под ред. Е.С. Северина. – М.: ГЭОТАР-МЕД, 2003. – С. 102–123.
7. Николаев А.Я. Биологическая химия / А.Я. Николаев. – М.: ООО Медицинское информационное агентство, 1998. – С. 84–92.
8. Бышевский А.Ш. Биохимия для врача / А.Ш. Бышевский, О.А. Терсенов. – Екатеринбург: Уральский рабочий, 1994. – С. 43–50.
9. Практикум з біологічної хімії / Д.П. Бойків, О.Л. Іванків, Л.І. Кобилянська та ін. / за ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 51–66.
10. Лабораторні та семінарські заняття з біологічної хімії: навч. посібник для студентів вищих навч. закл. / Л.М. Вороніна, В.Ф. Десенко, А.Л агайко та ін. – Х.: Вид-во НФаУ; Оригінал, 2004. – С. 89–104.
ЗМІСТКОВИЙ МОДУЛЬ 7
ЗАНЯТТЯ 5 (4 години)
Тема: Загальна характеристика вітамінів. Жиророзчинні вітаміни. Якісні реакції на жиророзчинні вітаміни.
Актуальність. Вітаміни – група органічних речовин, які мають різну будову та фізико-хімічні властивості, є абсолютно необхідними для нормальної життєдіяльності організму і виконують у ньому каталітичну, регуляторну або антиоксидантну функції безпосередньо або у складі більш складних сполук. Як правило, в організмі людини вони не синтезуються та не депонуються, тому мають обов’язково надходити з продуктами харчування. Недостатність вітамінів призводить до розвитку специфічного симптомокомплексу, який називають гіпо- та авітамінозом.
Мета. Ознайомитися з історією відкриття вітамінів та роллю вітчизняних учених у розвитку вітамінології. Вивчити загальну характеристику вітамінів: біохімічні закономірності їх функціонування як компонентів харчування людини та регуляторів ферментативних реакцій і обмінних процесів, класифікацію за фізико-хімічними властивостями та клініко-фізіологічною дією, поняття про вітамери та провітаміни, причини та молекулярно-біохімічні механізми виникнення патологій за гіпо- та гіпервітамінозів. Розглянути та вміти охарактеризувати жиророзчинні вітаміни за наступним планом: 1) назва (хімічна, біологічна); 2) хімічна структура та її можливі перетворення; 3) біологічна роль; 4) специфічний симптомокомплекс гіпо- і авітамінозу; 5) джерела та профілактична доза.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
ПІД ЧАС ПІДГОТОВКИ ДО ЗАНЯТТЯ
ТЕОРЕТИЧНІ ПИТАННЯ
1. Історія відкриття вітамінів, роль учених у розвитку вітамінології.
2. Загальна характеристика вітамінів, їх роль в організмі людини.
3. Класифікація вітамінів за фізико-хімічними властивостями та клініко-фізіологічною дією.
4. Провітаміни, формули відомих провітамінів.
5. Загальна характеристика гіпо- та авітамінозів, їх класифікація, причини виникнення.
6. Вітаміни групи А і β-каротини: структура, участь в обміні речовин; джерела, добова потреба для ретинолу і β-каротинів; гіпо- та гіпервітамінози.
7. Вітаміни групи Е: структура, участь в обміні речовин; джерела, добова потреба, симптоми недостатності.
8. Вітаміни групи К: структура, участь у системі згортання крові; джерела, добова потреба. Аналоги та антагоністи вітаміну К як лікарські препарати.
9. Вітаміни групи Д: структура, механізм дії в обміні кальцію та фосфатів, джерела, добова потреба. Гіповітаміноз у дітей та дорослих. Симптоми гіпервітамінозу.
10. Вітамін F (комплекс поліненасичених вищих жирних кислот): структура компонентів комплексу, участь в обміні речовин; джерела, добова потреба, симптоми недостатності.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Який із перелічених вітамінів містить ізопреноїдні фрагменти як структурний елемент?
| А. Е. | С. Д. | Е. Р. |
| В. А. | D. В5. |
2. Який вітамін є похідним стеролів?
| А. В12. | В. С. | С. Д3. | D. К. | Е. А. |
3. Які вітаміни є жиророзчинними?
| А. Вітамін Д. | С. Вітаміни групи В. | Е. Аскорбінова кислота. |
| В. Вітаміни групи К. | D. Вітамін Е. |
4. У хворих з непрохідністю загальної жовчної протоки виникають геморагії, що пов’язані з поганим засвоєнням вітаміну:
| А. F. | В. А. | С. Е. | D. D. | Е. К. |
5. Лікар виявив у хворого збільшення часу адаптації ока до темряви. Недостатність якого вітаміну може бути причиною даного симптому?
| А. Е. | В. А. | С. С. | D. К. | Е. D. |
6.Людям похилого віку необхідно вживати комплекс вітамінів, який містить вітамін Е. Яку головну функцію він виконує?
| А. Антискорбутну. | C. Антиоксидантну. | Е. Антидерматитну. |
| В. Антигеморагічну. | D. Антиневритну. |
7. При якому гіповітамінозі спостерігається одночасне порушення репродуктивної функції організму та дистрофія скелетних м’язів?
| А. В1. | В. А. | С. К. | D. D. | Е. Е. |
8. Для попередження післяопераційної кровотечі дитині 6 років рекомендовано приймати вікасол, який є синтетичним аналогом вітаміну К. Які посттрансляційні зміни факторів згортання крові активуються під впливом вікасолу?
А. Карбоксилування глутамінової кислоти.
В. Фосфорилування радикалів серину.
С. Обмежений протеоліз.
D. Полімеризація.
Е. Глікозилування.
9. У хворого після видалення жовчного міхура порушилися процеси всмоктування кальцію в кишечнику. Який препарат треба призначити для стимулювання цього процесу?
| А. Д3. | В. К. | С. РР. | D. Е. | Е. А. |
10. Линолева та линоленова кислоти необхідні організму людини для синтезу ейкозаноїдів. Головним джерелом цих кислот є:
| А. Аліментарний фактор. | D. Мікросомальне окислення. |
| В. Біосинтез жирних кислот. | Е. Окислення жирних кислот. |
| С. Розпад холестерину. |
11. Який вітамін має антиксерофтальмічну дію?
| А. Д. | В. К. | С. А. | D. Р. | Е. С. |
12. Яке порушення в обміні речовин є характерним для рахіту?
А. Окисного декарбоксилування пірувату.
В. Нормального відкладення фосфату кальцію в кістковій тканині за умов відсутності вітаміну Д.
С. Окисного фосфорилування, дихання.
D. Перенесення метильних груп.
13. Пацієнт скаржиться на втрату апетиту, головний біль, поганий сон. Об’єктивно спостерігаються гіперкератоз, запалення очей, випадання волосся, загальне виснаження організму. З анамнезу відомо, що хворий тривалий час вживав риб’ячий жир. Що можна запідозрити?
| А. Гіпервітаміноз вітаміну Д. | D. Гіповітаміноз вітаміну А. |
| В. Гіповітаміноз вітаміну Д. | Е. Гіпервітаміноз вітаміну F. |
| С. Гіпервітаміноз вітаміну А. |
14. Які прояви К-гіповітамінозу?
| А. Тромбози. | D. Підвищене згортання крові. |
| В. Підшкірні крововиливи. | Е. Дерматити. |
| С. Випадіння зубів. |
15. Мати немовляти скаржиться на поганий сон дитини, плаксивість, дратливість, потіння, облисіння потилиці. Яке захворювання можна припустити?
| А. Цингу. | С. Бері-бері. | Е. Анемію Аддісона-Бірмера. |
| В. Рахіт. | D. Пелагру. |
Оберіть правильні ствердження:
1) джерелом вітаміну Е для людини є рослинні олії, зернові продукти, різні тканини тварин, особливо жирова;
2) каротини широко розповсюджені та синтезуються в організмі тварин;
3) ендогенні гіповітамінози виникають при недостатньому надходженні до організму того чи іншого вітаміну;
4) усі вітаміни містять аміногрупу;
5) вітамін К є похідним піримідину;
6) головним джерелом вітаміну Д є ягоди, овочі, фрукти;
7) природним антагоністом вітаміну К є гепарин – гетерополісахарид, який утворюється в тканинах печінки, легень та затримує процес згортання крові;
8) добова потреба у вітаміні А для дітей нижче, ніж для дорослих;
9) недостатнє надходження до організму вітамінів викликає авітаміноз;
10) за відсутності вітамінів у їжі розвивається авітаміноз;
11) вперше на важливу роль вітамінів як додаткових факторів харчування указав у 1881 р. Н.І. Лунін;
12) вітамін А1 входить до складу зорового пурпуру родопсину;
13) вітамін А2 входить до складу зорового пурпуру родопсину;
14) вітамін А бере участь у процесах трансамінування;
15) група вітамінів К необхідна для нормального згортання крові;
16) механізмом дії вітаміну Д є його участь у вуглеводному обміні;
17) при розщепленні α- та γ-каротинів утворюється по дві молекули вітаміну А;
18) вітамін А входить до складу мультиферментного комплексу, який каталізує декарбоксилування пірувату з утворенням ацетил-КоА;
19) вітамін F запобігає відкладенню холестерину на стінках кровоносних судин;
20) вітамін Е входить до складу зорового пурпуру – родопсину;
21) вітамін К є активною групою ферменту, який бере участь у синтезі протромбіну;
22) для гіпервітамінозу Д характерне надлишкове всмоктування Са в кишечнику;
23) вітамін Е – речовина, необхідна для нормального розмноження;
24) синтез вітаміну К мікрофлорою кишечнику є постійним поставником вітаміну К для людини та тварин.
ПРАКТИЧНА РОБОТА
Якісні реакції на жиророзчинні вітаміни
Завдання 1. Провести реакцію на ретинол із концентрованою сульфатною кислотою.
Принцип. Концентрована сульфатна кислота віднімає воду від ретинолу з утворенням забарвлених продуктів.
Хід роботи. У суху пробірку вносять 2 краплі 0,05% масляного розчину ретинолу в хлороформі (1:5) та додають 1 краплю концентрованої сульфатної кислоти. З’являється червоно-фіолетове забарвлення, яке поступово переходить у червоно-буре.
Завдання 2. Провестиреакцію на ретинол із феруму (III) сульфатом.
Хід роботи. До 2 крапель 0,05% масляного розчину ретинолу у хлороформі (1:5) додати 10 крапель льодяної оцтової кислоти, насиченої феруму (III) сульфатом, і 2 краплі концентрованої сульфатної кислоти. З’являється блакитне забарвлення, яке поступово переходить у рожево-червоне. Каротини дають у цій реакції зеленувате забарвлення.
Завдання 3. Провестиреакціюна кальциферол.
Принцип. При взаємодії з аніліновим реактивом за умов нагрівання вітамін Д забарвлюється у червоний колір.
Хід роботи. У суху пробірку вносять 2 краплі риб’ячого жиру та 10 крапель хлороформу, а потім додають при безперервному помішуванні 2 краплі анілінового реактиву. Обережно нагрівають при безперервному помішуванні та кип’ятять 30 с. За наявності вітаміну Д жовта емульсія набуває зеленого, а потім червоного кольору.
Завдання 4. Провестиреакціюна нафтохінон (вітамін К1).
Принцип. Вікасол у присутності цистеїну в лужному середовищі забарвлюється у лимонно-жовтий колір.
Хід роботи. На сухе скло наносять 5 крапель 0,05% розчину вікасолу, додають 5 крапель 0,025% розчину цистеїну та 1 краплю 10% розчину натрію гідрокисиду. З’являється лимонно-жовте забарвлення.
Оформлення: заповнити таблицю.
| Вітамін | Хімічна будова | Якісна реакція | Механізм реакції | Спостереження |
| Ретинол | ||||
| Кальциферол | ||||
| Нафтохінон |
Практичне значення. Якісні реакції на вітаміни базуються на кольорових реакціях, характерних для тієї чи іншої хімічної групи, що входить до їх структури. Проведення таких реакцій дозволяє виявити вітаміни в лікарських препаратах, харчових продуктах і лікарських рослинах. Принципи, покладені в основу якісних реакцій на вітаміни, використовують і при розробленні методів їх кількісного визначення.
ЛІТЕРАТУРА
1. Губський Ю.І. Біологічна хімія / Ю.І. Губський. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 399–400, 411–417.
2. Губський Ю.І. Біологічна хімія: підручник / Ю.І. Губський. – Київ-Вінниця: Нова книга, 2007. – С. 481–482, 494–501.
3. Гонський Я.І. Біохімія людини: підручник / Я.І. Гонський, Т.П. Максимчук, М.І. Калинський. – Тернопіль: Укрмедкнига, 2002. – С. 107–124.
4. Біологічна хімія / Л.М. Вороніна та ін. – Харків: Основа, 2000. – С. 426–442.
5. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 204–220.
6. Биохимия: учебник / под ред. Е.С. Северина. – М.: ГЭОТАР-МЕД, 2003. – С. 124–125, 132–139.
7. Практикум з біологічної хімії / Д.П. Бойків, О.Л. Іванків, Л.І. Кобилянська та ін.; за ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 219–235.
8. Бышевский А.Ш. Биохимия для врача / А.Ш. Бышевский, О.А. Терсенов. – Екатеринбург: Уральский рабочий, 1994. – С. 134, 138–142.
9. Лабораторні та семінарські заняття з біологічної хімії: навч. посібник для студентів вищих навч. закл. / Л.М. Вороніна, В.Ф. Десенко, А.Л. Загайко та ін. – Харків: Вид-во НФаУ; Оригінал, 2004. – С. 234–241.
ЗМІСТКОВИЙ МОДУЛЬ 7
ЗАНЯТТЯ 6 (4 години)
Тема: Водорозчинні вітаміни. Вітаміноподібні речовини. Антивітаміни. Якісні реакції на водорозчинні вітаміни. Кількісне визначення вітаміну С у сечі та екстракті шипшини.
Актуальність. Знання ролі вітамінів в обміні речовин є необхідним для пояснення виникнення специфічного симптомокомплексу, характерного для розвитку того чи іншого гіпо- або авітамінозу, розуміння можливостей та шляхів їх запобігання і лікування. На підставі якісних проб та кількісного визначення вітамінів і деяких констант біологічних рідин, які залежать від них, можна робити висновки щодо вітамінної забезпеченості організму.
Мета. Вивчити та вміти охарактеризувати водорозчинні вітаміни за наступним планом: 1) назва (хімічна, біологічна); 2) хімічна структура та її можливі перетворення; 3) біологічна роль; 4) специфічний симптомо-комплекс гіпо- і авітамінозу; 5) джерела та профілактична доза. Ознайомитися з вітаміноподібними речовинами та антивітамінами. Ознайомитися з якісними реакціями на водорозчинні вітаміни та методом кількісного визначення вітаміну С.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
ПІД ЧАС ПІДГОТОВКИ ДО ЗАНЯТТЯ
ТЕОРЕТИЧНІ ПИТАННЯ
1. Вітамін В1 (тіамін): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності. Структура ТДФ.
2. Вітамін В2 (рибофлавін): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності. Структура ФАД, ФМН.
3. Вітамін В3 (пантотенова кислота): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності. Структура HS-KoA.
4. Вітамін В5 (нікотинова кислота, нікотинамід, ніацин): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності. Структура НАД та НАДФ.
5. Вітамін В6 (піридоксин): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності. Структура ПАЛФ.
6. Вітамін В7 (біотин): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності.
7. Вітамін В9 (фолієва кислота): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності.
8. Вітамін В12 (кобаламін): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, добова потреба, симптоми недостатності.
9. Вітамін С (аскорбінова кислота): будова, біологічні властивості, механізм дії, роль в обміні речовин, джерела, симптоми недостатності. Профілактична, захисна та лікувальна дози.
10. Вітамін Р (флавоноїди): будова, біологічні властивості, механізм дії, прояви недостатності, джерела, добова потреба.
11. Загальна характеристика вітаміноподібних речовин. Роль карнітину, убіхінону та ліпоєвої кислоти в метаболізмі речовин.
12. Антивітаміни: особливості структури і дії, використання в медицині.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1.Гідроксипролін – важлива амінокислота, що входить до складу колагену. За участю якого вітаміну відбувається утворення цієї амінокислоти шляхом гідроксилування проліну?
| А. В1. | В. D. | С. С. | D. В2. | Е. В6. |
2. У хворого – дерматит, діарея, деменція. Відсутність якого вітаміну є причиною даного стану?
| А. Фолієвої кислоти. | С. Нікотинаміду. | Е. Рутину. |
| В. Аскорбинової кислоти. | D. Біотину. |
3. Хворому призначено піридоксальфосфат. Для корекції яких процесів необхідний цей препарат?
А. Синтезу пуринових та піримідинових основ.
В. Окисного декарбоксилування кетокислот.
С. Дезамінування амінокислот.
D. Синтезу білка.
Е. Трансамінування та декарбоксилування амінокислот.
4. У пацієнта розвинувся дерматит після вживання сирих яєць. Недостат-ність якого вітаміну спостерігається у цьому випадку?
| А. Фолієвої кислоти. | D. Параамінобензойної кислоти. |
| В. Біотину | Е. Пантотенової кислоти. |
| С. Інозиту. |
5. У хворого збільшена концентрація пірувату в крові, значна його кількість виводиться з сечею. Який авітаміноз у хворого?
| А. В2. | С. В3. | Е. B1. |
| В. Е. | D. В6. |
6. Злоякісна гіперхромна анемія – хвороба Бірмера – виникає внаслідок дефіциту вітаміну B12. Який біогенний елемент входить до складу цього вітаміну?
| А. Залізо. | B. Молібден. | C. Цинк. | D. Кобальт. | Е. Магній. |
7. Після видалення 2/3 шлунка в крові зменшилася кількість еритроцитів, збільшився їх об’єм, знизився рівень гемоглобіну. Дефіцит якого вітаміну призводить до таких змін картини крові?
| А. РР. | В. С. | С. Р. | D. В6 . | Е. В12. |
8. У хворого спостерігається кровотеча ясен. Які вітаміни слід призначити?
| А. В1, В2. | С. А, Е. | Е. В3, В7. |
| В. С, К. | D. РР, B12. |
9. При ентеробіозі призначають акрихін – структурний аналог вітаміну В2. Порушення синтезу яких ферментів у мікроорганізмів викликає цей препарат?
| А. Цитохромоксидаз. | D. НАД-залежних дегідрогеназ. |
| В. ФАД-залежних дегідрогеназ. | Е. Амінотрансфераз. |
| С. Пептидаз. |
10. Який вітамін є складовою частиною коферменту, здатного приєднувати та віддавати водень по ізоалоксазиновому кільцю?
| А. Вітамін РР | С. Піридоксамін | Е. Пантотенова кислота. |
| В. Рібофлавін | D. Біотин |
11. Який вітамін синтезується в організмі людини з триптофану?
| А. Нікотинова кислота. | С. Пантотенова кислота. | Е. Токоферол. |
| В. Рибофлавін. | D. Вікасол. |
12.Який вітамін входить до складу коферменту, який бере участь у реакціях трансамінування, декарбоксилування та рацемізації амінокислот?
| А. В1. | С. РР. | Е. Р |
| В. В6. | D. B2. |
13.Який вітамін є складовою частиною коферменту А?
| А. Параамінобензойна кислота. | D. Оротова кислота. |
| В. Піридоксин. | Е. Пантотенова кислота. |
| С. Карнітин. |
14. Який вітамін впливає на проникність капілярів?
| А. Тіамін. | С. Піридоксин. | Е. Пангамова кислота. |
| В. Рибофлавін. | D. Рутин. |
15.Відсутність якого вітаміну викликає хворобу, що супроводжується підвищеною проникністю та ламкістю кровоносних судин?
| А. В1. | С. В6. | Е. Е. |
| В. В2. | D. С. |
16. Хворий скаржиться на загальну м’язову слабкість, болі в ділянці серця. При об’єктивному огляді виявлені запальні процеси слизової оболонки язика і губ, кератит, васкуляризація рогівки. Що може бути причиною такого стану?
| А. Гіпервітаміноз вітаміну А. | D. Гіповітаміноз вітаміну В2. |
| В. Гіповітаміноз вітаміну А. | Е. Гіповітаміноз вітаміну С. |
| С. Гіпервітаміноз вітаміну В2. |
17. Яка хімічна природа ендогенного фактора вітаміну В12:
| А. Ліпід. | С. Простий білок. | Е. Нуклеопротеїн. |
| В. Мукопротеїн. | D. Поліпептид. |
18. При обстеженні хворого виявлено зниження кислотності шлункового соку, зміни з боку нервової системи. При аналізі крові виявлено гіперхромну анемію, наявність великих еритроцитів (мегалоцитів). Яке порушення можна припустити?
| А. Гіповітаміноз вітаміну РР. | D. Гіповітаміноз вітаміну В6. |
| В. Гіпервітаміноз вітаміну РР. | Е. Гіповітаміноз вітаміну В12. |
| С. Гіпервітаміноз вітаміну В6 |
Оберіть правильні ствердження:
1) вітамін В2 є похідним каротинів;
2) вітамін В6 є похідним стеролів;
3) антивітаміном пантотенової кислоти є пентоїлтаурин – антимікробна речовина;
4) карнітин є похідним піридину;
5) біотин є похідним ізоалоксазину;
6) інозит є похідним циклогексану;
7) антивітаміном біотину є авідин;
8) механізм біологічної дії біотину полягає в його участі в окислювально-відновних реакціях;
9) вітамін U надає болезаспокійливу дію, підсилює епітелізацію слизової оболонки шлунка в осіб, які страждають на виразкову хворобу;
10) біологічна дія пантотенової кислоти полягає в тому, що вона входить до складу коферменту А;
11) вітамін В2 входить до складу ферменту, який каталізує окислювально-відновні процеси;
12) тіамінпірофосфат бере участь у здійсненні зорового акту;
13) за участю фолієвої кислоти в організмі людини та тварин можуть синтезуватися СН3- групи, які переносяться на гомоцистеїн з утворенням метіоніну;
14) механізмом дії вітаміну РР є його участь в утворенні ферментів метилювання глікозидів;
15) вітамін В2 використовують при запаленні та кератитах очей, запаленні слизової оболонки порожнини рота, губ, поразках шкіри коло вуха та рота, при дегенерації мієлінових оболонок та інших патологічних станах, пов’язаних із порушенням окислювально-відновних процесів;
16) для авітамінозу В6 характерні хвороба ясен, випадіння зубів, структурні зміни хрящів та кісток;
17) недостатність вітаміну С проявляється втратою апетиту, анемією, швидкою втомою, розлитими болями у різних частинах тіла;
18) біотин входить до складу ферментів, які каталізують зворотні реакції карбоксилування, транскарбоксилування;
19) ліпоєва кислота – кофермент піруватдекарбоксилази;
20) тіамінпірофосфат входить до складу одного з ферментів пентозофосфатного циклу;
21) убіхінон бере участь у реакціях трансметилування;
22) параамінобензойна кислота бере участь у багатьох процесах, зокрема у декарбоксилуванні пірувату;
23) параамінобензойна кислота у складі фолієвої кислоти активізує процес синтезу пуринів та піримідинів, бере участь у біосинтезі ДНК, РНК та процесі перетворення тирозину на меланін;
24) вуглеводна дієта не потребує підвищення вмісту тіаміну;
25) для перніціозної анемії, викликаної авітамінозом В12, характерно по-рушення кровотворної функції;
26) оротова кислота стимулює біосинтез одного з основних білків крові – альбуміну;
27) при авітамінозі В6 розвивається пелагра;
28) при авітамінозі Н з’являються депігментація шкіри, дерматити, нервові розлади, гальмування росту;
29) одним із характерних симптомів авітамінозу В12 є дерматити;
30) для біологічної дії убіхінону характерною є участь у процесі біологічного окислення;
31) при авітамінозі В1 розвивається хвороба бері-бері або поліневрит, в основі якого лежать дегенеративні зміни нервів.
ПРАКТИЧНА РОБОТА
Якісні реакції на водорозчинні вітаміни. Кількісне визначення
вітаміну С у сечі та екстракті шипшини.
Завдання 1. Провести якісні реакції на водорозчинні вітаміни.
А) Діазореакція на тіамін.
Принцип. У лужному середовищі тіамін з діазореактивом утворює складний комплекс оранжевого кольору.
Хід роботи. До діазореактиву, що складається із 5 крапель 1% розчину сульфанілової кислоти і 5 крапель 5% розчину натрію нітрату, додають 1–2 краплі 5% розчину тіаміну і потім по стінці, нахиливши пробірку, обережно додають 5–7 крапель 10% розчину натрію карбонату. На межі двох рідин утворюється кільце оранжевого кольору.
Б) Реакція окислення тіаміну в тіохром.
Принцип. У лужному середовищі тіамін окислюється в тіохром калію гексаціанофератом (III). Тіохром дає синю флуоресценцію при ультрафіолетовому опроміненні розчину на флуороскопі.
Хід роботи. До 1 краплі 5% розчину тіаміну додають 5–10 крапель 10% розчину натрію гідроксиду, 1–2 краплі 5% розчину калію гексаціаноферату (III) і збовтують. Попередньо прогрівають флуороскоп протягом 10 хв та спостерігають синю флуоресценцію при опроміненні розчину ультрафіолетовими променями.
В) Ферихлоридна проба на піридоксин.
Принцип. При додаванні до розчину піридоксину феруму (III) хлориду рідина забарвлюється у червоний колір (утворення комплексної сполуки феруму феноляту).
Хід роботи. До 5 крапель 1% розчину піридоксину додають рівну кількість 1% розчину феруму (III) хлориду і перемішують. Розвивається червоне забарвлення.
Г) Відновлення аскорбіновою кислотою калію гексаціаноферату (III).
Принцип. Аскорбінова кислота відновлює K3[Fe(CN)6] у K4[Fe(CN)6], який із феруму (III) хлоридом утворює синє забарвлення або осад – берлинську лазурь.
Хід роботи. У пробірку наливають 1 краплю 5% розчину калію гексаціаноферату (III), 1 краплю 1% розчину феруму (III) хлориду і додають 5 крапель 1% розчину аскорбінової кислоти. Рідина у пробирці набуває зеленувато-синього кольору, на дні пробірки – синій осад берлинської лазурі.
Оформлення роботи:заповнити таблицю.
| Вітамін | Хімічна будова | Якісна реакція | Механізм реакції | Спостереження |
| Тіамін | ||||
| Піридоксин | ||||
| Вітамін С |
Завдання 2. Визначити вміст аскорбінової кислоти у сечі.
Принцип.Аскорбінова кислота в кислому середовищі відновлює молекулярний йод, при цьому вона з відновленої форми переходить в окислену. Поява синього кольору свідчить про те, що вся аскорбінова кислота з відновленої форми перейшла в окислену і перша надлишкова крапля розчину йоду в присутності крохмалю дає синє забарвлення.
Хід роботи. У колбу відмірюють 5 мл сечі та 5 мл 1 н НСl, додають 5 крапель розчину крохмалю. Титрують 0,001 н розчином йоду до появи синього забарвлення, що не зникає протягом 30 с.
Розрахунок. За результатом титрування розраховують добове виділення аскорбінової кислоти, враховуючи, що 1 мл 0,001 н розчину йоду відповідає 0,5 мкмолям аскорбінової кислоти. Розрахунок проводять за такою формулою:
|
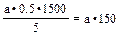 ,
,
де а – кількість мл 0,001 н розчину йоду; 0,5 мкмоль аскорбінової кислоти, що відповідає 1 мл 0,001н J2; 1 500 – добовий діурез, мл; 5 – об’єм сечі в пробі (мл). У нормі за добу із сечею виділяється 284–568 мкмоль аскорбінової кислоти.
Завдання 3. Визначити вміст аскорбінової кислоти в екстракті шипшини.
Принцип. Визначення засновано на окислювально-відновній реакції між аскорбіновою кислотою та 2,6-дихлорфеноліндофенолом, який при відновленні переходить у лейкоформу. Для визначення аскорбінової кислоти з досліджуваного продукту готують підкислений водний екстракт, яким титрують 2,6-дихлорфеноліндофенол. Підкислення вітамінного водного екстракту підвищує специфічність методу.
Хід роботи. 150 г шипшини заливають 5 000 мл води, залишають