Порядок виконання лабораторної роботи. для студентів факультету біотехнології та біотехніки
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
«КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ»
ЗАВДАННЯ ТА МЕТОДИЧНІ ВКА3ІВКИ
ДО ЛАБОРАТОРНИХ РОБІТ ТА ПРАКТИЧНИХ ЗАНЯТЬ
ЗАГАЛЬНОЇ ТА НЕОРГАНІЧНОЇ XІMIЇ
для студентів факультету біотехнології та біотехніки
Київ
“Політехніка”
MIHICTEPCTBO ОСВІТИ ТА НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
«КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ»
ЗАВДАННЯ ТА МЕТОДИЧНІ ВКА3ІВКИ
ДО ЛАБОРАТОРНИХ РОБІТ ТА ПРАКТИЧНИХ ЗАНЯТЬ
ЗАГАЛЬНОЇ ТА НЕОРГАНІЧНОЇ XІMIЇ
Для студентів факультету біотехнології та біотехніки
Затверджено Методичною радою НТУУ “КПІ”
Київ
“Політехніка”
НАВЧАЛЬНЕ ВИДАННЯ
Завдання та методичні вказівки до лабораторних робіт з загальної та неорганічної xiмії
для студентів факультету біотехнології та біотехніки
Укладачі:
Андрійко Олександр Опанасович
Лісовська Ірина Володимирівна
Матяшов Віктор Георгійович
Власенко Наталія Евгенівна
Рецензент:
Пацкова Тетяна Валентинівна
Ці завдання та методичні вказівки складені у відповідності до програми з загальної та неорганічної xiмії для напрямків підготовки “біотехнологія” вищих учбових закладів і призначені для організації самостійної роботи студентів перед лабораторними та практичними заняттями з xімiї, контролю знань та підготовки студентів до проведення лабораторних дослідів.
Посібник складається з трьох частин. В першій частині наведені роботи, що стосуються загальних понять хімії та закономірностей перебігу хімічних процесів, які вивчаються перед розглядом хімічних властивостей неорганічних речовин. Роботи другої частини стосуються вивчення хімічних властивостей елементів та їх сполук. В третю частину винесені деякі теми, що вивчаються на практичних заняттях, передбачених навчальними програмами курсу.
До кожної теми подані теоретичні відомості, які включають ocновні положення програми, контрольні запитання та задачі, порядок виконання робіт (для лабораторних робіт).
При підготовці теми необхідно вивчити програмні питання домашнього завдання за підручниками або за посібниками. Потім письмово розв'язати задачі, дати обгрунтовані відповіді на поставлені запитання, а також підготувати протокол лабораторних дослідів.
Опрацьовуючи матерiал другої частини посібника, потрібно навести необхіднi формули речовин, структурнi формули, рiвняння реакцiй, і, нарештi, пiдготувати рiвняння реакцiй до лабораторних дослiдiв. Якщо при виборi необхiдних реакцiй виникають труднощi, можна скористатись лiвими частинами рiвнянь реакцiй, якi поданi в роздiлi “Закiнчiть рiвняння реакцiй”.
Назви хiмiчних елементiв та простих речовин поданi вiдповiдно до ДСТУ2439-94:
| Символи елементiв | Назви елементiв | Назви простих речовин |
| H | Гiдроген | Водень |
| C | Карбон | Алмаз, графiт |
| N | Нiтроген | Азот |
| O | Оксиген | Кисень, озон |
| F | Флюор | Фтор |
| S | Сульфур | Сiрка |
| Fe | Ферум | Залiзо |
| Ni | Нiкол | Нiкель |
| Cu | Купрум | Мiдь |
| Ag | Аргентум | Срiбло |
| Sn | Станум | Олово |
| I | Iод | Йод |
| Hg | Меркурiй | Ртуть |
| Pb | Плюмбум | Свинець |
| Au | Аурум | Золото |
(назви інших елементів та простих речовин збігаються)
Частина І. Загальна хімія
Лабораторна робота 1
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ. ЗАКОН ЕКВІВАЛЕНТІВ
Мета роботи: навчитися експериментально визначати молярні маси еквівалентів металів.
Теоретичні відомості
Предмет та завдання хімії. Значення xiмiї для підготовки спеціалістів-біотехнологів. Перспективи розвитку хімії, технології та проблеми екології.
Основні поняття xiмiї: атом, елемент, проста речовина, алотропія, молекула. Атомні та молекулярні маси. Моль як одиниця кількості речовини. Молярна маса.
Закон еквівалентів. Еквівалент елементу. Еквівалентна маса. Молярна маса еквівалентів. Еквівалентні маси складних речовин.
Контрольні запитання і задачі.
1. Що таке атом, атомна маса, елемент?
2. Що таке елемент, проста речовина? Відмінності цих понять.
3. Що таке моль, молярна маса? Як визначають молярну масу?
4. Що таке еквівалент, еквівалентна маса? Чи може еквівалент бути ідентичним атому, молекулі речовини? Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів феруму в сполуках Fe2O3, FeSO4?
5. Сформулюйте закон еквівалентів та наведіть його математичний вираз. Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів Сульфуру в сполуках H2S, SO2, H2SO4?
6. Поясніть закон еквівалентів на основі атомно-молекулярного вчення. Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів нітрогену в сполуках NO, NO2, N2O5?
7. Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів сполук: a) H2SO4, б) Al(ОН)3, в) А12О3, г) НС1, д) FеS04, e) Fe2(SO4)3?
8. 3 г металу взаємодіє з 1,64 г сірки. Визначте еквівалентну масу металу (валентність сульфуру у продукті реакції дорівнює 2).
9. 11,9 г металу витісняє з кислоти 2,24 л водню (н.у.). Розрахуйте еквівалент та атомну маси металу, якщо його валентність у продукті реакції дорівнює 2.
10. Визначте еквівалентну масу меркурію в оксиді, його валентність, якщо з 1 г цього оксиду після повного розкладу утворюється 0,9262 г вільної ртуті.
Порядок виконання лабораторної роботи
Визначення молярної маси еквівалентів металу
Молярна маса еквівалентів цинку визначається об’ємним методом за результатами взаємодії цинку з соляною кислотою:
Zn + 2НС1 = ZnCl2+ H2
У колбу місткістю 250 мл налийте через лійку 20 мл розчину солянoї (хлоридної) кислоти так, щоб кислота не попала на шийку колби. Потім колбу потрібно закріпити горизонтально (див. малюнок). У шийку колби покладіть шматочок цинку, попередньо зважений з точністю до 0,01 г. Отвір колби закрийте газовідвідною трубкою, протилежний кінець якої занурте у кpиcталiзатор з водою.
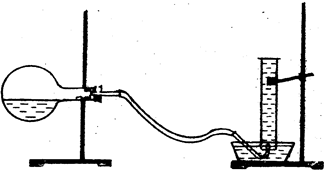
Прилад потрібно перевірити на герметичність. Для цього нагрійте рукою верхню частину колби. Якщо прилад герметичний, з трубки будуть виділятися бульбашки повітря. Якщо бульбашки не виділяються, то необхідно перевірити всі місця з'єднання. Потім заповніть мірний циліндр міcткіcтю 250 мл водою та закрийте скляною пластинкою так, щоб у циліндрі не було бульбашок повітря. Опустіть циліндр у кристалізатор з водою отвором донизу і під водою заберіть пластинку, закріпіть циліндр у штативі вертикально. Кінець газовідвідної трубки підведіть під циліндр (див. малюнок) і переведіть колбу у вертикальне положення. Потрапивши на дно колби, шматочок цинку починає взаємодіяти з кислотою. Водень, що виділяється, буде збиратися в циліндрі над водою. Після розчинення цинку слід виміряти об'єм водню, що виділився, та висоту водяного стовпа від поверхні води в кристалізаторі до поверхні води у циліндрі.
Дані досліду занесіть до лабораторного журналу:
1. Маса наважки металу m, г –
2. Об'єм водню в циліндрі V(Н2), мл –
3. Висота водяного стовпа h, мм –
4. Барометричний тиск Pб, мм рт. ст. –
5. Температура t,°С -
6. Тиск водяної пари, що насичує простір при температурі досліду
(з таблиці) Р(Н2О), мм рт.ст. –
Тиск водню в циліндрі Р(Н2) визначте із співвідношення
Pб = Р(Н2) + Р(Н2О) + h/13,6.
розрахуйте масу водню за рівнянням Менделєєва-Клапейрона:
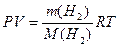
при цьому значення P, V, T треба спочатку перевести в систему СІ (1мм рт.ст.= 133,12 Па, 1мл = 10-6м3; R=8,31 Дж/(моль×К)).
Молярну масу еквівалентів цинку розрахуйте, користуючись законом еквівалентів.

Визначте абсолютну (D) та відносну(d)похибки досліду:
D =М(l/2Zn) досл- М(1/2Zn)теор; 
Лабораторна робота 2