Перед началом работы начертите таблицу
| № зад. | ||||||||
| Индекс отв. |
Часть 1
1.Энтропия системы служит мерой...
1. устойчивости системы к распаду
2. тепловой энергии системы
3. неупорядоченности и бесструктурности системы
4. температуры системы
2. Для смещения равновесия в системе
CO(г) + Cl2(г) ↔ COCl2(г) , Δ H 0 0 , в сторону образования продуктов необходимо
• понизить температуру и давление
• повысить температуру и давление
• понизить температуру и повысить давление
• повысить температуру и понизить давление
3. По правилу --------: на твердой кристаллической поверхности адсорбента адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента
1. Фаянса
2. изоморфизма
3. Гендерсона-Гассельбаха
4. Менделеева-Клайперона
4. Комплексное соединение Ca [ Pt+4 (NO2)4 (Cl)2 ]имеет название
1.дихлоротетранитроплатинат (II) кальция
2.дихлоротетранитроплатинат (IV) кальция
3.дихлоротетранитратоплатинат (II) кальция
4.дихлоротетранитратоплатинат (IV) кальция
5. Щавелевой кислотой в кислой среде ( 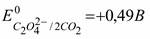 ) восстанавливается ион:
) восстанавливается ион:
| 1) Сг3+ → Сг2+; | Е° = –0,41В; |
| 2) А13+ → А1; | Е° = –1,66 В; |
| 3) Mn2+ → Mn; | E° = –1,19B; |
| 4) MnO4– → Mn2+; | Е° = +1,51 В. |
Часть 2
• Рассчитайте молярную концентрацию эквивалента раствора пероксида водорода, содержащего 1,5 г Н2О2 в 250 см3 раствора. Какой объём раствора калия перманганата с концентрацией С (1/5 КMnO4) = 0,2 моль·дм-3 израсходуется на титрование 25 см3 этого раствора?
1. 4,8 моль·дм-3 2. 0,35 моль·дм-3
52 см3 43,8 см3
3. 0,56 моль·дм-3 4. 2,5 моль·дм-3
43 см3 10 см3
7. Вычислите ∆Н° реакции С6Н12О6 → 2С2Н5ОН + 2СО2,
если : ∆Н° сгорания (С6Н12О6) = -2815,8 кДж·моль-1
∆Н° сгорания (С2Н5ОН) = -1366,9 кДж·моль-1
∆Н° сгорания (СО2) = 0 кДж·моль-1
1. -82 кДж·моль-1 2.+82 кДж·моль-1
3. -164 кДж·моль-1 4.+164 кДж·моль-1
8. Как изменится потенциал марганцевого электрода, если активную концентрацию ионов Mn2+ в жидкой фазе электрода при 298 К повысить от 0,01 моль·дм-3 до 0,05 моль·дм-3?
Е0Mn2+/Mn = -1,18 В.
• уменьшится на 0,042В
• уменьшится на 0,021В
• увеличиться на0,021В
• увеличиться на 0,042В
Часть 3
9. Высокомолекулярные вещества (ВМВ). Классификация. Структура, форма макромолекул и типы связей между ними. Гибкость макромолекул.
10. Мицелла, её строение. Электрокинетический потенциал как фактор, определяющий поведение мицеллы. Для золя иодида серебра, полученного по реакции AgNO3(изб.) + KI → AgI + KNO3
а) указать потенциалопределяющие ионы
б) указать противоионы
в) написать формулу мицеллы
г) привести пример ионов, вызывающих коагуляцию золя
Матрица ответов к демонстрационному варианту билета
| № зад. | ||||||||
| Индекс ответа |
Выполнение заданий билета оценивается следующей суммой баллов
| Часть | № задания | балл оценки | Итого |
| I | 1 – 5 | по 1 баллу | 5 баллов |
| II | 6 баллов 6 баллов 5 баллов | 17 баллов | |
| III | 4 балла 4 балла | 8 баллов | |
| Итого максимально: 30 баллов (100%) |
Таблица перевода набранной суммы баллов
в пятибалльную систему оценки зачетной работы
| Оценка | Итого (сумма баллов) |
| «5» (отлично) | 25 – 30 (83-100%) |
| «4» (хорошо) | 19 – 24 (63-82%) |
| «3» (удовлетворительно) | 12– 18 (40-62%) |
| «2» (неудовлетворительно) | менее 12 (менее 40%) |
Список литературы, рекомендуемой для подготовки к зачету
по дисциплине «Химия» для студентов I курса специальностей
060101- лечебное дело; 060103-педиатрия
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др.Общая химия. Биофизическая химия. Химия биогенных элементов. - М.- Высшая школа, 5-ое изд.-2009.-560 с.
2.Ершов Ю.А., Кононов А.М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. - М.Высшая школа.-2005.-167 с.
3. Общая и биоорганическая химия: учебник для студентов/ И.Н, Аверцева; Под ред. В.А. Попкова, А.С. Берлянда.- М.: Высшая школа, 2010.-113 с.
4. Практикум по общей и биоорганической химии/ И.Н, Аверцева; Под ред. В.А. Попкова, А.С. Берлянда.- М.: Высшая школа, 2008.-67 с.