СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ. 1. Романова Н.В. Загальна та неорганічна хімія
Основна:
1. Романова Н.В. Загальна та неорганічна хімія. Підручник для ВНЗ. – Ірпінь. – 2002. – 480 с.
2. Неділько С.А., Попель П.П. Загальна та неорганічна хімія. Задачі та вправи: навчальний посібник для ВНЗ. – Київ: Либідь. – 2001. – 400 с.
3. Зеленива Общая химия : Киев Л. – 2010. – 412 С.
4. Буринська Н. Н. Хімія c. 246-267, 2008 р.
5. Исаенко Н.И., Войтко И.И. Методические указания к лабораторным работам по
аналитической химии (качественный анализ). – К.: РИО КТЭИ, 1985
6. Ісаєнко Н.І., Войтко І.І. Методичні вказівки до лабораторного практимуму і
самостійної роботи з аналітичної хімії (якісний аналіз). – К.: КТЕІ. 1993
7.Старенький А.Г., Войтко І.І., Ісаєнко Н.І. Збірник карток програмованого
контролю знань з курсу якісного аналізу. – К.: РВВ КТЕІ, 1992
8. Алексеев В.Н. Количественный анализ. – М.: Химия, 1972
9. Войтко И.И., Исаенко Н.И. Методические указания к самостоятельной работе
при подготовке к лабораторным работам по качественному анализу. – К.: КТЭИ,
10. Войтко И.И., Исаенко Н.И. Методические указания и руководство к
лабораторным работам по количественному анализу. – К.: КТЭИ, 1988
11. Войтко І.І., Ісаєнко Н.І. Методичні вказівки до самостійної роботи при
підготовці до лабораторних занять з кількісного аналізу. – К.: РВВ КДТЄК, 1994
Допоміжна
12. Голуб А.М. Загальна та неорганічна хімія. Ч. II. К.: Вища шк., 1971
13. Писаренко А.Г., Хавин З.Я. Курс органической химии. М.: Высш. шк., 1985
14. Нечаев А.Г., Еременко Т.В. Органическая химия. – М.: Высш. шк., 1985
Степаненко Б.Н. Курс неорганической химии. – М.: Высш. шк., 1979
15. Сайке П. Механизм реакций в органической химии. М.: Мир, 1974
16. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. М.: Высш. шк.,
17. Буряк В.Ю., Старенький А.Г., Ісаєнко Н.І. Методичні вказівки до виконання лабораторних робіт і домашніх завдань з курсу органічної хімії (Ч. I). К.: 1995
18. Буряк В.Ю., Старенький А.Г., Ісаєнко Н.І. Методичні вказівки до виконання лабораторних робіт і домашніх завдань з курсу «Органічна хімія» (Ч. II). К.: 1996
19. Краткий курс физической химии \ Под ред. С.Н.Кондратьева. – М.: Высш. шк., 1978
20. Киреев В.А. Краткий курс физической химии. – М.: Химия, 1985
21. Хмельницкий Р.А. Физическая и коллоидная химия. – М.: Высш. шк., 1988
22. Писаренко А.П., Поспелова К.А., Яковлев А.Г. Курс коллоидной химии. М.: Высш. шк., 1969
23. Захарченко В.Н. Коллоидная химия. – М.: Высш. шк., 1989
24. Каданер Л.І. Фізична і колоїдна хімія. К.: Вища шк.., 1971
25. Ліпатников В.Є., Казаков К.М. Фізична і колоїдна хімія. - М.: Высш. шк., 1978
Інформаційні ресурси
https://sites.google.com/site/osvitnires/navcalni.../himia
cf.dp.ua/index.php/ua/.../ph-neorg-cathedres-menu
metodportal.com/node/588
Додаток до п. 7
КОНТРОЛЬНІ ЗАВДАННЯ
1. Визначити молярну масу газу, якщо відомо, що 448 мл його за н.у. мають
масу 1,16 г. Скільки молекул містить ця кількість газу? Легший чи важчий за
повітря цей газ? Молярна маса повітря дорівнює 29 г/моль.
2. За однакових умов однакові об'єми повітря та деякого газу мають маси
відповідно 1,32 та 1,45 г. Обчислити молярну масу газу та масу однієї
молекули цього газу.
3. Обчислити кількість речовини (моль) і масу 2,8 м3 ацетилену C2H2 за н.у.
Скільки молекул міститься в цій кількості газу?
4. Маси однакових об'ємів ацетилену (C2H2) і деякого газу дорівнюють,
відповідно, 0,39 г і 0,45 г. Визначити молярну масу газу і кількість молекул,
що містяться в цих масах газів.
5. Обчислити кількість речовини (моль), яка міститься у 56 м3 кисню за н.у.
Скільки молекул міститься у цій кількості кисню? Яка маса однієї молекули
кисню?
6. Чи однакова кількість молекул міститься: а) в 1 л водню та 1 л метану (CH4)
за н.у.? б) в 1 г водню та 1 г метану? Чому? Відповідь підтвердити
розрахунками.
7. Який об'єм за н.у. займуть 1,6x1021 молекул диоксиду сульфуру. Чому
дорівнює маса молекули диоксиду сульфуру?
8. Визначити молярну масу газу, якщо маса 280 мл його за н.у. дорівнює 1,15 г.
Легший чи важчий за повітря цей газ?
9. Який об'єм за н.у. займуть: а) 6,02 х1021 молекул оксиду нітрогену (ІІ); б)
1,2x1021 атомів кисню; в) 2,0 х 1023 молекул води? Чому дорівнює маса цих
речовин? Чому дорівнює маса однієї молекули води?
10. Що називається густиною та відносною густиною газу? Відносна густина
деякого газу за повітрям дорівнює 1,52. Який об'єм займуть за н.у. 5,5 г цього
газу? Визначити молярну масу цього газу.
11. Чому дорівнює маса 3,01 х 1023 молекул диоксиду нітрогену? Який об'єм
буде мати ця кількість молекул за н.у.? Чому дорівнює маса однієї молекули
NО2 ?
12. Відносна густина деякого газу за азотом дорівнює 1,57. Обчислити молярну
масу газу. Який об'єм ( н.у.) займуть 28 г цього газу? Визначити масу даного
газу, якщо його об'єм дорівнює 44,8 м3.
13. Відносна густина деякого газу за воднем дорівнює 64. Який це газ?
Визначити його молярну масу, густину цього газу, масу однієї молекули та
розрахувати кількість молекул, що будуть займати об'єм 0,056 м3 за н.у.
14. Відносна густина деякого газу за воднем дорівнює 18,25. Обчислити
молярну масу, густину газу, масу однієї молекули. Який об'єм займуть за н.у.
7,3 г цього газу? Скільки молекул міститься в цьому об'ємі газу?
15. Що називається молярною масою? В яких одиницях вона
вимірюється? Обчислити молярну масу деякого газу, якщо 30 г його при
тискові 840,2 кПа та температурі 27°С займають об'єм 3,2 л.
16. Який об'єм за н.у. займуть: а) маса кисню, що дорівнює молярній; б) суміш,
до складу якої входить 2 г водню та 6,4 г кисню; в) 2,5 моль азоту та 1,5 моль
повітря? Яка кількість молекул міститься в кожному з випадків а), б), в)?
17. Визначити молярну масу газу, якщо 1 м3 його при 27°С та тискові 120 кПа
має масу 0,96 кг. Скільки молекул міститься в цій кількості газу?
18. Визначити молярну масу газу, якщо за н.у. 1 м3 його має масу 2,86 кг.
Обчислити масу однієї молекули та густину газу за киснем.
19. Обчислити молярну масу газу, якщо 25 г його при 7°С та тиску 1030 кПа
займають об'єм 20,5 л. Скільки молекул міститься в цій кількості газу? Яка
маса однієї молекули цього газу?
20. В сполуці карбону з гідрогеном міститься 92,26 % карбону. Відомо, що
0,195 г цієї сполуки займають об'єм 61,5 мл при 27°С і тиску 101,3 кПа.
Визначити формулу цієї сполуки.
21. Сполука сульфуру з флуором містить 62,8 % сульфуру. Маса 118 мл цієї
сполуки, виміряна при 7°С і тиску 98 кПа, дорівнює 0,51 г. Написати
формулу сполуки сульфуру з флуором.
22. Яка маса кальцію прореагувала з водою, якщо утворилось 480 мл водню при
25°С і тиску 92 кПа?
23. Сполука гідрогену з арсеном містить 3,85 % водню. Відносна густина цього
газу за повітрям дорівнює 2,7. Написати формулу сполуки. Розрахувати масу
однієї молекули.
24. В балоні ємністю 25,0 л знаходиться при 15°С водень під тиском 8100 кПа.
Обчислити масу водню в балоні та кількість молекул газу.
25. Який об'єм займуть 1,5 г оксиду нітрогену (ІІ) при 0°С і тиску 120 кПа?
Скільки молекул міститься в цій кількості газу?
26. Обчислити молярну масу еквіваленту кислоти, якщо на нейтралізацію 0,009
кг її було витрачено 0,008 кг гідроксиду натрію.
27. Обчислити молярну масу еквіваленту двовалентного металу, якщо з 48,15·10 –3 кг його оксиду можна одержати 88,65 ·10-3 кг нітрату.
28. Обчислити молярну масу еквіваленту двовалентного металу, якщо з
14,2 ·10- 3 кг цього металу утворюється 30,2 ∙10-3 кг сульфату.
29. При з'єднанні 1 г фосфору з киснем було одержано 2,29 г оксиду. Обчислити молярну масу еквіваленту фосфору та його валентність і написати формулу оксиду.
30. Визначити молярні маси еквівалентів: а) оксиду феруму (III) Fе2О3; б) гідроксиду магнію Мg(ОН)2; в) сульфату барію ВаSО4; г) хлодидної кислоти НСІ.
31. Визначити молярну масу еквіваленту слідуючих сполук: а) нітрату купруму Сu(NO3)2; б) оксиду феруму (II) FеО; в) гідроксиду алюмінію Аl(ОН)3; г) сульфідної кислоти Н2S в реакціях:
а) Н2S + КОН = KHS + Н2О
б) Н2S + 2 КОН = К2S + 2 Н2О.
32. При нагріванні 10,03 г металу було одержано 10,83 г його оксиду. Обчислити молярну масу еквіваленту металу.
33. Скласти три рівняння хімічної взаємодії фосфатної кислоти з гідроксидом кальцію, при цьому утворилося дві кислі та одна нормальна сіль. Обчислити молярну масу еквіваленту фосфатної кислоти Н3РО4 для кожної реакції.
34. Молярна маса еквіваленту деякого одновалентного металу дорівнює 39,1 г/моль. Обчислити масову частку (%) оксигену в оксиді цього металу.
35. Обчислити молярну масу еквіваленту металу, якщо при з'єднанні 7,2 ∙10-3 кг його з хлором було одержано 28,2 ∙10-3 кг солі, в якій валентність хлору дорівнює 1.
36. Обчислити молярну масу еквіваленту цинку, якщо 1,168 ∙10-3 кг його виділяють з кислоти 0,438 л водню, виміряного при 17°С і тиску 98,64 кПа.
37. Обчислити молярну масу еквіваленту металу, якщо 0,34∙10-3 кг цього металу виділяють з кислоти 59,9 ∙10-6 м3 водню, виміряного при 0°С і тиску 94,64 кПа.
38. 4,086 ∙10-3 кг металу витиснюють з кислоти 1,4 л водню, виміряного за н.у. Та ж сама маса металу витиснює 12,5∙10-3 кг свинцю з розчину його солі. Обчислити молярну масу еквіваленту свинцю.
39. Арсен утворює два оксиди, масова частка арсену в яких дорівнює 65,2% та 75,7%. Обчислити молярну масу еквіваленту арсену в цих оксидах і його валентність. Написати формули оксидів.
40. Визначено, що масова частка карбону в одному з його бінарних сполук з гідрогеном дорівнює 75%. Обчислити молярну масу еквіваленту карбону та його валентність, написати формулу сполуки.
41. При взаємодії хлору з міддю масою 0,320 г утворюється 0,677 г хлориду. Обчислити молярну масу еквіваленту та валентність купруму в цьому хлориді, написати формулу сполуки.
42. Яку кількість молярних мас еквівалентів вміщують наведені нижче маси речовин: кисню - 32 г, гідроксиду натрію - 15г, нітратної кислоти - 126 г, оксиду карбону (II) - 70 г ?
43. При спалюванні 10,8 ∙10–3 кг металу було витрачено 6,72 ∙10 -3 м3 кисню за н.у. Обчислити молярну масу еквіваленту металу.
44. Обчислити молярну масу еквіваленту основи, якщо на нейтралізацію 1 г основи було витрачено 2,14 г хлоридної кислоти.
45. Нітроген утворює з оксигеном п'ять оксидів. Напишіть їх формули. Еквівалент якого елементу залишається постійним в цих сполуках і чому? Обчислити еквівалент нітрогену в цих оксидах.
46. Сполука металу з бромом містить 89,9% брому. Визначити еквівалент металу, якщо молярна маса еквіваленту брому - 80 г/моль. Чому дорівнює молярна маса металу, якщо його валентність три ?
47. На відновлення 16 г оксиду металу потрібно 4,48 л водню за н.у. Обчислити молярні маси еквівалентів металу та його оксиду.
48. Чому дорівнює кількість молів оксиду, що утвориться при окисленні 4,5 г металу, молярна маса еквіваленту якого дорівнює 9 г/моль ?
49. При окисленні 2,54∙10-3 кг металу утворилося 7,04∙10-3 кг оксиду. Визначити молярну масу еквіваленту металу та його молярну масу.
50. Купрум утворює два оксиди. У першому міститься 80% купруму, у другому 88,8%. Обчислити молярні маси еквівалентів купруму. Визначити валентність купруму в цих оксидах, скласти їх формули.
51. Скласти електронну формулу атому гелію та вказати, які значення квантових чисел мають електрони цього елементу.
52. Вказати значення головного, орбітального, магнітного та спінового чисел, які характеризують стан зовнішнього електрона в атомі натрію. Віддавати чи приєднувати електрони буде атом натрію в хімічних реакціях?
53. Довжина хвилі електрона 0,242∙10-7 м. Обчислити швидкість руху електрона (h=6,62 ∙10-34 Дж∙с).
54. Маса нейтрона 1,675∙10-27 кг, а швидкість руху його 4∙102 м/с. Визначити довжину хвилі де Бройля. (h = 6,62 ∙10-34Дж∙ с).
55. Для атома з електронною структурою 1s2 2s2 2р2 вказати значення чотирьох квантових чисел. Який це елемент? Яке місце в періодичній таблиці він займає?
56. Написати електронні формули атомів елементів з порядковими номерами 16 та 23, вказати розподіл електронів по квантовим коміркам. Які властивості - металів чи неметалів - мають ці атоми?
57. Скільки електронів на зовнішньому енергетичному рівні в атомі силіцію? Які значення квантових чисел вони мають? Показати їх розташування по квантових комірках.
58. Написати електронні формули: атому і іону хлору. Скільки вакантних d- орбіталей має атом і іон хлору? Вказати загальну кількість р-електронів в обох випадках.
59. Чому елементи шостої групи - сірка та хром, що мають в зовнішньому електронному шарі різну кількість електронів, виявляють однакову найвищу валентність? Складіть електронні формули атомів вказаних елементів та покажіть розподіл електронів по вантових комірках в нормальному та збудженому станах.
60. В якого з елементів першої групи - калію чи рубідію в більшій мірі виявляються металічні властивості? Складіть електронні формули цих атомів, вкажіть значення потенціалів їх іонізації.
61. Яке максимальне число електронів може мати атом на електронному рівні з головним квантовим числом 3? Які значення матимуть при цьому інші квантові числа? Навести приклад елементу, в якого завершується забудова третього енергетичного рівня, написати його електронну формулу.
62. Розрахувати довжину хвилі де Бройля для атомів гелію та фтору, які мають швидкість 500 м/с (h = 6,62·10-34 Дж· с).
63. Записати електронну конфігурацію атому брому та вказати, скільки електронних пар в атомі брому, які атомні орбіталі вони займають, скільки неспарених електронів має цей aтом в нормальному та збудженому стані.
64. Квантові числа для електронів зовнішнього енергетичного рівня деяких атомів мають значення:
n = 3, l = 0, m  = 0, m
= 0, m 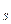 =
=  1/2
1/2  ;
;
n = 3, l = 2, m  = 0,
= 0,  1,
1,  2; m
2; m 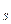 =
=  1/2
1/2 
Вказати, які це елементи, їх місце в таблиці Д.І.Менделєєва, скласти електронні формули і розподіл електронів по квантових комірках.
65. Виходячи з величин електронегативності елементів (див. табл. І), вказати, як змінюється здатність атомів елементів другого періоду до приймання електронів. Відповідь підтвердити, склавши електронні формули атомів цих елементів та розподіл їх по квантових комірках.
66. Написати електронну формулу атома селену (№34). Скільки електронів на зовнішньому енергетичному рівні має селен в нормальному та збудженому стані? Показати їх розташування по квантових комірках.
67. Які значення орбітального та магнітного квантового числа мають електрони, що знаходяться на четвертому рівні? Сформулювати принцип Паулі, правило Гунда.
68. Яке максимальне число електронів може мати атом з головним квантовим числом 2? Які значення при цьому має орбітальне квантове число ? Яку просторову форму мають ці атомні орбіталі?
69. Ядро атому деякого елементу має 16 протонів та 16 нейтронів. Визначити :
а) порядковий номер цього елементу в таблиці; б) молярну масу атома; в) кількість і розподіл електронів по енергетичним рівням та підрівням; г) формулу вищого оксиду; д) формулу його сполуки з гідрогеном.
70. На прикладі елементів третього періоду скласти електронні формули атомів та намалювати розподіл зовнішніх електронів по квантових комірках; вказати, які сполуки з гідрогеном та оксигеном утворюють ці елементи.
71. Які з електронних формул мають помилки в формі запису: а) 1s32s2 ; б)1s22s22p5; в) 1s22s22p63s23p7; г) 1s22s22p63s23p53d4; д) 1s22s22p63s23p5; е)1s22s22p23s23p63d74s2? Виправити помилки та вказати, атомам яких елементів в таблиці вони відповідають.
72. Скільки і які значення може приймати магнітне квантове число, якщо орбітальне квантове число дорівнює 0; 1; 2? Намалювати просторову форму атомних орбіталей цього типу і розподіл електронів по квантових комірках.
73. Скласти електронні формули атомів з порядковими номерами 15 і 28. Скільки вільних d -орбіталей є в атомах цих елементів?
74. Як розміщуються електрони по енергетичних рівнях та підрівнях в атомах елементів з порядковими номерами 20 і 32 ? Написати формули їх сполук з гідрогеном та оксигеном. Написати формули гідроксидів цих елементів і порівняти їх хімічні властивості.
75. Знайти помилки в формі запису електронних структур атомів:
а) 1s22s22p62d23s2 ; б) 1s22s22p63p4 ; в) 1s22s22p43s23p4 ; г)1s22s22p63s23d4 ; д) 1s2s22p63s23p64s24f 5. Виправити помилки і вказати, атомам яких елементів в періодичній таблиці вони відповідають.
76. Визначити максимальне число ступенів свободи та максимальне число фаз, що знаходяться у рівновазі в однокомпонентній та двохкомпонентній системах.
77. Розглянути криву охолодження чистого металу (АД); відмітити відрізок (АВ), який відповідає охолодженню розтопленого металу; відмітити відрізок (ВС), що відповідає процесу кристалізації металу та відрізок (СД), що відповідає процесу охолодження твердого металу, визначити число ступенів свободи системи на відрізках АВ, ВС та СД, користуючись правилом фаз для конденсованих систем.
78. Визначити тип гібридизації електронних хмар атому алюмінію та намалювати просторову структуру молекули АІСІз.
79. Визначити тип хімічного зв"язку в молекулах ВеН2 та ВВг3, змалювати їх просторову структуру.
80. Який із зв'язків - Са - Н; С - S; І - СІ - є найбільш полярним? До якого з aтомів зміщується спільна електронна пара?
81. В якій із сполук : LiF, BeF2, CF4 - зв`язок Е - F буде наближатися до ковалентного? Відповідь обгрунтувати розрахунками ЕН (табл.1).
82. Намалювати діаграму стану Sn - Zn, якщо температура топлення олова 232°С, а цинку 418°С. Евтектичний стоп містить 8% цинку та топиться при 200°С. За даними діаграми визначити, скільки ступенів свободи мають слідуючі склади при вказаних температурах:
Zn(%)............. 5 20 60
Т,°С... .........250 170 300
Які фази співіснують при цьому?
83. Пояснити, чому максимальна валентність фосфору дорівнює п`яти, а нітрогену - чотирьом. Скласти формули оксидів фосфору та нітрогену, в яких ці елементи проявляють різні валентності.
84. Намалювати діаграму стану конденсованої системи LіСІ - КС1, якщо температура топлення КС1 800°С, LіСІ 600оС, а евтектичного стопу 300°С. Склад евтектики: КС1 - 40%, LіСІ - 60%. Визначити, скільки ступенів свободи мають слідуючі склади стопів при відповідних температурах:
LіСІ (%)......40 60 80 100
Т,оС...... 700 300 200 500
85. Які з наведених реакцій є окисно-відновними? Вказати для кожної з них, які атоми окислюються, а які відновлюються, підібрати коефіцієнти:
а) НІО3 + Н2О2 = I2 + O2 + H2O ;
б) ZnSO4 + NaOH = Zn(OH)2 + Na2SO4 ;
в) SO2 + O2 = H2 SO3 ;
г) H2S + O2 = S + H2O ;
86. Скласти схему електронного балансу в реакціях, вказати окисник та відновник:
КNO2 + КІ + Н2 SO4 = N0 + І2 + К2 SO4 + H2O ;
НСІО3 = СIO2 + НСIO4 + H2O;
87. Підібрати коефіцієнти в окисно-відновних реакціях:
Сг(ОН)3 + Вг2 + КОН  ?КВг + К2CrO4 + H2O ;
?КВг + К2CrO4 + H2O ;
КNO3 + Mn SO4 + H2O  ?KNO2 + Н2SO4 + KMnO4;
?KNO2 + Н2SO4 + KMnO4;
В якому напрямку вони будуть перебігати? Відповідь обгрунтувати, обчисливши  Ео за даними табл.3.
Ео за даними табл.3.
Визначити можливості окислення за допомогою сульфатної кислоти галогенводнів до вільних галогенів: а)НС1 до СI2 ; б) НВг до Вг2; в) HJ до J2.
Обчислити  Е за даними табл.3.
Е за даними табл.3.
88. Які з наведених речовин можуть бути тільки окисниками, тільки відновниками, а які окисниками і відновниками: КМnO4, MnO2 , H2O, Na2SO4, H2O2, HNO3 ? Скласти рівняння окисно-відновної реакції, вказати окисник і відновник:
Вi2O3 + СI2 + КОН = КС1 + КВіО3 + Н2О
89. Окислення чи відновлення відбувається при слідуючих перетвореннях:
а) Fe2O3  Fe; б) FeSO4
Fe; б) FeSO4  Fe 2 (SO
Fe 2 (SO  )3 ; в) NH3
)3 ; в) NH3  NO; г) 2CI
NO; г) 2CI 
 CI2;
CI2;
д) CI 
 CIO4- ; e) JO3-
CIO4- ; e) JO3-  J2.
J2.
90. Підібрати коефіцієнти в рівнянні окисно-відновної реакції:
КМnO4 + K2SO3 + K2 SO4 + H2O, вказати окисник та відновник, обчислити  E
E  за даними табл. 3. В якому напрямку буде перебігати ця реакція?
за даними табл. 3. В якому напрямку буде перебігати ця реакція?
91. Скласти рівняння окисно-відновної реакції, вказати окисник та відновник, обчислити  Е за даними табл.3.
Е за даними табл.3.
Cr2 (SO4)3 + Fe2(SO4)3 + K2SO4 + H2O  ?К2 Cr2 O7 + FeSO4 + H2SO4
?К2 Cr2 O7 + FeSO4 + H2SO4
В якому напрямку буде перебігати ця реакція?
92. Вказати перехід електронів і підібрати коефіцієнти в окисно-відновних реакціях:
Zn + H2SO4 (конц) = ZnSO4 + H2S + H2O
Cu + HNO3 (конц) = Cu(NO3)2 + NO + H2O
КМnO4 + FeSO4 + H2SO4 + MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
93. Обгрунтувати можливість окислення КNO2 в КNО3 за допомогою перманганата калію КМnO4 в кислому середовищі (H2SO4), обчисливши  E
E  за даними табл. 3.
за даними табл. 3.
Скласти рівняння реакції.
94. Використовуючи метод електронного балансу, закінчити слідуючі рівняння, вказати окисник та відновник:
КСIO3 + Fe(NO3)2 + HNO3 = KCI + Fe(NO3)3 + …..
КМnO4 + H2S + HCI = MnCI2 + S + …..
Обчислити  Е за даними табл.3.
Е за даними табл.3.
95. Вказати, окислення чи відновлення відбувається при слідуючих перетвореннях:
а) АsO33-  АsO43- б)К2Cr2O7
АsO43- б)К2Cr2O7  К2Cr2O7 ; в) NH3
К2Cr2O7 ; в) NH3  N2 O ; г) BrO
N2 O ; г) BrO 
 Br2 ;
Br2 ;
д) J 
 JO
JO  ; е) NO2
; е) NO2  N2 ;
N2 ;
96. Скласти рівняння реакцій взаємодії Си, Zn та Мg з розчинами концентрованої та розведеної сірчаної кислоти. Вказати, скільки молів H2SO4 було використано в кожному випадку на процес солетворення та процес окислення металу.
97. Скласти рівняння хімічних реакцій, що відбуваються біля електродів у гальванічному елементі, який складається з мідної та олов`яної пластинок, занурених у розчини їх солей, написати схему гальванічного елементу, вказати катод і анод та напрямок зміщення електронів. Пояснити, чи захищатиме олов`яне покриття мідний виріб від корозії, якщо в покритті утворились тріщини?
98. Скласти рівняння хімічних реакцій, що відбуваються біля електродів у гальванічному елементі, який складається із залізної та алюмінієвої пластинок, занурених у розчини їх солей. Записати схему цього гальванічного елементу, вказати анод і катод. Описати коротко механізм захисту заліза від корозії, якщо покрити його поверхню алюмінієм, яким покриттям буде алюміній: анодним чи катодним?
99. Обчислити ЕРС концентраційного гальванічного елементу, який складається з двох мідних електродів, занурених в 0,001 М та 1 М розчини сульфату міді.
100. Скласти схеми двох гальванічних елементів, в одному з яких цинк є катодом, а у другому – анодом. Написати рівняння реакцій, що відбуваються на цинкових електродах під час роботи елементів в першому та другому випадках; обчислити ЕРС обох елементів і значення ∆G0.
101. Гальванічний ланцюг складений із залізного електроду, зануреного у розчин його солі з концентрацією іонів заліза (2+) 0,01 моль/л, та мідного електроду, зануреного у розчин з концентрацією іонів міді (2+), яка невідома.Обчислити невідому концентрацію іонів міді, якщо ЕРС цього ланцюга дорівнює нулю.
102. Обчислити масу технічного заліза, яке містить 18% домішок, необхідного для витіснення з розчину сульфату нікеля 7,42 г нікеля.
103. Визначити окисник та відновник в гальванічному елементі, складеному з олов’яного та срібного електродів, занурених у розчин їх солей, скласти схему гальванічного елементу. Обчислити ЕРС та значення ∆G0. Вказати, чи можливо здійснити дану реакцію в гальванічному елементі.
104. Виходячи із значень стандартних електродних потенціалів (табл.3), розрахувати значення ∆G0 для реакцій, зробити висновок про напрямок цих процесів:
1. Zn + H2SO4 = ZnSO4 + H2
2. Cd + CuSO4 = CdSO4 + Cu
3. Cu + FeSO4 = CuSO4 + Fe
105. Скласти схеми двох гальванічних елементів, які складаються: а) з нікелевої та мідної пластинок,занурених у розчин їх солей; б) з нікелевої та залізної пластинок, занурених у розчини їх солей; обчислити ЕРС цих елементів та ∆G0. При нікелюванні залізних виробів поверхню виробу спочатку покривають міддю, а потім нікелюють. Пояснити, чому таке покриття краще захищає залізні вироби, ніж безпосереднє нікелювання.
106. Чим відрізняється процес електролізу розплавленого хлориду кальцію від процесу електролізу його водного розчину? Які речовини та в якій кількості утворюються біля електродів, якщо через розплав CaCl2 пропускати струм силою 2А на протязі 2 год.10 хв.?
107. Які засоби захисту металів від корозії Ви знаєте? Навести приклади анодного та катодного покриття заліза для запобігання корозії. Скласти рівняння реакцій, що відбуваються біля поверхні заліза та поверхні покриття в розчині, якщо цілісність покриття порушена.
108. Залізо покрите хромом. Який з металів буде кородувати у випадку порушення поверхневого шару покриття в атмосфері промислового району, повітря якого містить CO2, H2S, SO2?
109. Обчислити кількість теплоти, що виділяється при окисленні 16,8 л оксиду сірки (4) киснем в стандартних умовах. Вказати, чи буде цей процес відбуватися самовільно.
110. Обчислити тепловий ефект слідуючих процесів, зробити висновок про їх напрямок в стандартних умовах:
1. KClO3(кр) ↔ KCl(кр) + O2(г)
2. CO(г) + H2O(г) ↔ CO2(г) + H2(г)
3. С(кр) + CO2(г) ↔ 2 CO(г)
111. Термохімічна реакція окислення сірководню має вигляд:
H2S(г) + 1,5 O2(г) ↔ SO2(г) + H2O(г), ∆H0298(процесу) = -517,8 кДж
Обчислити стандартну ентальпію утворення сірководню ∆H0298(H2S).
112. Обчислити зміну енергії Гіббса в реакції: CS2(p) + 3 O2(г) ↔ CO2(г) + 2 SO2(г) при стандартних умовах та при температурі 7270С, зробити висновок про її напрямок в цих умовах.
113. Обчислити ∆H0298; ∆S0298; ∆G0298 для реакції:
ZnS(кр) + O2(г) ↔ ZnO(кр) + SO2(г)
CuO(кр) + H2(г) ↔ Cu(кр) + H2O(г)
Зробити висновок, яка з цих реакцій буде самовільною.
114. Розрахувати стандартну теплоту утворення метану CH4, якщо при спалюванні метану кількістю 1 моль виділяється 802,3 кДж теплоти, при цьому утворюються оксид вуглецю (4) та водяна пара.
115. При розчиненні у воді 16 г карбіду кальцію CaC2 виділяється 31,3 кДж теплоти.
Визначити стандартну теплоту утворення Ca(OH)2.
116. Яка з реакцій розкладання нітрату калію KNO3 має мінімальне значення ∆G0298:
KNO3 = K + NO2 + 0.5 O2
2 KNO3 = K2O + 2 NO2 + O2;
KNO3 = KNO2 + 0.5 O2
117. Чи будуть при стандартних умовах перебігати реакції:
KH + H2O = KOH + H2
KH = K + 0.5 H2?
Який вплив на напрямок цих процесів має підвищення температури до 373 К?
118. Яка з наведених нижче реакцій має менше значення ∆G0298:
4 NH3(г) + 3 O2(г) = 2 N2(г) + 6 H2O(г)
4 NH3(г) + 5 O2(г) = 4 NO(г) + 6 H2O(г) ?
119. Обчислити зміну енергії Гіббса та зробити висновок про напрямок слідуючих процесів в стандартних умовах та при температурі 1000 0C:
2 C(графіт) + H2(г) = C2H2(г)
C(графіт) + CO2(г) = 2 CO(г)
2 Al(кр) + Cr2O3(кр) = 2 Cr(кр) + Al2O3(кр)
120. Розрахувати ∆H0298; ∆S0298; ∆G0298 та зробити висновок про напрямок процесів:
4 NH3(г) + 3 O2(г) ↔ 2 N2(г) + 6 H2O(рід)
CO(г) + 3 H2(г) ↔ CH4(г) + H2O(г)
S(кр) + H2(г) ↔ H2S(г)
121. Обчислити зміну енергії Гіббса в реакції: NH3(г) + HCl(г) = NH4Cl(кр) при стандартних умовах та при температурі 5270С, зробити висновок про можливість перебігу даного процесу в цих умовах.
122. На основі ∆H0298 та ∆S0298 реагуючих речовин (табл.2) обчислити ∆G0298 для процесів і визначити імовірність їх перебігу за стандартних умов:
O2(г) + 2 SO2(г) ↔ 2 SO3(г)
SO2(г) + 2 H2(г) ↔ S(кр) + 2 H2O(г)
123. Обчислити ∆G0298 для системи: PbO2(кр) + Pb ↔ PbO(кр); зробити висновок про можливість цього процесу в стандартних умовах; визначити температуру рівноваги.
124. Обчислити ∆H0298; ∆S0298; ∆G0298 для слідуючих реакцій:
a) N2(г) + O2(г) ↔ 2 NO(г)
б) 2 ZnS(кр) + 3 O2(г) ↔ 2 ZnO(кр) + 2 SO2(г)
125.Обчислити ∆G0298 системи:
Fe2O3(кр) + 3 H2(г) ↔ Fe(кр) + 3 H2O(г); зробити висновок, в якому напрямку ця реакція буде перебігати самовільно за стандартних умов та при температурі 5270С.
126. Розрахувати зміну енергії Гіббса при 250С для процесів, використовуючи значення ∆H0298; ∆S0298 речовин (табл.2):
SO2(г) + 2 H2S(г) ↔ 3 S(кр) + 2 H2O(рід)
KH(кр) + H2O(рід) ↔ KOH(кр) + H2(г)
Зробити висновок про напрямок цих процесів.
127. Розрахувати зміну енергії Гіббса на основі значень ∆H0298; ∆S0298, вказати, яка з наведених реакцій буде протікати самовільно і є екзотермічною:
2 H2O2(рід) ↔ O2(г) + 2 H2O(рід)
3 H2(г) + N2(г) ↔ 2 NH3(г)
128. Обчислити значення ∆H0298; ∆S0298 ; ∆G0298 процесу розкладання карбонатів:
MeCO3(кр) = MeO(кр) + CO2(г), де Me = Ba, Mg, Ca та скласти ряд термічної стабільності карбонатів цих металів за стандартних умов. Вказати вплив температури на перебіг цих процесів, обчисливши значення ∆G0 при 1000 К.
129. Обчислити зміну енергії Гіббса при 250С та 10000С для реакцій:
C(графіт) + H2O(г) ↔ CO(г) + H2(г), ∆Н0298 = 131,3 кДж
2 NO(г) + O2(г) ↔ 2 HO2(г)
Вказати напрямок процесів в цих умовах.
130. Обчислити значення ∆H0298; ∆S0298 ; ∆G0298; зробити висновок про напрямок цих процесів в стандартних умовах та при температурі 500 0С:
4 NH3(г) + 5 O2(г) ↔ 4 NO(г) + 6 H2O(рід)
H2(г) + Cl2(г) ↔ HCl(г)
131. Обчислити температуру, при якій системи знаходяться в стані рівноваги:
O2(г) + 2 H2O(г) ↔ 2 H2O2(рід)
C2H6(г) + H2(г) ↔ 2 CH4(г)
Який з цих процесів є екзотермічним?
132. При розчиненні 13,5 г алюмінію в соляній кислоті виділилося 407,5 кДж теплоти. Обчислити зміну енергії Гіббса в цьому процесі, зробити висновок про його напрямок в стандартних умовах та при температурі 500 0С.
133. Розрахувати, який з наведених процесів може бути самовільним в стандартних умовах: а)С(графіт) + Н2(г) = С2Н2(г); б) С(графіт) + СО2(г) = 2 СО(г);
в) С(графіт) +О2(г) = СО2(г) .Вказати вплив температури на перебіг цих процесів.
134. Обчислити початкову швидкість реакції: N2 + 3 H2 ↔ 2 NH3, коли концентрації реагентів були (моль/л): азоту 1,5; водню 2,5; константа швидкості реакції становить 0,24; та через деякий час, коли утворилося 0,5 моль/л аміаку.
135. Початкові концентрації речовин в реакції: СО + Н2О ↔ СО2 + Н2 були (моль/л) : оксиду вуглецю (2) 0,5; води 0,6; константа швидкості реакції 1,5. Обчислити початкову швидкість реакції та швидкість її після того, як прореагувало 60% води.
136. Дві реакції при 100С відбуваються з однаковою швидкістю. Температурний коефіцієнт швидкості першої реакції 2, а другої 3. Як відноситимуться швидкості цих реакцій, якщо вони відбуватимуться при 50 0С ?
137. Обчислити, при якій температурі реакція закінчиться за 45 хв., якщо при 293 К на це потрібно 3 години? Температурний коефіцієнт швидкості 3.
138. Константи швидкості реакції при 303 і 308 К відповідно дорівнюють 2,2·10-3 і 4,1·10-3 хв-1. Розрахувати енергію активації реакції.
139. Енергія активації реакції: 2 N2O5 ↔ 2 N2O4 + O2 дорівнює 103,5 кДж/моль. Константа швидкості прямої реакції при 298 К дорівнює 2,03·10-3 с-1 .Обчислити константу швидкості при 288 К.
140. Як зміниться швидкість прямої реакції: 2 NO + O2 ↔ 2 NO2, якщо: а) збільшити вдвічі тиск NO ? б) збільшити одночасно концентрації NO та O2 ?
141. Швидкість однієї реакції при нагріванні з 30 до 60 0С збільшилася в 27 разів, а другої – у 8 разів. Чому дорівнює температурний коефіцієнт кожної реакції ?
142. Реакцiя вiдбувається за рiвнянням: 4 NНз + 5О2 <=> 4 NO + 6 Н2О.
Як будуть змiнюватись швидкостi прямої та зворотньої peакції, якщо збiльшити загальний тиск в системi вдвiчi?
143. Константи швидкостi peaкції омилення пропiлового ефiру оцтової кислоти лугом при 283 i 293 К, вiдповiдно, дорiвнюють 2,15 та 4,23 л/(моль . хв). Обчислити енергiю активацiї peaкції.
144. Температурний коефiцiєнт швидкостi реакції: 2НI <=>I2 + Н2 дорiвнює 2. Обчислити константу швидкостi реакції при 684 К, якщо при 629 К константа швидкостi дорiвнює 8,9 ·10-5 л/(моль· с).
145. Дві реакції при 280К вiдбуваються з однаковою швидкiстю. Температурний коефiцiєнт швидкостi першої peaкції 2,0; другої - 3,0. Як будуть вiдноситися швидкостi реакцiй, якшо першу провести при температурi 350 К, а другу - при 330 К?
146. Реакцiя мiж речовинами А i В вiдбувається за схемою: 2А+В<=>2С. Початкова концентрацiя речовини А становить 0,3 моль/л, речовини В - 0,5 моль/л. Константа швидкостi peaкції дорiвнює 0,8. Обчислити початкову швидкiсть реакції та швидкiсть через деякий час, коли концентрацiя речовини А зменшиться на 0,1 моль/л.
147. Визначити рiвноважну концентрацiю водню в peaкції: 2 НІ<=> I2 + Н2, якщо початкова концентрацiя НI була 0,55 моль/л, а константа рiвноваги = 1,22.
148. Як будуть змiнюватися швидкостi прямої та зворотньої peaкції в рiвноважнiй системi: N2 + 3 Н2 <=> 2 NН3, ΔНО298=-92,38 кДж, якшо а) збiльшити тиск? б) збiльшити температуру? Що буде вiдбуватися з рiвновагою в системі, якщо одержання aміаку за цим рiвнянням проводити в присутностi каталiзатора ?
149. Константа рiвноваги для peaкції: СО(г.) + Н2О (г.) <=> С02(г.) + Н2 (г.) при сталому тисковi та 415°С дорiвнює 10. Обчислити значення константи рiвноваги цієї реакції при температурi 650°С. Вважати, що в данному температурному iнтервалi ΔG° = const.
150.Вiдомо, що для peaкції: N204(г.) <=> 2 N02(г.) , ΔНО298= 58,41 кДж; при 400С константа рiвноваги дорiвнює 0,46. Обчислити змiну eнepriї Гіббса при цiй тeмпepaтуpi. В якому напрямку буде змiщуватись рiвновага в цiй системi:
а) при зменшеннi температури; б) при пiдвищеннi тиску?
151. В процесі поглинання адсорбентом aмiaку масою 42,5·10-4 кг видiляється 177,8 кДж теплоти. Визначити теплоту адсорбцiї aмiaкy.
152. Питома площа поверхнi активованого вугiлля досягає 1000 м2 на 1 г вугiлля. Скiльки молекул фосгену (СОС12) поглинається 5м2 площi поверхнi вугiлля, якщо адсорбцiйна здатнiсть для фосгену складає 0,440 л газу на 1 г вугiлля?
153. Реакція відбувається з виділенням теплоти: 2NO(г.) + СІ2(г.)<=> 2NOC1(г.) В бік якої реакції зміститься рівновага, якщо: а) тиск в системі знизити вдвічі; б) підвищити температуру на 40° (температурні коефіцієнти прямої та зворотньої реакції, відповідно, дорівнюють 2 і 3)?
154. Рівновага реакції 2 NO + О2 <=> 2 N02 встановилася при слідуючих концентраціях речовин (моль/л):[NO] = 0,5; [О2] = 0,7; [NО2] = 2,1. Як будуть змінюватися швидкості прямої та зворотньої реакції, якщо в системі збільшити загальний тиск вдвічі? Чи відбудеться зміщення хімічної рівноваги?
155. Залізо занурюють в розчин, який містить іони СrЗ+, Cr2+ та Fe2+. Рівноважні концентрації цих іонів в розчині, відповідно, дорівнюють (моль/л): 0,03; 0,27 та 0,11. Знайти константу рівноваги для процесу:
2СrЗ+ (водн.) + Fe (кр.) <=>2Cr2+ (водн.)+ Fe2+ (водн.)
156. Рівновага реакції: N2 + 3Н2 <=> 2NНз встановилася при слідуючих концентраціях речовин (моль/л): [N2] = 0,3; [Н2] = 0,9; [NНз] = 0,4. Як будуть змінюваться швидкості прямої та зворотньої реакції, якщо в системі збільшити загальний тиск у 5 разів? Чи відбудеться зміщення хімічної рівноваги?
157.Рівновага реакції: СО + СІ2 <=> СОСІ2 встановилася при слідуючих концентраціях речовин (моль/л): [СО] = 0,1; [СІ2] = 0,2; [СОСI2] = 2,0. Як будуть змінюваться швидкості прямої та зворотньої реакції, якщо в системі збільшити загальний тиск у 10 разів ? В якому напрямку відбудеться зміщення хімічної рівноваги?
158. Написати вираз констант рівноваги для слідуючих процесів:
а) 2NНз(г.)<=>N2(г.)+ 3Н2(г.); б) FезО4(кр.) + 4СО(г.) <=> 3Fe(кр.)+ 4СО2(г.)
в) С(кр.) + СО2 ( г.) <=> 2СО(г.); г) Fе2О3 (кр.) + Н2(г.) <=> 2FезО4 (кр.) + Н2О(г.)
В якому напрямку зміщується рівновага в кожній системі при підвищенні тиску?
159. Зміною яких факторів (Т, Р, С) можна змістити рівновагу у наведених нижче реакціях в напрямку прямого процесу - одержання продуктів:
2SO2(г.)+ О2 ( г.) <=> 2SО3 (г.) , ΔНО298= -196,6 кДж
CS2(рід.) + 3О2(г.) <=> 2 SО2(г.) + СО2(г.), ΔНО298=-1075 кДж
С(кр.) + Н2О(пара) <=> СО(г.) + Н2(г.) , ΔНО298 = 130 кДж
160.В 0,5 л розчину міститься 10,6 г карбонату натрію Nа2СО3. Обчислити масову та молярну концентрацію солі. Густина розчину дорівнює 1,102 г/мл.
161. Скільки грамів сульфату міді CuSO4 необхідно взяти для приготування таких розчинів: а) 600 мл 0,2 М розчину; б) 200 мл 10%-го розчину з густиною 1040 кг/мЗ?
162. При 40°С тиск водяної пари 7375,9 Па. Яким буде тиск пари при цій температурі, якщо в 540 г води розчинити 36 г глюкози С6НІ2О6 ?
163. Розрахувати, чи при однаковій температурі будуть замерзати розчини, що містять: а) 12 г сечовини CO(NН2) 2 в 1л води та 18,4 г гліцерину С3Н8Оз в 1л води; б) 0,2 моль глюкози С6НІ2О6 в 1л води та 0,2 моль гліцерину в 1000 мл води.
164.Коли розчинили 8 г нафталіну в 200 г бензолу, температура кипіння останнього підвищилась на 0,64оС. Визначити молекулярну масу нафталіну. Ебуліоскопічна константа бензолу дорівнює 2,56оС.
165. Пояснити, чи при однаковій температурі будуть кипіти розчини, що містять: а) 2 г формальдегіду СН2О в 100 г води та 2 г глюкози C6H12О6 в 100 г води;
б) 0,1 моль формальдегіду в 100 г води та 0,1 моль глюкози в 100 г води.
166. При 20°С тиск водяної пари 2337,8 Па. Який тиск пари при цій температурі над розчином, що містить в 180 г води 18,4 г гліцерину С3Н8О3?
167.В 100 г води розчинили 8,4 г сечовини CO(NН2) 2. Визначити температуру замерзання цього розчину.
168. Скільки грамів гліцерину С3Н8О3 необхідно розчинити в 1 л води, щоб температура замерзання знизилася до -10°С ?
169. Пояснити, чи є колоїдні розчини гомогенними системами. Записати формули колоїдних частинок золей: а) гiдроксиду заліза (ІІІ); б) йодиду срібла. Пояснити механізм коагуляції та седиментації цих колоїдних розчинів.
170. Тиск пари над розчином, який містить 10,5 г неелектроліту в 200 г ацетону, дорівнює 21854,4 Па. Тиск пари чистого ацетону (СН3)2СО при цій температурі дорівнює 23939,4 Па. Знайти молярну масу неелектроліту.
171.Знайти осмотичний тиск розчину, який містить 90,0 г глюкози С6Н12О6 в 4л розчину при 27оС.
172. При якій температурі осмотичний тиск розчину, що містить 18,6 г аніліну C6H5NH2 в 3 л розчину, досягне 2,84 ·105 Па?
173. При 0°С осмотичний тиск розчину цукру С12Н22О11 дорівнює 3,55·105 Па. Скільки моль цукру міститься в 1 л цього розчину?
174. Коли розчинили в 400 мл води 6,8 г неелектроліту, утворився розчин з температурою замерзання -0,93оС Визначити молярну масу розчиненої речовини.
175. Змішали два розчини (а) та (б): а) 36 г глюкози С6НІ2О6 в 150 мл води та б) 4,6 г глюкози в 100 мл води. Визначити підвищення температури кипіння розчину, що утворився після змішування.
176. Осмотичний тиск розчину, що містить в 1 л 3,2 г неелектроліту, дорівнює 2,42 ·105 Па при 20оС. Обчислити молярну масу неелектроліту.
177. Яку масу метилового спирту СН3ОН повинен містити водний розчин об'ємом 1 л, щоб його осмотичний тиск був таким самим, як і розчину, що містить в 1 л 9 г глюкози C6H1206 при цій же температурі?
178. Осмотичний тиск розчину цукру С12Н22О11 дорівнює 151,9 кПа. Обчислити температуру кристалізації цього розчину. Прийняти густину розчину за 1,0 г/мл.
179.Що називають ефектом Тиндаля? Як використовують цей ефект для ідентифікації колоїдних розчинів? Які існують методи одержання колоїдних
розчинів? Стисло описати їх суть на прикладі утворення міцели золю гідроксиду заліза Fе(ОН)3.
180. Підвищення температури кипіння водного розчину цукру С12Н22О11 дорівнює 0,312°С. Обчислити величину зниження температури кристалізації цього розчину.
181. Написати формулу речовини, яка містить 40,0 % вуглецю, 6,67 % водню та 53,33 % кисню, якщо осмотичний тиск розчину, що містить 36 г цієї речовини в 1 л, складає 453,94 кПа при 0°С (Cх Hу Oz).
182. Які іони можуть бути зарядотворюючими та протиіонами в колоїдній частинці золю йодиду срібла в двох випадках: а) в присутності надлищку йодиду калію та б) в присутності надлищку нітрату срібла?
183. Визначити температуру замерзання та кипіння водного розчину етилового спирту, якщо масова концентрація С2Н5ОН в ньому складає 40 %.
184.Написати в молекулярно-іонній формі рівняння реакцій між слідуючими речовинами: а) Na2SO3 і H2S04; б) NН4CI і КОН; в)CuSО4 і NaOH.
185. Написати в молекулярно-іонній формі рівняння реакцій гідролізу солей: Na2S, ZnSО4, (NН4) 2СО3. Вказати рН і реакцію середовища в цих розчинах.
186. Скласти молекулярні рівняння до наведених молекулярно-іонних:
а) Fе2+ + Н2О <=> H+ + FеOH+;
б) NH4+ + Н2О <=> H+ + NН4OH;
в) СН3СОО - + Н2О <=> СН3СООН + ОН -.
187. Обчислити молярну концентрацію розчину оцтової кислоти СН3СООН, рН якого дорівнює 3. Кдис (сн3соон ) == 1,75 ·10-5 .
188. Написати необхідні рівняння реакцій в молекулярній та молекулярно-іонній формах, щоб пояснити, чому розчини NН4Cl, FeSО4, Zn(NO3)2 використовуються для обробки поверхні в процесах пайки металів.
189. Визначити концентрації іонів Н+ і ОН- в розчинах, водневий показник яких дорівнює: 5,0; 9,0; 6,0; 11,0. У скільки разів концентрація іонів Н+ більша або менша за концентрацію іонів ОН- в цих розчинах?
190.Обчислити концентрацію іонів ОН- в 0,1М розчині гідроксиду амонію. Чому дорівнює рН цього розчину? Кдис.(NН4ОН) =1,77 ·10-5 .
191. Чи можна приготувати розчин, який містить одночасно такі речовини:
а) Сu(ОН)2 і NaOH; б) NaOH і Сr(ОН)3; в) K2S04 і ВаС12; г) K2S04 і АIСl3;
д) АIСl3 і КОН; е) Fе(ОН) 3 і НNОз? Написати можливі реакції в молекулярному та іонно-молекулярному вигляді.
192. Скласти молекулярні та іонно-молекулярні рівняння до кожного з процесів:
а) Cu(OH)2 + 2H+ = Cu2+ + 2 H2O;
б) AgNO3 + NaCl = AgCI + NaNO3;
в) Zn2+ + H2O = H+ + ZnOH+
г) CaS + HCI = H2S - CaCI2.
193. Чому розчин хлориду амонію має кислу реакцію, розчин карбонату натрію -лужну, а розчин сульфіду алюмінію - нейтральну? Скласти молекулярно-іонні рівняння реакцій, що відбуваються при розчиненні цих солей у воді.
194. Скласти рівняння реакцій дисоціації таких сполук, враховуючи, що слабкі електроліти дисоціюють ступінчасто: H2SO4, H2CO3, Ba(NO3)2; CuOHCI; KOH; Mg(OH)2.
195.Обчислити ступінь дисоціації NH4OH в його розчинах з концентрацією (моль/л): 0,1; 0,01; 0,001. Кдис.(NH4ОН) = 1,77·10-5.
Побудувати графік залежності ступеня дисоціації (вісь ординат) від концентрації розчину (вісь абсцис), зробити висновок про їх взаємозалежність.
196. Обчислити концентрацію іонів H+ в 0,1М розчині оцтової кислоти СНзСООН і молярну електропровідність цього розчину при 298 K, якщо при цій температурі
λ∞=390,7 см2/(Ом·моль), Кдис.(СН3СООН)=1,74·10-5.
197.Опір ячейки, що заповнюється розчином KCl з питомою електропровідністю 5,79∙10-3 Ом-1см-1, дорівнює 103,6 Ом. Опір такої ж ячейки, заповненої 0,01 M розчином оцтової кислоти, дорівнює 5771 Ом. Визначити молярну електропровідність 0,01 M розчину оцтової кислоти.
198. Ступінь дисоціації оцтової кислоти в водних розчинах з молярною концентрацією: 1,0; 0,1; 0,01 розчинах, відповідно, дорівнює: 0,42; 1,34; 4,25 %. Обчислити K дис.оцтової кислоти в цих розчинах. Побудувати графічну залежність Кдис. (вісь ординат) від концентрації кислоти (вісь абсцис), зробити висновок про їх взаємозалежність.
199. Написати в молекулярно-іонній формі рівняння реакцій між слідуючими речовинами: а) Na2CO3 і H2O; б) NH4OH і H2SO4; B)CaCO3 і HCl; г) AgNO3 і CuCl2;
д) NaCN і H2O.
200. Скласти по два молекулярних рівняння до кожного з іонних рівнянь:
а) H+ + OH- = H2O;
б)Са2+ + СО32- = СаСОз;
в) CO32- + H2O <-> HCO3- + ОH-
201.Обчислити молярну електропровідність розчину соляної кислоти (HCl) з концентрацією 0,1 моль/л, якщо питома електропровідність її розчину дорівнює 3.9·10-3Ом-1 /см-1.
202.Обчислити значення рН розчинів гідроксиду натрію з концентраціями 0,01 та 0,001 моль/л та при 25оC.
203. Обчислити, при якій концентрації розчину гідроксиду амонію ступінь дисоціації становитиме 2,0%. Чому дорівнюватиме концентрація гідроксид- іонів та рН розчину? Кдис.(NH4ОН) =1,77∙10-5.
204. Питома електропровідність розчину гідроксиду амонію з концентрацією 0,0109 моль/л при 18°С дорівнює 1,02∙10-4 Ом/см, а з концентрацією 0,0219 моль/л - 1,50∙10-4Ом/см, λ∞= 237,6 см2/(Ом∙моль). Обчислити ступінь і константу дисоціації гідроксиду амонію в указаних розчинах.
205.До водних розчинів сполук: NaHCO3, Zn(OH)2, H2SO4, Cu (NO3)2 додали розчин гідроксиду натрію. Скласти молекулярно-іонні рівняння реакцій, які будуть відбуватися при цьому.
206.Написати рівняння електролітичної дисоціації таких речовин: CaCl2, ZnOHNO3, Al2(SO4)3 , Ва(НСО3)2, H2SO3.
207. За іонним добутком води обчислити концентрацію іонів водню та гідроксилу в розчині, рН якого дорівнює 5. Лужне чи кисле середовище в цьому розчині ?
208. Скласти в молекулярному та іонно-молекулярному вигляді рівняння реакцій гідролізу солей, які будуть гідролізувати, вказати рН і реакцію середовища в кожному випадку: Ва(NO3)2, CrCl3, CuSO4, NH4Cl, K2S, Na2CO3.
209.Описати типи хімічного зв`язку в молекулах етану, етену (етилену), етіну (ацетилену), скласти їх структурні формули. Які реакції найбільш характерні для цих сполук? навести приклади.
210.Написати структурні формули вуглеводнів за назвами: а) гептан; б) 3-метил-2-хлоргексан; в) пентан-2-ол; г) гексен-2; д) бутанова кислота; є) трибромбензол.
211.Написати рівняння реакцій, які ведуть до утворення таких речовин: а) CH2=CHCN; б) CH3CHO; в) C2H5-OCO-CH3; г) CH2Br=CH2Br. Назвати всі наведені вище речовини і cкласти їх структурні формули.
212.Описати хімічну будову слідуючих молекул: метану, етилену та ацетилену. Яку масу хлору можуть приєднати IO л суміші, яка містить 32,8% CH4; 22,4% C2H2; 44,8% C2H4?
213.Написати структурну формулу спирту, який має склад С3Н8О.Скласти рівняння реакцій його з: а) оцтовою кислотою; б) йодоводнем; в) металевим калієм.
214. При взаємодії 3,7 г насиченого одноатомного спирту з металевим натрієм виділилося 560 мл водню (н.у.). Обчислити молярну масу спирту, написати його структурну формулу.
215. Скласти рівняння реакції одержання тринітрогліцерину. До якого типу сполук належить тринітрогліцерин? Розрахувати, скільки літрів CO2 виділиться під час вибуху 1,5 г тринітрогліцерину.
216.Із 7,8 г бензолу при дії надлишку брому утворюється 15 г бромбензолу. Обчислити вихід (%)C6H5Br від теоретичного.
217.Визначити напрямок реакції крекінгу циклогексану: С6Н12→3C2H4; Відповідь підтвердити, розрахувавши ∆Н298, ∆S298, ∆G0298 за табличними даними.
218.Написати рівняння реакції полімеризації формальдегіду та визначити коефіцієнт полімеризації, якщо утворюється поліформальдегід з середньою молярною масою 45000. Яка кількість полімеру може утворитися, якщо для реакції взяти 250 кг розчину формальдегіду з масовою концентраією HCOH
40%?
219.Волокно "енант" одержують поліконденсацією аміноенантовоі кислоти (NH2-(CH2)6-COOH). Написати рівняння реакції поліконденсації та визначити масу аміноенантовоі кислоти, яка необхідна для одержання 150 г смоли.
220. Скласти рівняння полімеризації бутанового (масляного) альдегіду С3Н7СОН. Визначити масу розчину альдегіду з масовою концентрацією 12%, яка потрібна для одержання 500 кг полімеру. Чому дорівнює коефіцієнт полімеризації полібутаналя?
221. Під час реакції акрилової кислоти CH2=C