Визначення загальної твердості води
Задачі для розв'язку.
1. Концентрація іонів H+ у розчині 1.10-3 моль/л. Знайти pH, pOH та вказати яке це буде середовище.
2. Концентрація іонів OH- у розчині 1.10-4 моль/л. Знайти pH, pOH та вказати яке це буде середовище.
3. Обчислити [H+ ], [OH- ], pH, pOH та вказати середовище в:
0,01 М розчині HCl.
4. Обчислити [H+ ], [OH- ], pH, pOH та вказати середовище в:
0,01 М розчині NaOH.
5. Обчислити [H+ ], [OH- ], pH, pOH та вказати середовище в:
0,01 М розчині NH4OH (a=1%).
6. Обчислити [H+ ], [OH- ], pH, pOH та вказати середовище в:
0,1 М розчині CH3COOH (a=1%).
Лабораторне заняття №2 Теоретичні основи аналітичної хімії
Мета: Засвоїти способи вираження концентрацій в аналітичній хімії.
Контрольні питання
1. Що таке нормальна концентрація розчину?
2. Що таке молярна концентрація розчину?
3. Що таке титр розчину?
4. Як від титру перейти до нормальної концентрації розчину та від нормальної концентрації розчину до титру?
5. Що таке титр за визначаємою речовиною?
Задачі для розв'язку.
1. В 1 літрі розчину міститься 25 г сульфатної кислоти. Порахуйте молярну, еквівалентну концентрацію та титр розчину.
2. Який об’єм 24% розчину хлоридної кислоти ( 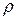 = 1,12г/мл) необхідно взяти для приготування 2 л. 0,1 н. розчину. Який буде титр цього розчину?
= 1,12г/мл) необхідно взяти для приготування 2 л. 0,1 н. розчину. Який буде титр цього розчину?
3. В 200 мл. розчину міститься 10 г натрій гідроксиду. Порахуйте нормальну концентрацію та тир цього розчину.
4. Порахуйте титр 0, 100 н. розчину калій перманганату.
5. Порахуйте нормальну концентрацію розчину калій йодиду, титр якого 0,002 г/мл.
- Яку масу Na2S2O3.5H2O необхідно взяти щоб приготувати 1 літр 0,05 н. розчину. Який титр буде цього розчину. Врахуйте також що ця сіль є кристалогідрат.
Лабораторне заняття №3
Якісний аналіз
Мета: Засвоїти кислотно-основну класифікацію катіонів та аніонів та основи якісного аналізу.
Контрольні питання
1. Поділ катіонів та аніонів на аналітичні групи в кислотно-лужному методі аналізу.
2. Перша група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
3. Друга група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
4. Третя група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
5. Четверта група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
6. П'ята група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
7. Шоста група катіонів. Груповий реактив та реакції катіонів групи з груповим реагентом.
8. Перша група аніонів. Груповий реактив та реакції аніонів групи з груповим реагентом.
9. Друга група аніонів. Груповий реактив та реакції аніонів групи з груповим реагентом.
10. Третя група аніонів. Груповий реактив та реакції аніонів групи з груповим реагентом.
11. Виявлення окремих катіонів. Приклади визначення катіонів селективними (специфічними) реакціями.
12. Виявлення окремих аніонів. Приклади визначення аніонів селективними (специфічними) реакціями.
Лабораторне заняття №4 Гравіметричний метод аналіз
Мета: Засвоїти основи гравіметричного аналізу на прикладі визначення вологості хліба.
Контрольні питання
1. Суть гравіметричного аналізу та поділ на три групи.
2. Основні переваги та недоліки гравіметричного аналізу.
3. Що таке осаджувальна та гравіметрична форми в гравіметричному аналізі.
4. Які терези називають аналітичними?
5. Що таке наважка?
Хід визначення:
1. Бюкс просушити в сушильній шафі на протязі 30 хвилин при температурі 110°С до постійної маси, охолодити та зважити.
2. Взяти наважку хліба (приблизно 5 грам).
3. Висушити (зневоднити) хліб в сушильній шафі при температурі 140°С на протязі 40 хвилин.
4. Визначити вологість хліба за формулою:
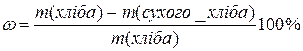
Де:
m(хліба) – маса хліба до висушування. Обчислюється як різниця маси бюкса з хлібом до висушування мінус маса пустого бюкса.
m(сухого хліба) – маса хліба після висушування. Обчислюється як різниця маси бюкса з хлібом після висушування та маса пустого бюкса.
5. Захистити лабораторну роботу у викладача та отримати оцінку.
Лабораторне заняття №5
Кількісний аналіз
Мета: Приготування та стандартизація робочих розчинів (титрантів) хлоридної кислоти, натрій гідроксиду та калій перманганату.
Хід роботи:
Робочі розчини (титранти) хлоридної кислоти, натрій гідроксиду та калій перманганату готують використовуючи фіксанали. Для цього в мірну колбу на один літр вставлюють лійку та бойок від фіксаналу і несильно ударяють фіксаналом по бойку щоб його розбити. Потім пробивають верхній кінець ампули фіксаналу і промивають вміст ампули дистильованою водою перемішуючи розчин що утворився та доводять об’єм розчину до мітки ( 1 літр).
Необхідно дотримуватись термінів зберігання фіксаналів, так як розчин натрій гідроксиду може роз’їдати скло ( при цьому вміст ампули-фіксаналу або приготовленого розчину втрачає прозорість. Такий розчин для титрування непридатний.
Розчин калій перманганату необхідно готувати на бідистильованій воді, що додатково була очищена від органічних сполук (для цього в дистильовану воду додають деяку кількість калій перманганату витримують декілька діб та ще раз переганяють).
Зберігають розчин калій перманганату в темному місці. Так як на світлі він поступово розкладається змінюючи свою концентрацію.
Для уточнення концентрації розчину калій перманганату його титрують з щавлевою кислотою.
Лабораторне заняття №6 Титриметричний аналіз
Мета: Засвоїти алкаліметричне титрування на прикладі визначення вмісту ацетатної кислоти в маринаді.
Хід визначення:
1. Піпеткою відібрати на аналіз 10,0 мл маринаду, перенести в конічну колбу на 200 мл та додати декілька крапель індикатору – розчину метилоранжу.
2. В бюретку залити 0,100 н. розчин калій гідроксиду приготовлений з фіксаналу.
3. Записати рівняння реакції взаємодії ацетатної кислоти з розчином калій гідроксиду. Визначити яке середовище буде в титрувальній колбі до точки еквівалентності, в точці еквівалентності та після досягнення точки еквівалентності.
4. Провести титрування розчину маринаду розчином калій гідроксиду до зміни забарвлення індикатору з червоного на жовтий не допускаючи надлишку розчину калій гідроксиду. Титрування провести тричі та розрахувати середнє значення об'єму розчину калій гідроксиду, що пішов на титрування.
5. Розрахувати еквівалентну концентрацію розчину ацетатної кислоти в маринаді та масу розчину ацетатної кислоти в 1 літрі маринаду. Для розрахунків використати закон еквівалентів.
- Захистити лабораторну роботу у викладача та отримати оцінку.
Лабораторне заняття №7 Титриметричний аналіз
Мета: Засвоїти основи комплексонометричного титрування на прикладі визначення твердості води.
Контрольні питання
1. Які іони зумовлюють твердість води?
2. Що таке комплексонометричне титрування?
3. Як визначають точку еквівалентності в комплексонометричному титруванні?
Хід визначення:
Метод ґрунтується на утворенні міцної комплексної сполуки трилону Б (двонатрієвої солі етилендіамідтетраоцтової кислоти - ЕДТА) з іонами кальцію і магнію. Визначення проводять титруванням проби трилоном Б при рН=10 в присутності індикатора.
Якщо у воду, яка містить іони кальцію та магнію, внести індикатор, що дає зафарбовану сполуку з цими іонами, то при додаванні трилону Б відбудеться зміна кольору в точці еквівалентності, тобто коли трилон Б зв'яже іони кальцію і магнію в міцний комплекс. За кількістю доданого розчину трилону Б визначають загальну твердість досліджуваної води.
Визначення загальної твердості води
1. В колбу наливають 100 мл досліджуваної води, додають 5 мл буферного розчину та невелику кількість індикатора хромогену чорного (для приготування індикатору 0,25 г індикатора змішують з 50 г хлориду натрію, попередньо добре розтертого в ступці). Забарвлення розчину - винне.
Приготування буферного розчину: 10 г NН4СІ розчинити в дистильованій воді, додати 50 мл 25 %-го розчину аміаку (NН4ОН) і довести до 500 мл дистильованою водою.
2. У колбу налити 50 мл досліджуваної води та воду титрують 0,05 н. розчином трилону Б до переходу забарвлення в зелено-синє.
3. Розрахунок проводять за формулою:
x мг екв/л = а• 0,05• 1000/V
де а – об’єм розчину трилону Б, використаного на титрування;
V - об'єм досліджуваної води, мл;
0,05 - нормальність розчину трилону Б.