Короткі теоретичні відомості. Екомоніторинг водойм
Лабораторна робота 2
Екомоніторинг водойм
Методи очистки стічних вод від неорганічних забруднювачів
2.1 Мета роботи.Вивчити теоретичні та прикладні основи методів екологічного моніторингу водного басейну та експериментально визначити вміст неорганічних забруднювачів у стічній воді до і після очистки фізико-хімічними методами, а також ступінь очистки води .
Короткі теоретичні відомості
Внаслідок антропогенної діяльності відбувається забруднення гідросфери, класифікувати яке можливо наступним чином.
1 Хімічне – завдяки надходженню в водойми зі стічними водами ШР, як неорганічної так і органічної природи (всього зафіксовано 959 видів ШР).
Основними забруднювачами водойм є:
– СПАР – дуже токсичні речовини, утворюють з важкими металами комплекси з високою константою стійкості, які дуже важко зруйнувати при очистці води;
– пестициди – хімічні засоби захисту рослин (поділяють: за призначенням – гербіциди (боротьба з бур’янами), інсектициди (з шкідливими комахами), фунгіциди (з грибковими, плісенню); за хімічним складом: хлорорганічні (розчиняються в жировій тканині), фосфорорганічні (руйнують ЦНС), ртутьвмісні (руйнація клітин головного мозку); за токсичністю: сильнодіючі, високотоксичні, середньотоксичні, малотоксичні);
– нафта та нафтопродукти – 1 крапля дає плівку на поверхні води 1 м2 (1т–12км2), ця плівка не пропускає кисню, гине все живе;
– катіони – Pb2+ (порушення роботи ЦНС, хронічні захворювання мозку, канцероген. мутаген), Zn2+ (рак шлунку), Mо2+ (рак стравоходу), Mn2+ (анемія, ЦНС), Sr2+ (рахіт);
– аніони – Cl–, SO42–, NO3– (NO3– відновлюється в організмі до нітриту, який утворює комплексні сполуки з гемоглобіном крові, нездатні переносити кисень як і СО), крім того NO2– – канцероген, F– (карієс, руйнація зубів);
– гази – NH3, H2S (клітинна та ферментна отрута), наявність H2S, NH3 у воді свідчить про загнивання, таку воду не можна пити, Cl2 (захворювання сердцевосудинної системи та ЦНС, канцероген, зниження пам’яті. прогресуюча недоумкуватість).
2 Фізичне – пов’язане зі зміною фізичних властивостей води (температура, прозорість, вміст суспензій та інших нерозчинних компонентів, радіоактивних речовин. В р. Десна спостерігається перевищення вмісту радіонуклідів в 10-100 разів за норму.
3 Біологічне – виникає при надходженні до водойм різних видів рослин, тварин, мікроорганізмів, яких раніше тут не існувало. Перше місце по біологічному забрудненню займають комунально-побутові стоки.
Основними джерелами забруднення водойм є:
– стічні води промислових підприємств;
– стоки сільського господарства;
– стічні води судів морського та річного транспорту;
– поверхневий сток з урбанізованих територій;
– побутові стічні води.
Згідно з класифікацією, запропонованою Л. А. Кульським, забруднюючі речовини за їх фазово-дисперсним станом і відношенням до дисперсійного середовища поділяють на чотири групи. Домішки перших двох груп (крім високомолекулярних сполук) утворюють термодинамічно нестійкі гетерогенні системи, а двох інших – термодинамічне рівноважні оборотні гомогенні системи.
До першої групи належать нерозчинні у воді зависі (суспензії – глина у воді і т. і., емульсії – масла у воді), а також бактерії та планктон. Розмір їх часточок становить 10–3–10–7 м (>100 нм). Вони кінетично нестійкі і підтримуються у завислому стані динамічними силами водяного потоку. В стані спокою зависі осідають. Але бувають і стійкі суспензії. емульсії, що довго не руйнуються.
Друга група домішок поєднує гідрофільні й гідрофобні мінеральні та органо-мінеральні колоїдні часточки ґрунтів, недисоційовані і нерозчинні форми високомолекулярних гумусових речовин, детергенти та інші речовини. До цієї групи належать також віруси і мікроорганізми, які за своїми розмірами близькі до колоїдних часточок. Розміри дисперсних часток знаходяться в межах 10–7—10–9 м (1...100 нм). Кінетична стійкість гідрофобних домішок характеризується співвідношенням сил гравітаційного поля і броунівського руху. Агрегативна стійкість їх зумовлена електростатичним станом міжфазної поверхні і утворенням на поверхні частинок стабілізувальних шарів (гідратних оболонок, адсорбованих катіонів і аніонів). Сюди ж відносяться високомолекулярні сполуки.
Третя група забруднювальних домішок включає молекулярно-розчинні сполуки розміром менш ніж 10–9 м (<1 нм). До неї відносять розчинені гази, органічні речовини біологічного походження та інші домішки, що можуть міститися в складі промислових і господарсько-побутових стоків (частіше – низькомолекулярні сполуки органічної природи). У водному середовищі можливий перебіг двох процесів: сполучення різнорідних молекул з Н2О (гідратація) і сполучення однорідних молекул (асоціація). Молекулярно-розчинні речовини здатні за рахунок водневих зв'язків утворювати з водою неміцні сполуки, що існують лише в розчині. Велике значення ці зв'язки мають також при асоціації молекул розчиненої речовини. Необхідною умовою їх виникнення є достатня полярність валентних зв'язків у вихідних речовин.
До четвертої групи забруднювальних домішок належать електроліти – речовини з іонним або сильно полярним ковалентним зв'язком, які під впливом полярних молекул води дисоціюють на іони. Кристалічні структури цих речовин руйнуються переважно в результаті процесу гідратації.
Санітарні умови за вмістом забруднювачів відповідають нормі, якщо виконується умова:
SСі/ГДКі ≤1 (2.1)
де Сі – фактичні концентрації і-тої ШР у воді, мг/л, ГДКі – ГДК і-тої речовини, мг/л, n =3 (для водойм І та ІІ категорій), n =5 (для водойм ІІІ та ІV категорій).
Для кожного джерела забруднення встановлюється гранично допустимий скид (ГДС), г/с. ГДС — це маса забруднень у стічних водах, допустима для відведення з установленим режимом у певному пункті водного об'єкта за одиницю часу, з метою забезпечення норм якості води в контрольному пункті.
ГДС=Сm·q, г/с (2.2)
де Сm– максимально допустима концентрація ШР у стічній воді, г/л;
q – витрати стічної води, м3/с.
Сучасний рівень розвитку промисловості і техніки потребує використання методів аналізу, які дозволяють визначати мікрокількості (до 10-7 %) різних речовин.
З цією метою широке використання отримали оптичні методи аналізу, засновані на взаємодії променевої енергії з речовиною, яка аналізується . За характером взаємодії променевої енергії і способу її зміни розрізняють :
1) абсорбційний аналіз, тобто аналіз на поглинання світла речовиною, яка визначається у видимій, ультрафіолетовій та інфрачервоній областях спектру (спектрофотометрія, фотоколориметрія);
2) аналіз на поглинання і розсіювання променевої енергії зваженими частинками речовини, яка визначається (турбідиметрія, нефелометрія);
3) флюорометричний (люмінесцентний) аналіз, заснований на вимірюванні вторинного випромінювання, яке виникає в результаті взаємодії променевої енергії з речовиною, яка визначається .
Суть фотоколориметричного методу аналізу. В фотометричних методах аналізу вимірюють поглинання світла речовиною, яку аналізують після введення в розчин реактиву, який реагує з компонентом, що визначається в стічній воді, з утворенням сполук з інтенсивним забарвленням.
Будь-яка речовина відбиває і поглинає електромагнітне випромінювання. Речовини, які поглинають промені довжиною хвиль від 400 до 760 нм (видиме світло), забарвлені.
Характер і величина поглинання і відбивання світла залежить від природи речовини і його концентрації в суміші.
У відповідності до основного закону світлопоглинання – закон (Бугера–Ламберта–Бера, який покладений в основі більшості фотометричних методів аналізу), між поглинанням випромінювання розчином і концентрацією в ньому речовини, що поглинає (С) існує відношення :
І = І0*10-e×L×C ( 2.3 )
де С – концентрація речовини, яка поглинає світло, моль/л.
L – товщина шару розчину, що поглинає світло, см.
e – молярний коефіцієнт.
Величина e показує індивідуальні властивості речовини, змінюючись із зміною довжини хвилі потоку і температури розчину.
Поглинання випромінювання можливо характеризувати величиною оптичної густини D :
D = - lgT (2.4)
D = lg 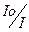 (2.5)
(2.5)
Величина D може приймати будь-які позитивні значення (від 0 до ¥), проте сучасні пристрої дозволяють вимірювати величини оптичної густини, не більше 2. Якщо врахувати рівняння (2.3), то можливо отримати рівняння:
D = e×L×C (2. 6)
з якого виходить, що якщо світлофільтр для дослідженого розчину не суперечить закону Бугера–Ламберта–Бера, то оптична густина розчину прямо-пропорційна концентрації речовини в розчині. В цьому випадку графік залежності оптичної густини D від концентрації С є прямою лінією, яка починає рух від початку координат.
Методи визначення концентрації розчину.
Існує декілька методів визначення концентрації речовини на основі вимірювання оптичної густини D.
Метод розрахунку.
Оснований на використанні основного закону світлопоглинання.
При відомій товщині шару розчину L і коефіцієнта e, концентрація розчину, що аналізується Сx розраховується після вимірювання оптичної густини за формулою :
Сx = D/(e·L) (2.7)
.Коагуляцію застосовують для видалення зі стічних вод найдрібніших колоїднодисперсних глинистих часточок, білкових речовин та інших ви-сокомолекулярних сполук. Коагуляцію здійснюють шляхом введення в очищувану воду незначної кількості електролітів — Аl2(SО4)3 , FеSO4 та деяких інших сполук, які називають коагулянтами. Фізико-хімічна суть цього процесу в спрощеному вигляді полягає в тому, що коагулянт, гід-ролізуючись, утворює позитивно заряджені аквагідроксокомплекси алюмінію та заліза, які адсорбуються на поверхні негативно заряджених колоїдних домішок і нейтралізують їхній заряд. Чим більший заряд аквагідроксо-комплексів, утворених під час гідролізу коагулянтів, тим менші їх витрати на коагуляцію. В результаті збільшення розмірів часточок під час адсорбції вони осідають у відстійниках під дією сили гравітації. Одночасно йде процес адсорбції на поверхні осаду домішок органічних забарвлених речовин, внаслідок чого вода знебарвлюється.
Адсорбцію застосовують переважно для видалення з води органічних сполук (докладніше дивись лабораторну роботу 3).
Хімічні методи очищення ґрунтуються на проведенні різноманітних хімічних реакцій, які нейтралізують токсичні речовини, руйнують їх, переводять у газоподібний стан або осад. Наприклад, кислі стічні води металургійних та інших заводів нейтралізують, обробляючи вапном або фільтруючи через вапняк (СаСО3), магнезит (MgCO3), доломит (MgCO3×СаСО3) – так звана “суха” нейтралізація. За допомогою хімічних методів здійснюють пом'якшення води з видаленням солей твердості содово-вапняковим та фосфатним методами, видалення кольорових і важких металів, силіцію, заліза, магнію та ін. Щоб хімічні методи були рентабельні, треба додержувати двох головних умов: 1) зменшувати об'єми очищуваної води, збільшуючи за рахунок цього концентрації забруднюючих речовин; 2) утилізувати виділені сполуки.
Процес очистки води, що полягає у застосування явища “осмос” – це проникнення молекул розчинника в розчин неелектроліту (електроліту) під дією осматичного тиску (p). Осмотичний тиск розчинів навіть у разі невисокої мінералізації досить значний. Так, для морської води з вмістом солі 3,5 % він становить 2,5 МПа (рис. 2.8 а,б). Якщо прикласти (рис. 2.8 в) гідростатичний тиск р, який більше p , то відбувається зворотній осмос: розчинник просочується із забрудненого електроліта через мембрану в судину чистої води. Робочий тиск в установках для опріснення визначається вмістом солей у розчинах і для морської води його підтримують у межах 4-5 МПа. Зворотній осмос застосовують для стічних вод з вмістом солей 20-3
Іонообмінний метод очистки стічних вод ґрунтується на використанні іонообмінних смол. Він перспективний, але поки що відносно дорогий і застосовується в тих випадках, коли потрібне тонка очистка води. Іонообмінний метод забезпечує практично повне очищення води, яке не потребує ніякого додаткового. Цей метод використовується для добування із стічних вод золота, срібла, платини, міді, хрому, молібдену, ванадію, нікелю, кобальту, заліза, фенолу, радіоактивних та деяких інших речовин. Процес проводять в іонітових фільтрах (докладно дивись лабораторну роботу 5).
Електроліз звичайно використовують для вилучення із стічних вод цінних металів: міді, хрому тощо. Застовувати цей метод для добування вільних металів доцільно тільки при досить високій концентрації іонів. Електролітичний метод використовується також для очищення, стічних вод від ціаністих сполук, які на аноді окиснюються, а потім гідролізуються до карбонатів – аніонів (СО3–) і катіону амонію (NH4+). Ефективно очищуються хромвмісні стічні води за допомогою електролізу з залізними електродами. При цьому можливі два варіанти. У лужному середовищі іони заліза (ІІ), що виділяються з розчинного аноду, відновлюють хромати у хроміти (тетрагідроксохромати – ІІІ) й утворюють нерозчинний осад хроміту заліза: Fe(CrO2)2 (чи Fe[Cr(OH)4]2), який вилучається механічним способом. У кислому середовищі залізо (ІІ) відновлює шестивалентний хром до тривалентного, який при нейтралізації розчину лугом вилучається у вигляді осаду гідроксиду хрому (ІІІ) (докладно дивись лабораторну роботу 4).
Термічний метод очищення полягає в спалюванні токсичних органічних речовин, що містяться в стічних водах, у присутності кисню повітря (докладно дивись лабораторну роботу 3).
Останнім часом для очищення стічних вод використовується також озонування. Озон - сильний окисник, і його легко добути на місці в озонаторах з кисню повітря. Перспективним в, наприклад, процес очищення стічних вод від тетраетилсвинцю окисненням його озоном до металічного свинцю на поверхні каталізатора - силікагелю. Озонування застосовується також для очищення та знезаражування питної води замість хлорування. Вода при цьому виходить прозора, без смаку й запаху, властивих воді водойм.
Магнітна обробка та радіоопромінення використовується для зміни фізичних властивостей води (накип не осаджується на поверхні апарату, а утворюється в об’ємі води, а потім осаджується).
Екстракція застосовується для вилучення із стічних вод фенолів, жирних кислот та інших речовин за допомогою обробки їх різними органічними розчинниками, які не змішуються з водою, наприклад бензолом, бутилацетатом та ін. Речовини, що містяться в стічних водах, переходять в екстрагент, який відокремлюється відстоюванням. Потім екстрагент відганяється і повертається у виробництво (дивись лабораторну роботу 3).
Аерація проводиться в основному з метою збільшення вмісту кисню у воді перед біохімічними методами очистки.
Дистиляція проводиться з метою отримання знесоленої води.
Біохімічні методи очищення стічних вод застосовуються для повного вилучення з них органічних речовин. Біохімічні методи очищення застосовуються на підприємствах харчової промисловості, заводах, що виробляють синтетичний каучук, віскозний шовк і після міських очисних споруд.
Методи біохімічного очищення грунтуються на використанні діяльності різних мікроорганізмів. Серед них розрізняють аеробний процес, який здійснюється в присутності кисню, й анаеробний - без доступу кисню.
Експериментальна частина
Використовується реакція шонів міді з розчином аміаку, при цьому утворюються коплексні іони синього кольору:
Cu^2+4NH3=[Cu(NH3)4]^2+
Визначення проводять до і після очистки. Очистку проводять пропускаючи пробу стічної води через колонку з катіонами.Для визначення в мірну колбу ємність 50 мл відбирають піпеткою 10 мл обраної води, нейтралізують розчином аміаку. Доводять дистильованою водою до мітки, ретельно перемішують. Вимірюють густину.
| До очистки | Після очистки |
| D=0.23 | D1=0.0035 |
| C=2.2 | C2=0.7 |
2.4 Висновок:Експериментально встановлена концентрація неорганічних забруднювачів в воді :
до очистки Cu2+ 2.2 мг/л; ГДКв = 1 мг/л
після очистки
Cu2+ -0.7 мг/л;
Концентрація забруднювача знаходиться в допустимих межах.
Ступінь очистки води : η = [(2.2 – 0.7)/2.2]·100 %
від Cu2+ - 68 % .