Тема: Біогенні s – елементи
МОЗ України
ВНКЗ ЛОР «Львівський медичний коледж ім. Андрея Крупинського»
МЕДична хімія
(БІОНЕОРГАНІЧНА ХІМІЯ)
Методичні рекомендації до практичних занять
для студентів спеціальності 5.12010102
« Сестринська справа »

Львів 2015
Методичні рекомендаціїскладено
викладачем - методистом вищої кваліфікаційної категорії ВНКЗ ЛОР «ЛМК ім. Андрея Крупинського» Сташків О.Д.
Розглянуто і схвалено на засіданні кафедри
фундаментальних дисциплін
Протокол №1 від 28.08. 2015 р.
Рецензент:
Викладач вищої кваліфікаційної категорії,
викладач – методист ВНКЗ ЛОР «ЛМК ім. Андрея Крупинського», канд. пед. наук
Мазепа Х.П.
Під загальною редакцієюдиректора ВНКЗ ЛОР «ЛМК ім. Андрея Крупинського»,
Заслуженого лікаря України, професора, доктора медичних наук Шегедин М.Б.
Вступ
Біонеорганічна хімія – це наука про роль йонів металів та їх сполук з білками, нуклеїновими кислотами, ліпідами та деякими низькомолекулярними природними речовинами в життєдіяльності організмів. Ця наука, моделюючи процеси у клітинах живого організму, допомагає фармації і медицині у створенні нових, більш ефективних медичних препаратів, які використовують для лікування різних хвороб.
У методичних рекомендаціях систематизовано матеріал з найважливіших теоретичних питань біонеорганічної хімії, який дозволить студентам застосувати його для розкриття суті фізико – хімічних процесів, що відбуваються в живому організмі. Це сприятиме кращому засвоєнню студентами інших теоретичних та клінічних дисциплін, формуванню у них наукового мислення.
Розглядаються загальні поняття про біогенні елементи, їх вміст в організмі, положення у періодичній системі та основні фізико – хімічні параметри, якими вони характеризуються. Цей матеріал необхідний студентам для глибшого розуміння хімічних властивостей біогенних елементів, їх ролі у життєдіяльності організму та застосуванні сполук хімічних елементів у медичній практиці.
Подаються способи одержання, номенклатура, будова та властивості комплексних сполук, їх біологічна функція та застосування у медицині, а також суть метало – лігандного гомеостазу.
Оскільки більшість фізіологічних рідин є розчинами електролітів, то для розуміння багатьох біохімічних та фізіологічних процесів необхідно знати закономірності, яким вони підлягають, розуміти хімічну суть процесів дисоціації, протолізу, гідролізу, утворення і розчинення осадів, склад і механізм дії буферних систем.
У методичних рекомендаціях подано контрольні запитання та завдання, тестові завдання, питання для підсумкового модульного контролю.
Практичне заняття
Тема: Біогенні s – елементи
Мета:розглянути електронну структуру й електронегативність біогенних s – елементів, їх хімічні властивості та якісні реакції катіонів; засвоїти біологічну роль s – біоелементів і застосування їх сполук в медичній практиці.
Забезпечення заняття: періодична система хімічних елементів Д.І.Менделєєва; таблиця розчинності кислот, основ і солей у воді; електрохімічний ряд напруг металів; розчини NaCl, KCl, MgCl2, CaCl2, NaOH, HCl; штатив з пробірками, платинова дротина, газовий пальник.
Конкретні цілі:
- знати електронну структуру та електронегативність біогенних s – елементів;
- знати типові хімічні властивості s – елементів та їх сполук;
- складати рівняння реакцій, що відображають типові хімічні властивості s – елементів та їх сполук;
- встановлювати зв’язок між місцезнаходженням біогенних s – елементів в періодичній системі та їх вмістом в організмі;
- проводити якісні реакції, характерні для катіонів біогенних s – елементів;
- знати біологічну роль та медичне застосування сполук біогенних s – елементів;
- трактувати взаємозв’язок між біологічною роллю біогенних s – елементів та формою знаходження їх в організмі.
Зміст заняття
Залежно від властивостей, походження і поширеності в природі хімічні елементи поділяють на різні групи.
За хімічними властивостями розрізняють метали і неметали.
За будовою верхнього енергетичного рівня і подібними хімічними властивостями елементи поділяють на чотири блоки: s – елементи (елементи головної підгрупи І, ІІ групи), р – елементи (елементи головних підгруп ІІІ-VIII групи), d – елементи (елементи побічних підгруп І-VIII групи) та f – елементи (лантаноїди та актиноїди).
Хімічні елементи, необхідні для побудови та життєдіяльності клітин організму тварин і людини, називаютьбіоелементами. їх поділяють на біоме- тали, або «метали життя», - Са, К, Na, Mg, Fe, Zn, Cu, Co, Mn, Mo, органогенні елементи (О, C, H, N, P, S) та інші життєво необхідні елементи (СІ, І, В, Se, Si, Ва, V, Ті та ін.). Вони містяться у повітрі, воді, різноманітних продуктах харчування і потрапляють до організму в процесі дихання, пиття, споживання їжі тощо. Біогенні елементи є важливими хімічними складовими різних систем живого організму - усіх тканин, фізіологічних рідин (плазма крові, спинномозкова рідина, лімфа тощо).
За фізіологічною дією на живі організми елементи поділяють на необхідні, нейтральні та токсичні.
У живих організмах тварин та людини за допомогою різних хімічних та фізико-хімічних методів виявлено 80 хімічних елементів. Серед них є 20 незамінних елементів, які постійно містяться в організмі і входять до складу білків, ферментів, вітамінів, гормонів, нуклеїнових кислот. З неметалів сюди входять – C, H, O, N, P, S, Cl, I, Se, а з групи металів – Na, K, Ca, Zn, Cu, Mg, Fe, Co, Mn, V, Mо.
Основою для вивчення властивостей хімічних елементів, їх біологічної ролі є періодичний закон Д.І.Менделєєва: властивості хімічних елементів, а також форми і властивості їх сполук перебувають у періодичній залежності від заряду ядер атомів. У періодичній системі хімічних елементів сконцентровані і систематизовані численні хімічні факти, на основі яких можна зробити такі висновки:
1. Періодичність зумовлена повторенням електронних конфігурацій атомів (повторенням у розміщенні електронів навколо ядра при збільшенні зарядів ядер від 1 до 8 у малих періодах і від 1 до18 у великих періодах).
2. Порядковий номер елемента вказує на заряд ядра Z і кількість електронів, які знаходяться навколо ядра.
3. Положення елемента в періоді вказує на кількість енергетичних рівнів електронів.
4. Номер групи як правило вказує на найвищу валентність елемента, тобто на кількість електронів у збудженому стані.
5. Металічні властивості виявляють елементи з малою кількістю електронів на верхньому енергетичному рівні. Неметалічними властивостями характеризуються елементи з великою кількістю валентних електронів.
6. Металічні властивості посилюються зверху вниз і справа наліво, а неметалічні – зліва направо і знизу догори.
7. Приблизно по діагоналі (від Берилію до Бору) розміщені елементи, які виявляють амфотерні властивості. Це вказує на те, що поділ на метали і неметали є умовним.
Під електронною структурою атома розуміють розподіл електронів навколо ядра по енергетичних рівнях і підрівнях. Електронні формули складають за певними правилами:
а). Найстійкішому стану електронів в атомі відповідає мінімальна енергія, тобто електрони розміщуються на найближчих до ядра енергетичних рівнях (принцип мінімуму енергії).
б). В атомі не може бути електронів з однаковим значенням усіх квантових чисел (принцип Паулі). Максимальне число електронів N на енергетичному рівні n визначають за формулою:
N=2n2.
Отже, на s -, p-, d-, f- підрівнях число електронів відповідно дорівнює: 2, 6, 10, 14.
в). Послідовне заповнення атомних орбіталей (АО) при збільшенні заряду ядра атома відбувається за зростанням суми головного n і орбітального l квантових чисел. За однакових значень суми цих чисел (n+l) заповнення АО відбувається в порядку зростання головного квантового числа n (правило Клечковського).
У багатоелектронних атомах заповнення електронами енергетичних рівнів і підрівнів для елементів І-VI періодів відбувається в такій послідовності:
1s1-2→2s1-2 →2p1-6→3s1-2→3p1-6→4s1-2→3d1-10→4p1-6→5s1-2→4d1-10→5p1-6→
6s1-2→5d1→4f1-14→5d2-10…
г). Заповнення електронами еквівалентних орбіталей відбувається згідно з принципом Гунда: сумарне спінове число електронів певного підрівня повинно бути максимальним. Наприклад, при заповненні рівноцінних за енергією р – орбіталей електрони розміщуються на кожній орбіталі, тобто заповнюються усі вільні АО, як показано на схемі:
| ↑ | ↑ | ↑ |
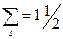
Елементи, в яких останніми заповнюються s – орбіталі, називають s- елементами. До них належать елементи І і ІІ групи головної підгрупи. До біогенних s- елементів відносять – K, Na, Mg, Ca. Загальна електронна формула зовнішнього енергетичного рівня цих елементів ns1 або ns2. Наприклад, атом Кальцію має таку електронну структуру:
+20Ca 1s22s22p63s23p64s2
Біометали із родини s – елементів відносять до неперехідних елементів (з постійною валентністю). Вони завжди містяться в організмі людини у макрокількостях і тому є життєво необхідними.
Атоми s – елементів легко віддають свої валентні електрони, виявляючи сильні відновні властивості, і перетворюються у позитивно заряджені йони:
Na – 1e → Na+
Реагують з такими простими речовинами, як кисень, галогени, водень, сірка, фосфор, вуглець, азот та ін., наприклад:
2Na+Cl2 =2NaCl
ЗСа+2Р = Са3Р2
При взаємодії з киснем тільки літій утворює оксид Li2О, а всі інші лужні метали - пероксиди або надпероксиди (супероксиди), що відповідають формуламМе2О2 іMeО2.
Оксиди лужних і лужноземельних металів мають високу реакційну здатність, енергійно реагують з водою, утворюючи гідроксиди:
Ме2О+Н2О = 2МеОН; МеО+Н2О = Ме(ОН)2.
Гідроксиди лужних металів - безбарвні, тверді, легкоплавкі й дуже гігроскопічні речовини. Це типові йонні сполуки, у водних розчинах вони повністю дисоціюють на катіони металуМе+ та аніони гідроксильної групи ОН-і тому належать до найсильніших основ, які називаютьлугами. Розчини гідроксидів у воді агресивні щодо багатьох речовин, тому їх ще називаютьїдкими лугами.
s-Елементи вступають у реакції і з багатьма складними речовинами: водою, кислотами-неокисниками (НС1, H2SО4(poзб), Н3РО4) та кислотами-окисниками H2SО4(конц), HNО3), наприклад:
2К+2Н2О = 2КОН+Н2 ; Са+2НС1 = СаС12 + Н2 ; 8Na+5H2SО4(конц) = 4Na2SО4 +H2S+4H2О; 8Na+10HNО3(poз6) =8NaNО3 +NH4NО3 +3H2О.
Унаслідок цих реакцій утворюються гідроксиди або солі відповідного металу. Переважна більшість солей лужних металів легко розчиняється у воді, оскільки є кристалічними речовинами йонної будови.
Переважно у йонному стані ці елементи містяться у живих організмах.
Натрій і Калій – дуже важливі елементи, які є у плазмі крові, лімфі, шлунковому соці. Найбільше Калію в печінці, нирках, серці, м’язах та мозку. Загальний вміст К в організмі дещо більший, ніж Na. Йони Натрію є основними позаклітинними йонами, а Калію – внутрішньоклітинними. Основна біологічна роль цих йонів полягає у підтриманні водно – електролітного балансу, осмотичного тиску, кислотності біорідин. Вони необхідні для генерування біопотенціалів у нервовій системі та для регулювання роботи серцевого м’яза. Встановлено, що йони Натрію сприяють скороченню м’язів, а Калію, навпаки, розслабленню. Натрій хлорид, який поступає в організм з їжею, є джерелом хлоридної кислоти для утворення шлункового соку, а натрій гідрогенкарбонат – є важливим компонентом буферної суміші, яка підтримує кислотно – основний стан деяких біорідин. Необхідно зазначити, що для функціонування окремих органів, зокрема серця, потрібна не лише певна концентрація йонів Калію, Натрію, Кальцію і Магнію у крові, але і їх точне кількісне співвідношення.
Йони Кальцію постійно містяться в організмі людини в макрокількостях. Вони необхідні для побудови тканин, оскільки мінеральні солі Кальцію є основою кісткової тканини та емалі зубів. У плазмі крові Йони Кальцію перебувають у зв’язаному з білками стані та у вільному вигляді. Вони підтримують нормальну здатність крові до зсідання, виявляють протизапальну дію. Нестача Кальцію в організмі призводить до нервових розладів.
Нагромадження Кальцію в деяких органах призводить утворення каменів, поліартриту, остеохондрозу, катаракти. Добова потреба організму в Кальції становить біля 1г. Вона забезпечується за рахунок рослинної їжі, молока, питної води. Засвоєння Кальцію організмом залежить від наявності вітаміну D, концентрація якого регулюється гормонами щитовидної залози.
Сполуки Магнію містяться у внутрішньоклітинних рідинах, кістках скелету та емалі зубів. В організмі Магній знаходиться у вигляді гідратованих йонів та складних комплексів з нуклеїновими кислотами. Залежно від концентрації, Магній прискорює або гальмує процес передачі імпульсів по нервових волокнах. Він також впливає на дихальні, судинорухові та інші мозкові центри і діє заспокійливо на нервову систему в цілому, сприяє виділенню жовчі, стимулює перистальтику кишок.
З неорганічних речовин здавна використовуються ряд сполук s – елементів в якості лікарських, серед яких виділимо найважливіші:
- препарати Натрію: NaCl застосовується для приготування ізотонічного (0,9%) та гіпертонічного (10%) розчинів; NaHCO3 – для нейтралізації високої кислотності шлункового соку; Na2S2O3∙5H2O – при отруєнні солями важких металів; NaNO2 – як судинорозширюючий засіб при стенокардії та спазмах судин головного мозку.
- препарати Калію: KBr – як заспокійливий засіб; KCl – при серцевих захворюваннях; КІ – для лікування зобу, катаракти; CH3COOK – сечогінний засіб при набряках, викликаних порушенням кровообігу.
- препарати Магнію: MgSO4∙7H2O –як заспокійливий, протисудомний засіб при внутрішньовенному введенні, а при внутрішньому вживанні – як проносний і жовчогінний; тальк 3MgO∙4SiO2∙H2O – для виготовлення різних присипок і мазей; MgO – антацидний та жовчогінний засіб; 4MgCO3∙Mg(OH)2∙H2O використовують як антацидний та послаблювальний засіб.
- препарати Кальцію: CaCl2∙6H2O, кальцій глюконат, кальцій лактат – протизапальні, протиалергічні і кровоспинні засоби.
Завдання для самостійної роботи
1. Виконати якісну реакцію йона Na+.
2. Виконати якісну реакцію йона K+.
3. Виконати якісну реакцію йона Ca2+.
4. Виконати якісну реакцію йона Mg2+.