Дослід 3. Кількісне визначення вмісту йонів Феруму в природній воді
Дослід 2. Якісне визначення деяких сполук у природній воді
Сульфат-іони є одним з головних аніонів і присутні практично у всіх природних водах. Сульфати беруть участь у складному колообігу Сульфуру. При відсутності кисню під впливом сульфатредукуючих бактерій вони відновлюються до сірководню і сульфідів, які при появі у природній воді кисню знову окинюються до сульфатів. Підвищений вміст сульфатів погіршує органолептичні властивості води і має шкідливий фізіологічний вплив на організм людини. ГДК сульфатів – 100-150 мг/л.
Прилади та обладнання: штатив з пробірками, піпетка з дозатором, піпетка, стакан.
Реактиви: 10%-ний розчин барій хлориду.
Приблизний вміст сульфат-іонів може бути визначений візуально за кількістю осаду барій сульфату, що випадає при доливанні в пробірку з 5 мл проби води 3 крапель 10% розчину барій хлориду.
| Вигляд реакційної суміші | Концентрація SO42-, мг/л |
| Відсутність помутніння | менше 5 |
| Слабке помутніння, що з’являється через декілька хвилин | 5-10 |
| Слабке помутніння, що з’являється відразу | 10-100 |
| Сильне помутніння, що швидко осідає | 100-500 |
Хлоридні йони належать до головних йонів хімічного складу природних вод. Концентрація хлоридів у природних водах схильна до сезонних коливань, які корелюють зі зміною мінералізації природних вод. Підвищений вміст хлоридів погіршує смакові якості води і робить їх малопридатними для питного водопостачання, обмежує її застосування для багатьох технічних і господарських цілей, а також для зрошення сільгоспугідь. ГДК хлоридів – 300 мг/л.
Прилади та обладнання: штатив з пробірками, піпетка з дозатором, піпетка.
Реактиви: 10%-ний розчин арґентум нітрату.
При порівняно невеликому вмісті хлорид-іонів про їх кількість можна орієнтовно дізнатися за візуальною оцінкою осаду арґентум хлориду, що випадає при доливанні до 5 мл проби води 3 крапель 10% розчину арґентум нітрату.
| Вигляд реакційної суміші | Концентрація Cl -, мг/л |
| Опалесценція, слабке помутніння | 1-10 |
| Сильне помутніння | 10-50 |
| Пластівці, що не відразу осаджуються | 50-100 |
| Білий об’ємний осад | більше 100 |
Ферум майже завжди присутній в природних водах, так як він розсіяний в гірських породах. Найбільші концентрації Феруму (до декількох десятків і сотень мг/л) спостерігаються у підземних водах. Підвищений вміст Феруму спостерігається також у болотних водах. Вміст Феруму в поверхневих водах суші складає десяті частки мг/л, поблизу боліт – одиниці мг/л. Підвищений вміст Феруму (більше 1 мг/л) погіршує якість води і можливість її використання для питних і технічних цілей. ГДК для Феруму(II) складає 0,5 мг/л, для Феруму(III) – 0,05 мг/л.
Прилади та обладнання: штатив з пробірками, піпетка з дозатором, піпетка, стакан.
Реактиви: нітратна кислота (конц.), 5%-ний розчин гідроген пероксиду, 20%-ний розчин калій роданіду.
Дляприблизного визначення вмісту Феруму відміряють в пробірку 10 мл проби води, додають 1 краплю концентрованої нітратної кислоти, декілька крапель 5% розчину гідроген пероксиду та 0,5 мл 20% розчину калій роданіду. При вмісті Феруму в концентрації близько 0,1 мг/л з'являється рожеве забарвлення розчину, при вищому вмісті – червоне.
Органічні сполуки.
Прилади та обладнання: стаканчик, лійка, фільтрувальний папір, піпетка з дозатором, мірний пальчик.
Реактиви: 30%-ний розчин сульфатної кислоти, 0,01н розчин калій перманганату.
До 3-4 мл попередньо відфільтрованої води додають 0,5 мл 30% розчину сульфатної кислоти та 1 мл 0,01н розчину калій перманганату. Суміш перемішують, зміна кольору рідини буде свідчити про наявність органічних сполук у природній воді.
Дослід 3. Кількісне визначення вмісту йонів Феруму в природній воді
Прилади та обладнання: піпетка з дозатором, циліндр, піпетка, ФЕК, міліметровий папір, електроплитка, термостійка колба, мірна колба на 100 мл, фільтрувальний папір, лійка.
Реактиви:
1. Стандартні розчини ферумамонійних галунів (NH4)Fe(SO4)2∙12H2O: а) основний розчин – 0,100 мг Fe/л: 0,8634 г солі розчиняють в 2 мл концентрованої хлоридної кислоти і доводять дистильованою водою до 1 літра; б) робочий розчин – 0,010 мг Fe/л: 50 мл основного розчину розбавляють в колбі на 500 мл.
2. Розчин NH4Cl, 2 н: 107 г солі розчиняють в 1 літрі дистильованої води.
3. Розчин амоніаку NH4ОН, 1: 1.
4. Сульфосаліцилова кислота – 20%.
5. Нітратна кислота, концентрована.
До проби води об'ємом 100 мл додають 0,5 мл концентрованої нітратної кислоти і упарюють. Розчин фільтрують в мірну колбу на 100 мл. Фільтр промивають, а фільтрат розбавляють дистильованою водою. Загальний об’єм фільтрату і промивних вод не повинен перевищувати 90 мл. Потім додають 2 мл розчину амоній хлориду (2н), 2 мл 20%-го розчину сульфосаліцилової кислоти і 2 мл розчину амоніаку (1:1). Об'єм доводять до 100 мл, перемішують і через 5 хвилин вимірюють оптичну густину при довжині хвилі 400-430 нм і кюветі 2 см. За градуювальним графіком знаходять вміст Феруму.
Побудова градуювальної кривої: в ряд склянок наливають 0, 1, 2, 4, 10, 20, 40, 60, 80, 100 мл робочого стандартного розчину (0,01 мг Fe/л). Об’єми розчинів доводять дистильованою водою приблизно до 90 мл, що відповідає концентраціям 0; 0,01; 0,02; 0,04; 0,1, 0,2, 0,4, 0,6, 0,8, 1 мг Fe.
Концентрацію Феруму, мг/л (Сх), обчислють за формулою
Сх = 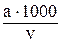 , де
, де
а – кількість Феруму, знайдена за градуювальним графіком, мг;
v – об’єм проби, мл.