Физические свойства и строение
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Схема лекции.
1. Нитросоединения
1.1. Классификация, номенклатура, изомерия.
1.2. Способы получения
1.3. Физические свойства и строение.
1.4. Химические свойства
2. Амины
2.1. Классификация, номенклатура, изомерия.
2.2. Способы получения
2.3. Физические свойства и строение.
2.4. Химические свойства
3. Диазо- и азосоединения
3.1. Реакции, протекающие с выделением азота
3.2. Реакции, протекающие без выделением азота
НИТРОСОЕДИНЕНИЯ
Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу – называются нитросоединениями.
Классификация, номенклатура, изомерия.
Возможны: изомерия положения нитрогруппы и формы изомерии, связанные со строением остального фрагмента молекулы нитпросоединения.
В зависимости от типа углеродного атома, с которым связана нитрогруппа, различают первичные, вторичные и третичные нитросоединения.
В зависимости от строения углеводородного радикала, с которым соединена нитрогруппа различают нитроалканы. нитроциклоалканы и нитроарены.
Действуют три номенклатуры. Тривиальные названия, например, пикриновая кислота, нитробензол. Название по рациональной номеклатуре может быть построено как производное нитрометана, а также от названий углеводорода с добавкой префикса «нитро». По систематической номенклатуре цифрой указывается положение нитрогруппы. В иерархии заместителей нитрогруппа предшествует галогенам. Например:
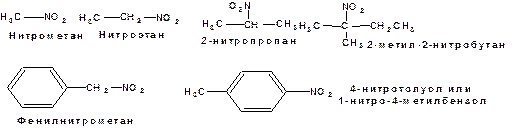
Способы получения.
Самостоятельно рассмотреть способы получения:
Нитрованием алканов в газовой и жидкой фазе;
Нитрованием ароматических соединений
Учесть в каких случаях используют:
нитрующую смесь азотной и серной кислоты, концентрированную азотную кислоту, разбавленную азотную кислоту, смесь азотной и уксусной кислот, ацетилнитрат, а также влияние температуры.
Физические свойства и строение.
Нитроалканы представляют собой бесцветные жидкости с высокими температурами кипения. Нитроалкены и нитроарены – жидкие или твердые вещества желтоватого цвета. Имеют острый запах и являются высокотоксичными.
В нитрогруппе оба атома кислорода находятся на равном расстоянии от атома азота, а угол О-N-О равен 1200. Равноценность атомов кислорода иллюстрируют резонансные структуры:
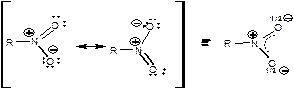
Наличие положительного заряда на атоме азота определяет высокие электроноакцепторные свойства нитрогруппы. В зависимости от радикала, соединенного с нитрогруппой. Последняя способна проявлять отрицательные индуктивный и мезомерный эыффекты, по отдельности и одновременно. Как следствие нитросоединения способны присоединять электрон. Кроме того, высокие акцепторные свойства обуславливают характер С-Н кислоты и замещение водорода у α-углеродного атома.
Химические свойства
Самостоятельно разобрать вопросы реакций электрофильного и нуклеофильного замещения в ароматических нитросоединениях, влияния нитрогруппы на кислотные свойства фенола и устойчивость карбоксильной группы в нитробензойных кислотах. Какая особенность в свойствах тринитротолуола?