Особенности адсорбции ионов и молекул из растворов на твердой поверхности
Билет №1
Конденсационные методы получения лиофобных дисперсных систем.
К лиофобным относятся колл. системы, в которых частицы ДФ слабо взаимодействуют с ДС. Эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Методы получения колл. растворов можно разделить на две группы: методы конденсации и диспергирования (в отд. группу выделяется метод пептизации).
Конденсация – метод получения дисп. систем, в основе которого лежит процесс укрупнения мельчайших частиц ДФ (молекулярных размеров) до частиц с размерами определённого класса дисп. систем.
В-во, находящееся в молекулярно-дисп. состоянии, можно перевести в колл. состояние при замене одного растворителя другим – т.н. методом замены растворителя.
Пример: Канифоль не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется гидрозоль канифоли.
Колл. растворы можно получать также и методом химической конденсации, основанном на проведении хим. реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом:
NaAuO2 + HCOH + Na2CO3 → Au(колл.) + HCOONa + H2O
Золи могут быть получены по реакциям ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор. Так можно получить золь AgI:
AgNO3 + KI → AgI(золь) + KNO3
Процесс гидролиза различных солей может приводить к образованию коллоидных растворов нерастворимых гидроксидов или кислот. Так получают, например, золь гидроксида железа(III), имеющий следующее строение:
FeCl3 + H2O → {[Fe(OH)3]m · n FeO+ · (n–x)Cl–}x+ · x Cl–
Также лиофобных дисп. системы могут образовываться путём конденсации пересыщенного пара.
Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
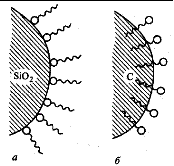
В зависимости от вида адсорбируемых частиц различают молекулярную и ионную адсорбции.
 Ребиндером был сформулирован ряд закономерностей:
Ребиндером был сформулирован ряд закономерностей:
· В системе полярный адсорбент – неполярный растворитель амфифильные молекулы ориентируются полярной головкой к поверхности адсорбента, а неполярным хвостом – к растворителю. В системе неполярный адсорбент–полярный растворитель ориентация, очевидно, обратная.
· На полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей, на неполярных же адсорбентах – неполярные вещества из полярных растворителей.
· Чем лучше в данном растворителе растворяется адсорбат, тем он хуже адсорбируется, и наоборот: чем хуже он растворяется – тем лучше адсорбируется.
· Если происходит адсорбция из разбавленных растворов, то в гомологических рядах она увеличивается с ростом молекулярной массы адсорбата.
· Правило Дюкло – Траубе соблюдается только до определенной длины молекулы, а далее адсорбция может уменьшаться.
· Как правило, с увеличением температуры адсорбция уменьшается за исключением того случая, когда вещество плохо растворяется (с увеличением температуры увеличится растворимость а следовательно, и адсорбция).
· Процесс адсорбции идет в сторону выравнивания полярностей и тем интенсивнее, чем больше разность полярностей – правило уравнивания полярностей Ребиндера. Полярность адсорбата должна быть промежуточной между полярностью среды и адсорбента.
Реология
Реология - это наука, формулирующая правила и законы обобщённого рассмотрения механического поведения твёрдо- и жидкообразных тел. Основным методом реологии является рассмотрение механ. свойств на конкретных идеальных моделях. Объектами реологии являются полимеры (расплавы, р-ры), дисперсные системы (пены, эмульсии, суспензии, порошки, пасты), металлы и сплавы, нефтепродукты и т.д.
Полная реологическая кривая мало концентрированной дисперсной системы с анизометричными частицами:
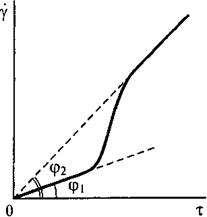 γ – эффективная относительная деформация сдвига
γ – эффективная относительная деформация сдвига
τ – скорость течения (напряжение сдвига)
ηэф = τ/γ
Пояснение: При малых скоростях деформации эффективная вязкость максимальна, затем она постепенно падает до некоторого максимального значения, не изменяющегося при дальнейшем увеличении скорости и соответствующего течению системы с полностью ориентированными в потоке частицами.