Определение среднего радиуса мицелл методом турбидиметрии
Цель работы: Определение среднего радиуса сферических мицелл из измерений мутности растворов олеата натрия (натриевой соли цис-9-октадеценовой кислоты, С17Н33СООNa).
Краткое теоретическое введение
Мицеллами называют коллоидные частицы, образующиеся при агрегации или ассоциации* молекул вещества в растворе. Мицеллы отличаются от частиц типичных лиофобных золей тем, что они построены из отдельных молекул, межмолекулярные связи между которыми значительно слабее, чем химические связи между атомами внутри молекулы, а так же тем, что они находятся в равновесии с молекулами в растворе и образуются самопроизвольно. По последнему признаку их относят к лиофильным коллоидам.
Склонность к мицеллообразованию показывают вещества, молекулы которых являются амфифильными. Этот термин означает, что в структуре одной и той же молекулы имеются как гидрофобные, так и гидрофильные участки или группы атомов. В водном растворе, гидрофильные группы стремятся к межмолекулярным взаимодействиям с растворителем – водой, тогда как гидрофобные участки стремятся к межмолекулярным взаимодействиям между собой или с другими неполярными молекулами (если они присутствуют) во избежание контакта с молекулами полярного растворителя. Эта тенденция служит движущей силой мицеллообразования.
Наиболее хорошо изучены мицеллы, образующиеся в растворах мыл, моющих средств и аналогичных синтетических веществ, а также мицеллы казеина, существующие в молоке. В качестве моющих средств обычно используются вещества, молекулы которых являются дифильными (двух-фильными), то есть состоящими из одной гидрофильной группы и одной протяженной углеводородной цепи, являющейся гидрофобной. Поскольку такие вещества способны адсорбироваться на поверхностях раздела фаз и снижать межфазное натяжение, их называют поверхностно активными веществами (ПАВ). Строение молекулы дифильного ПАВ принято изображать схематически как показано на рис. 7.1 а. Например, в применении к додецилсульфату натрия, С12Н25–О–SO3Na, длинный "хвост" на этом рисунке символизирует углеводородную цепь С12Н25, а круглая "головка" означает анионную сульфатную группу OSO3–. В мицеллах гидрофобные цепи объединены между собой, образуя ядро мицеллы, тогда как гидрофильные группы образуют поверхность, изолирующую гидрофобное ядро от контакта с растворителем.
В водных растворах с невысокой ионной силой мицеллы имеют сферическую форму с радиусом 1-10 нм и содержат обычно 50-100 молекул. На рис. 7.1 б) показан схематический внешний вид, а на рис. 7.2 – модель внутреннего строения сферической мицеллы ионогенного ПАВ, предложенная Хартли (1936 г). Согласно этой модели, углеводородные цепи ассоциированных молекул ориентированы радиально, так что концевые метильные группы СН3 сходятся в центре мицеллы. Совокупность цепей образует ядро мицеллы, не содержащее молекул растворителя, а гидрофильные головки образуют поверхность, заряженную положительно в случае катионактивных ПАВ и отрицательно в случае анионактивных ПАВ.
Согласно теории двойного электрического слоя (ДЭС), противоионы (то есть ионы противоположного знака по отношению к знаку заряда поверхности) должны находиться в слоях раствора, прилегающих к поверхности. Полностью диссоциированные противоионы находятся в тепловом движении в растворе и образуют так называемый диффузный слой, окружающий заряженную частицу подобно ионной атмосфере (этот слой называют также слоем Гуи-Чапмена). Важно заметить, что ионы в диффузном слое окружены гидратными оболочками, как обычно в водном растворе. В зависимости от химических свойств поверхности, часть противоионов может находиться также непосредственно на поверхности – либо из-за способности адсорбироваться на ней специфически, либо из-за её проницаемости по отношению к этим ионам. В любом случае эти ионы частично или полностью теряют гидратную оболочку, так как вступают в непосредственный контакт с веществом поверхности. В теории ДЭС они рассматриваются как находящиеся в слое Штерна, который имеет толщину меньшую чем размер гидратированного противоиона. Если бы все молекулы мицеллы были диссоциированы на ионы полностью и слой Штерна был пуст, поверхность имела бы очень высокий заряд, что противоречило бы экспериментальным данным о сравнительно низкой электрофоретической подвижности мицелл. Поэтому в модели Хартли принято, что от 50 до 70 % заряда мицеллы нейтрализовано противоионами в слое Штерна, причем этот слой образуется из-за проницаемости гидрофильной поверхности по отношению к противоионам, таким как Na+ или К+ в случае анионактивных ПАВ и Cl– или Br– в случае катионактивных ПАВ. Предполагается, что противоионы в слое Штерна находятся приблизительно на одном уровне с заряженными гидрофильными головками.
Поскольку в этой модели гидрофобные цепи вытянуты в радиальном направлении, радиус ядра мицеллы должен быть равен длине углеводородной цепи. Это даёт возможность количественных оценок размера мицелл на основании известных данных о длинах связей. Например, у додецилсульфата натрия, С12Н25ОSO3Na, углеводородная цепь может рассматриваться как последовательность связей Н–(СН2–)12 с длинами С–Н 1.09 Å и С–С 1.54 Å (Å – Ангстрем, см. сноску на стр. ). Если бы 12 связей С–С и одна связь С–Н были расположены на одной прямой, то длина цепи L составляла бы L = 12×1.54 + 1.09 = 19.57 Å (радиус мицеллы Хартли был бы R » 2.0 нм). Однако, поскольку валентные углы ССС и НСС не равны 180°, и поскольку метильные группы в центре ядра должны быть разделены расстоянием межмолекулярного взаимодействия, этот расчёт является неточным. Более точное геометрическое рассмотрение насыщенной углеводородной цепи даёт формулу
L = 1.5 + 1.265×N, [Å] (7.1)
где N – число атомов углерода в цепи. Тогда для додецилсульфата натрия получается L = 16.7 Å (R » 1.7 нм ).
В современной коллоидной химии модель Хартли считается в основном правильной, хотя с помощью физических методов исследований были установлены некоторые детали, не согласующиеся с этой моделью. В частности, установлено что ядро мицеллы имеет однородную плотность, тогда как в классической модели (рис. 7.2) плотность должна быть больше в центре ядра чем на периферии. Поэтому считается, что в действительности углеводородные цепи ориентированы не строго в радиальном направлении, а находятся в беспорядке, как показано схематически на рис. 7.3 а. По крайней мере одна концевая метильная группа должна находиться в центре, благодаря чему вычисления по формуле (7.1) для радиуса мицеллы остаются справедливыми. Фактически, экспериментально измеренные радиусы мицелл в чистых растворах ПАВ составляют 100-150 % от расчётных. В присутствии неполярных веществ радиус сферических мицелл может быть много больше из-за внедрения молекул этих веществ в углеводородные ядра. Благодаря этому неполярные вещества, практически нерастворимые в воде, способны растворяться в растворах коллоидных ПАВ – свойство, которое является важным для моющего действия ПАВ.
Найдено, что мицеллы находятся в динамическом равновесии с раствором. А именно, молекулы мицелл постоянно обмениваются с молекулами в растворе, а углеводородные цепи в ядре находятся в тепловом движении, аналогичном движению молекул в жидком состоянии. Физические свойства ядра – плотность и микроскопическая вязкость, приблизительно такие же, как у соответствующего жидкого углеводорода при данной температуре. Поэтому мицеллярный раствор следует рассматривать скорее как эмульсию, чем суспензию. Из-за теплового движения форма мицеллы претерпевает постоянные флуктуации во времени, так что она является сферической только в среднем, но в каждый момент времени отклоняется от сферической.
Считается, что средняя форма мицеллы зависит от сил электростатического отталкивания между одноименно заряженными головками. Сферическая форма отличается от любой другой тем, что при данном числе агрегации она позволяет головкам находиться на максимальном возможном удалении друг от друга. Иначе говоря, при сферической форме площадь поверхности мицеллы, приходящаяся на одну головку, является максимальной. В случае ионогенных ПАВ, электростатическое отталкивание между головками зависит от ионной силы раствора. При низкой ионной силе оно является максимальным, что заставляет мицеллу иметь сферическую форму. По теории ДЭС, при увеличении ионной силы толщина диффузного слоя уменьшается, ионная атмосфера становится плотней, и доля противоионов, входящих в слой Штерна, растёт. Противоионы в слое Штерна ослабляют (экранируют) отталкивание между одноимённо заряженными головками. Это позволяет мицелле при увеличении ионной силы принимать другие формы, с меньшей площадью поверхности в расчёте на головку, с большим числом агрегации и большим размером в одном или двух измерениях. Согласно экспериментальным исследованиям, сферические мицеллы деформируются и превращаются в цилиндрические или дискообразные при увеличении концентрации ПАВ более 0.1–0.5 моль/л (в зависимости от вида ПАВ), или в присутствии эквивалентной концентрации посторонних сильных электролитов, таких как NaCl, KBr, CaCl2 и т.д. Важной особенностью таких мицелл является то, что их окончания имеют тороидальную (то есть закруглённую) поверхность и что их толщина в одном или двух измерениях всегда приблизительно равна удвоенной длине углеводородной цепи (см. рис. 7.3 б и в), тогда как в другом измерении их размер может быть в десятки раз больше. Такие мицеллы также испытывают флуктуации формы во времени, из-за чего их Броуновское движение аналогично движению гибкоцепных полимеров. В частности, цилиндрическую мицеллу правильнее рассматривать как гибкий "червяк", извивающийся в растворе, а не как жесткий цилиндр.
Приборы и методы измерений
Для определения размеров и формы частиц золей применяются методы рассеяния видимого света, рентгеновского излучения, и нейтронов. При прохождении через неоднородную среду (в частности, через золь), излучение рассеивается на оптических неоднородностях во всех направлениях. Интенсивность рассеянного излучения является сложной функцией угла наблюдения (называемого углом рассеяния), размеров и концентрации частиц, разности оптических свойств вещества частиц и растворителя, и других физических величин. В частных случаях очень малых частиц и низких концентраций золя, для этой функциональной зависимости могут быть получены аналитические решения в явном виде относительно размеров частиц и других параметров, представляющих интерес. Однако в общем случае эта функциональная зависимость не может быть решена аналитически. Поэтому обработка экспериментальных данных в исследовательской практике осуществляется методами численной математики, реализуемыми с помощью компьютера.
В отношении рассеяния света, существуют два основных варианта метода: статическое или классическое рассеяние, разработанное в 40-ые годы Дебаем и усовершенствованное Зиммом, и динамическое рассеяние (называемое также фотонной корреляционной спектроскопией), разработанное в 70-ые годы и получившее распространение в последние 20 лет. В обоих вариантах используются приборы с одной и той же принципиальной схемой (рис. 7.4). Монохроматическое излучение из источника S проходит через коллимационную линзу С, затем через пробу золя Р в цилиндрической или конической ячейке, в результате чего оно частично рассеивается и частично проходит и попадает в ловушку прошедшего излучения Т. Последняя является существенным элементом прибора, так как рассеянное излучение не должно быть загрязнено отражением прошедшей интенсивности. Интенсивность рассеяния измеряется фото-детектором D, который закреплён на специальном устройстве G, называемым гониометром. С помощью гониометра детектор вращается вокруг пробы Р, что позволяет регистрировать интенсивность рассеянного излучения как функцию угла рассеяния. Электрический сигнал из детектора поступает в анализатор А, где он подвергается необходимым преобразованиям, оцифровывается и в заключении обрабатываются микропроцессором.
В варианте статического рассеяния света, из анализа зависимости интенсивности от угла рассеяния и от концентрации получают средневесовую молекулярную массу и средневесовой радиус инерции*, а из анализа степени поляризации рассеянного света получают информацию о форме частиц. Применение более коротковолнового излучения (рентгеновских лучей или нейтронов) позволяет получить аналогичную информацию, но более точную и подробную, а также установить распределение плотности вокруг центра масс частицы и некоторые детали внутреннего строения частиц.
Метод динамического рассеяния основан на флуктуациях интенсивности рассеянного света, которые являются следствием хаотического Броуновского движения частиц. Благодаря Броуновскому движению рассеянный свет модулирован по частоте и поступает в детектор с задержкой во времени, по аналогии с хорошо известным эффектом Доплера. В статическом рассеянии света используются кюветы с относительно большим объёмом пробы, из-за чего детектор получает усреднённый во времени сигнал, не несущий информации о Броуновском движении. В динамическом варианте используются микроскопические кюветы и когерентный свет, что позволяет исследовать флуктуации интенсивности во времени. Импульс света подаётся лазерным источником на пробу, детектор получает сигнал рассеянного света и регистрирует его как функцию времени (при данном угле рассеяния). С помощью Фурье-преобразования анализатор превращает эту функцию в спектр (зависимость интенсивности от частоты или волнового числа). Из спектральной ширины вычисляют коэффициент диффузии D, а из него получают гидродинамический радиус частиц RH с помощью уравнения Стокса-Эйнштейна

Наконец, из анализа зависимости спектральной ширины от угла рассеяния получают распределение частиц по радиусам RH.
Гидродинамический радиус RH отличается от геометрического радиуса сферической частицы на толщину гидратной (или сольватной) оболочки. Этот факт даёт возможность при исследовании одного образца двумя вариантами метода определить как размер "голых" частиц, так и толщину гидратной оболочки.
Современные приборы для подобных исследований являются сложными и дорогостоящими. Поэтому существуют так же другие, более простые модификации, в которых источник излучения и фотодетектор имеют фиксированные положения относительно ячейки с пробой. В методе нефелометрии детектор располагается под некоторым углом к направлению проходящего света. Например, наиболее распространенными в 50-ые и 60-ые годы были нефелометры с так называемыми полуоктаэдрическими кюветами (рис. 7.5). В этой конструкции детектор может быть установлен в трёх положениях, перпендикулярных граням кюветы с углами рассеяния 45°, 90° и 135°. Для более простых исследований, например для установления точки эквивалентности при осадительном титровании в аналитической химии, используются нефелометры с одним фиксированным положением детектора. Фактически, для таких простых измерений может быть использован любой флуориметр, поскольку во флуориметрии всегда применяется треугольное расположение источника, детектора и пробы. (Флуориметры производятся многими фирмами, специлизирующимися на оптическом приборостроении.)
В настоящей работе используется самый простой метод – метод турбидиметрии. В этом методе применяются обычные фотоколориметры, в которых источник, кювета и детектор располагаются на одной прямой. Назначение фотоколориметра – измерение оптической плотности D, которая при поглощении света является относительной логарифмической мерой интенсивности прошедшего через образец света IT:
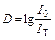 , (7.2)
, (7.2)
где I0 – интенсивность входящего в образец света. Если исследуемый раствор рассеивает свет, а другие потери интенсивности отсутствуют или компенсируются сравнением с оптической плотностью чистого растворителя, то интенсивность прошедшего света IT связана с интегральной интенсивностью рассеянного света IS (то есть света, рассеянного по всему пространству вокруг пробы):
IT = I0 – IS (7.3)
откуда следует:
 (7.4)
(7.4)
Интенсивность рассеянного света связана с размерами рассеивающих частиц и их концентрацией. В случае бесконечно разбавленных монодисперсных золей со сферическими частицами, радиус которых много меньше длины волны света, эта связь даётся сравнительно простым уравнением Рэлея:
is= Iо×K×V2×n , (7.5)
в котором V – объём единичной частицы, n - число частиц в единице объёма золя, то есть численная концентрация, К – оптическая постоянная золя:
 , (7.6)
, (7.6)
где n0 и n1 – показатели преломления растворителя и вещества дисперсной фазы, соответственно; l0 - длина волны света в растворителе (которая, как известно, связана с длиной волны света в вакууме, l, соотношением l0 = l/n0 ).
В уравнении (7.5) is– это интегральная интенсивность, рассеянная единицей объёма среды, и имеющая единицу измерения обратную длине, то есть м–1 в основных единицах СИ. Количество единиц объёма, через которые проходит свет в кювете фотоколориметра, пропорционально длине оптического пути в кювете. Если последнюю обозначить l, то уравнение Рэлея для полной интенсивности рассеяния будет иметь вид
Is = Iо×K×V2×n× l (7.5а)
С помощью уравнений (7.5а) и (7.4) оптическая плотность может быть представлена как функция объёма единичной частицы золя и концентрации. Эта функция значительно упрощается, если уравнение (7.4) для оптической плотности преобразовать к виду:

в котором последнее выражение можно разложить в степенной ряд:

Поскольку уравнение Рэлея справедливо для бесконечно разбавленных золей, измерения должны проводиться при условии IS << I0 и IS/I0 << 1. При этом условии степенной ряд можно оборвать на первом члене и записать для оптической плотности:
D×ln10 =  при IS << I0 (7.7)
при IS << I0 (7.7)
 Тогда комбинация (7.5а) и (7.7) даёт уравнение (7.8), которое следует преобразовать далее, к более удобному для практических целей виду. Во-первых, учтём, что отношение оптической плотности к длине кюветы в случае мутных сред называется мутностью t (7.9). Далее, необходимо избавиться от численной концентрации n, так как эта величина не известна, когда не известен размер частиц. Произведение V×n равно объёмной доле частиц золя f (7.10). Эта величина так же не известна в общем случае лиофильных золей, однако в случае мицеллярных растворов в отношении её можно сделать некоторые разумные предположения. Можно принять, что плотность вещества мицелл известна и равна плотности rМ соответствующего жидкого углеводорода при данной температуре. С этим предположением объёмную долю можно выразить через весовую концентрацию мицелл сМ (масса мицеллярного ПАВ в единице объёма раствора) по уравнению (7.11), а концентрацию мицелл найти как разность между весовой концентрацией раствора с и ККМ (7.12). Теперь, с помощью (7.8) – (7.11), можно сделать выкладки:
Тогда комбинация (7.5а) и (7.7) даёт уравнение (7.8), которое следует преобразовать далее, к более удобному для практических целей виду. Во-первых, учтём, что отношение оптической плотности к длине кюветы в случае мутных сред называется мутностью t (7.9). Далее, необходимо избавиться от численной концентрации n, так как эта величина не известна, когда не известен размер частиц. Произведение V×n равно объёмной доле частиц золя f (7.10). Эта величина так же не известна в общем случае лиофильных золей, однако в случае мицеллярных растворов в отношении её можно сделать некоторые разумные предположения. Можно принять, что плотность вещества мицелл известна и равна плотности rМ соответствующего жидкого углеводорода при данной температуре. С этим предположением объёмную долю можно выразить через весовую концентрацию мицелл сМ (масса мицеллярного ПАВ в единице объёма раствора) по уравнению (7.11), а концентрацию мицелл найти как разность между весовой концентрацией раствора с и ККМ (7.12). Теперь, с помощью (7.8) – (7.11), можно сделать выкладки:
t = K×V2×n = K×V×f = K×V×cМ/rM
и получить уравнение для объёма одной мицеллы:
 , (7.13)
, (7.13)
из которого можно вычислить её радиус:
R =  (7.14)
(7.14)
Форма записи уравнения (7.13) подчеркивает тот факт, что оно справедливо только для бесконечно разбавленных золей, мутность которых очень мала. Поскольку фотоколориметры имеют сравнительно низкую чувствительность, измерения необходимо производить в той области концентраций, где сферические мицеллы преобладают (10–2 ¸ 10–1 моль/л), но в уравнении (7.13) следует использовать отношение t/сМ, экстраполированное к нулевой концентрации.
Точность определения размеров частиц таким методом является неопределённой, так как описанный выше вывод содержит ряд допущений, справедливых только отчасти. Во-первых, в турбидиметрических измерениях детектор регистрирует не только прошедший свет, но и некоторую часть рассеянного света, DIS, из-за чего уравнение 7.2 не совсем точно. Причины этого поясняет рис. 7.6 а, на котором изображён центр рассеяния света в начале координат x, y, z и прохождение света вдоль оси х. Если зрачок детектора расположен на расстоянии х1 от центра рассеяния и имеет диаметр d, то он "видит" всё излучение, распространяющееся внутри телесного угла 2a. Оно включает как интенсивность прошедшего света IТ, так и часть рассеянного света DIS, ограниченную этим углом. При данном отношении х1/d, которое определяется геометрией фотоколориметра, доля DIS от полной интенсивности IS зависит от распределения интенсивности рассеянного света в пространстве вокруг центра рассеяния (такое распределение называется индикатрисой рассеяния). Если частицы золя имеют сферическую форму с радиусом, много меньшим длины волны света, как того требует уравнение Рэлея, индикатриса имеет вращательную симметрию относительно оси х и зеркальную симметрию относительно плоскости y-z (рис. 7.6 б). Доля DIS от интенсивности, проинтегрированной по всей индикатрисе, в этом случае может быть не очень велика и при любом отношении х1/d она должна составлять менее 50 % от IS, как это следует из соображений симметрии. Когда размеры сферических частиц сопоставимы с длиной волны (то есть имеют порядок 100-1000 нм в случае видимого света), индикатриса является по прежнему симметричной относительно оси х, но несимметричной относительно плоскости y-z. Она вытянута вперёд, из-за чего величина DIS, регистрируемая фотоколориметром как прошедший свет, может быть очень большой и может превышать 50 % от IS. То есть, в этом случае турбидиметрия видимого света не может быть использована даже для грубых оценок размеров частиц. Однако в некоторых лабораториях применяют инфракрасное излучение с длиной волны порядка 100 мкм, что позволяет увеличить диапазон размеров частиц, в котором индикатриса рассеяния удовлетворяет требованиям применимости уравнения Рэлея и является не слишком неблагоприятной для турбидиметрических измерений.
Кроме этого, некоторые предположения, лежащие в основе теоретического уравнения Рэлея, не выполняются в реальных золях. В частности, это уравнение предполагает, что вещество коллоидных частиц и растворитель имеют определённые значения плотности и показателя преломления, и что на границе раздела частица/растворитель эти характеристики меняются скачком. В действительности, из исследований рассеяния рентгеновских лучей и нейтронов известно, что эта граница в реальных коллоидных системах часто бывает более или менее размыта. Существуют и другие источники ошибок, из-за которых описанная выше турбидиметрическая методика должна рассматриваться как не очень точная.
Последовательность выполнения работы
В настоящей работе используется исходный раствор олеата натрия с концентрацией 10 г/л и измерения производятся на фотоэлектроколориметре КФК-2. Прибор должен быть включен за 10 минут или более до начала измерений.
Из исходного раствора олеата натрия готовят 5-6 разбавлений с концентрациями до ~1 г/л. Объём каждого разбавления должен быть несколько больше номинального объёма кюветы фотоколориметра. Например, можно приготовить следующие концентрации
| объём исходного раствора олеата натрия, мл: | ||||||
| объём добавляемой воды, мл: | - | |||||
| концентрация получаемого раствора, г/л: | 1.5 | |||||
Если объём кюветы существенно меньше, чем 20 мл, все рекомендуемые выше объёмы следует уменьшить, например в 2 или 1.5 раза.
В приборе КФК-2 имеются два гнезда для двух идентичных кювет. В одно из них устанавливается кювета с чистым растворителем (дистиллированной водой, в данном случае), в другое – кювета с исследуемым раствором. Кюветы должны быть чистыми настолько, насколько это возможно. В частности, их рабочие плоскости, которые устанавливаются перпендикулярно пучку света, не должны содержать отпечатков палец. Обе кюветы должны быть заполнены до боковой метки или несколько выше её. На внешних плоскостях кювет не должно быть висячих капель.
Измерения производят со светофильтром № 4 (длина волны света в вакууме l = 440 нм). Начинают с наиболее разбавленного раствора и продолжают в порядке увеличения концентрации. Каждое измерение включает одну и ту же последовательность действий. С помощью наружного рычага каретки кюветодержателя устанавливают кювету с растворителем в пучок света и с помощью рукояток настройки нуля прибора (рукояток "грубо" и "точно") добиваются положения индикаторной стрелки точно у нуля шкалы оптической плотности D. Затем устанавливают в пучок света кювету с исследуемым раствором с помощью того же рычага и считывают показание со шкалы оптической плотности. Для точного считывания показаний в обоих случаях наблюдателю следует установить глаза так, чтобы индикаторная стрелка прибора совпадала с её отражением в зеркальце, расположенном под шкалой. После каждого измерения раствор в кювете заменяют на более концентрированный и по окончанию работы обе кюветы моют водопроводной и дистиллированной водой.
В ходе работы следует выписать необходимые для вычислений данные: длину кюветы, использованной для растворов, (она указывается вверху каждой кюветы на одной из внешних плоскостей), концентрации растворов и значения оптических плотностей.
Обработка и оформление результатов
 1. Значения концентраций растворов олеата натрия и соответствующие оптические плотности заносят в таблицу (см табл. 7.1). Вычисляют концентрацию мицелл сМ по формуле (7.12), затем мутность растворов t по формуле (7.9) и отношение мутности к концентрации (t/cМ); результаты заносят в ту же таблицу. При вычислении сМ следует учесть, что величина ККМ олеата натрия составляет 1.0 ммоль/л при комнатной температуре. (Молекулярная масса олеата натрия 304.45).
1. Значения концентраций растворов олеата натрия и соответствующие оптические плотности заносят в таблицу (см табл. 7.1). Вычисляют концентрацию мицелл сМ по формуле (7.12), затем мутность растворов t по формуле (7.9) и отношение мутности к концентрации (t/cМ); результаты заносят в ту же таблицу. При вычислении сМ следует учесть, что величина ККМ олеата натрия составляет 1.0 ммоль/л при комнатной температуре. (Молекулярная масса олеата натрия 304.45).
2. Строят график в координатах cМ – (t/cМ) (аргументом является концентрация cМ) ; экстраполируют его к нулевой концентрации и считывают значение  на оси
на оси  . График, как правило, получается нелинейным убывающим. Из-за отсутствия аналитического выражения для зависимости (t/cМ) от cМ приходится проводить экстраполяцию ориентируясь только на экспериментальные точки.
. График, как правило, получается нелинейным убывающим. Из-за отсутствия аналитического выражения для зависимости (t/cМ) от cМ приходится проводить экстраполяцию ориентируясь только на экспериментальные точки.
3. Вычисляют оптическую постоянную К по уравнению (7.6). В качестве длины волны l следует принять её фактическое значение; в качестве показателя преломления растворителя n0 – значение для чистой воды (см. приложение 4), и в качестве показателя преломления ядра мицеллы – показатель преломления углеводорода, соответствующего олеату натрия. Таким углеводородом является 9-октадецен, C18H36, показатель преломления которого  равен 1.4470.
равен 1.4470.
4. Зная величины К и  , вычисляют объём мицеллы по уравнению (7.13) и затем радиус мицелл по уравнению (7.14). В качестве rМ следует принять значение плотности 9-октадецена при комнатной температуре. При 20 °С она составляет 0.7916 г/см3.
, вычисляют объём мицеллы по уравнению (7.13) и затем радиус мицелл по уравнению (7.14). В качестве rМ следует принять значение плотности 9-октадецена при комнатной температуре. При 20 °С она составляет 0.7916 г/см3.
5. Чтобы проверить реалистичность найденного радиуса, следует оценить радиус мицелл на основании длин связей. Полная длина L углеводородной цепи может быть вычислена по уравнению 7.1. Однако молекула олеата натрия содержит двойную связь С=С, в месте расположения которой углеводородная цепь изгибается. Можно принять, что молекулы олеата натрия имеют такую же конформацию углеводородной цепи, какая известна для кристаллической олеиновой кислоты (рис. 7.7). Эффективная длина этой молекулы равна расстоянию АС между наиболее удалёнными атомами. Его можно вычислить из метрических соотношений в треугольнике АВС:
АС2 = АВ2 + ВС2 – 2АВ×ВС×соs113°
Полная длина L молекулы равна сумме длин сторон треугольника АВ + ВС. Поскольку двойная связь расположена приблизительно в середине углеводородной цепи, то АВ » ВС » L/2. Из этого следует 
Таким образом, радиус мицеллы может быть оценен по формуле
 (7.15)
(7.15)
где L – длина углеводородной цепи, выпрямленной относительно двойной связи (уравнение 7.1)
6. В выводах из работы указать радиус мицелл, найденный экспериментально и оцененный из геометрических соображений (ур-ие 7.15)
Контрольные вопросы
1. Что называют мицеллой ? Какие вещества способны образовать мицеллы ?
2. Что является движущей силой мицеллообразования ?
3. Что называется лиофильными и лиофобными коллоидами ? Приведите примеры этих типов.
4. Какую форму имеют мицеллы в разбавленных растворах ? Что заставляет их иметь определённую форму ?
5. Какие размеры имеют сферические мицеллы ?
6. Можно ли вычислить размер мицелл данного ПАВ из теоретических соображений ?
7. Как изменится строение и размер мицелл, если к раствору коллоидного ПАВ добавить электролит, например азотнокислый калий ?
8. Изменится ли строение или размер мицелл, если к раствору коллоидного ПАВ добавить небольшое количество неполярного вещества, например несколько капель масла ?
9. Как изменится строение мицелл, если к водному раствору ПАВ добавить большое количество неполярного растворителя (большее, чем содержание воды ) ?
10. Что называется солюбилизацией? На каком свойстве коллоидного ПАВ основано это явление?
11. Какие варианты метода рассеяния света применяются для определения размеров частиц лиофильных золей ?
12. Чем отличается турбидиметрия от нефелометрии ?
13. Перечислите условия, для которых выведено уравнение Рэлея.
14. В настоящей работе турбидиметрический метод применяется к растворам, о которых известно, что они содержат очень маленькие, сферические коллоидные частицы. Можно ли применить этот метод к золям с неизвестными размерами и формой частиц ?
15. В настоящей работе рекомендуется наименьшая концентрация олеата натрия ~1 г/л. Можно ли распространить измерения до более низких концентраций, например 0.01 г/л ?
16. В настоящей работе используется наибольшая концентрация олеата натрия 10 г/л. Можно ли выбрать более высокую концентрацию, например, 100 г/л ? (Олеат натрия хорошо растворим в воде).
17. В настоящей работе используется длина волны света 440 нм, отвечающая коротковолновому концу видимой части спектра (синий цвет). Чем эта длина волны благоприятна или неблагоприятна в сравнении с длиноволновым концом оптического диапазона (красный цвет) для поставленной цели ?
18. Предположим, что на внутренней поверхности кюветы для турбидиметрических измерений имеются следы загрязнений – жира. Как это может повлиять на определяемый радиус мицелл ?
19. Как можно охарактеризовать турбидиметрический метод определения размеров частиц – точный или неточный ? универсальный или ограниченный многими условиями ?
Литература
Балакирев А.А., Бабак В.Г., Дехтяренко Н.Г., Иванова И.А., Монисова Р.А. Коллоидная химия. Лабораторный практикум. Часть 2. М: ВЗИПП 1986, Лаб. работа 9.
Chevalier Y., Zemb T. The structure of micelles and microemulsions. Reports on Progress of Physics 1990, vol. 53, p.279-371 (о мицеллах).
Ramnath N, Ramesh V, Ramamurthy V. The structure of micelles – A review. Journal of Scientific & Industrial Research 1985, vol. 44, 199-208 (о мицеллах).
Dickinson E., Stainsby G. Colloids in food. L: Applied Science 1982, Chapter 4 (о мицеллах), Chapter 5 (о статическом и динамическом рассеянии излучения).
Тенфорд Ч. Физическая химия полимеров. (пер с англ.) М: Химия 1965, Глава 5 (о статическом рассеянии света).
Наука о коллоидах. Том 1. Необратимые системы. (Под редакцией Г.Р. Кройта). (пер с англ.) М: Издатинлит 1955, Глава 3 (о рэлеевском рассеянии света).
Tanford C. Micelle shape and size. Journal of Physical Chemistry 1972, vol. 76, 3020-3024 (уравнение 7.1)
Abrahamsson S., Ryderstedt-Nahringbauer I. The crystal structure of the low-melting form of oleic acid. Acta Crystallographica 1962, vol. 15, 1261-1268 (структура олеиновой кислоты)
Beilstein Handbuch der Organischen Chemie. Berlin etc.: Springer-Verlag 1920-1976 (плотность и показатель преломления 9-октадецена)
Рис. 7.1 Схематическое изображение: (a) молекулы дифильного ПАВ, (б) сфкрической мицеллы, состоящей из таких молекул
Рис. 7.2 Внутреннее строение сферической мицеллы согласно классической модели Хартли. Рис (а) показывает схематически расположение молекул в мицелле и противоионов вокруг неё (крестики). Рис. (б) показывает соответствующие зоны строения и принятые термины. Относительные размеры ядра мицеллы и слоя Штерна не выдержаны.
Рис. 7.3 Изменение строения мицеллы при увеличении ионной силы. а) сферическая мицелла; б) цилиндрическая мицелла; в) дискообразная мицелла. Противоионы не показаны.
Рис. 7.4 Принципиальная схема прибора для исследования рассеяния света.
Рис. 7.5 Полуоктаэдрическая ячейка для нефелометрии. Фото-детектор может располагаться перпендикулярно граням и регистрировать интенсивность под углами рассеяния 45°, 90° и 135°.
Рис. 7.6 Схема взаимного расположения зрачка фото-детектора D и пробы Р в фотоколориметре в координатах пространства x,y,z (а) и распределение интенсивности рассеянного света по осям проекций интенсивности Ix, Iy, Izпри R << l ( б ) (индикатриса рассеяния малыми частицами)
Рис. 7.7 Конформация молекулы олеиновой кислоты: (а) вид вдоль оси а псевдо-орторомбической ячейки; (б) вид вдоль оси b. Атомы водорода не показаны.
* в коллоидной химии, термины агрегация и ассоциация являются почти синонимами, означающими объединение частиц, при котором они не теряют своей индивидуальности. Обычно, термин ассоциация подразумевает объединение однородных частиц, тогда как агрегация может относиться как к однородным, так и разнородным частицам. Чтобы подчеркнуть это смысловое различие, иногда используют термин само-ассоциация.
* Представим физическое тело произвольной формы как распределение элементов массы dm вокруг центра масс. Радиусом инерции называется величина  , где r – радиус-вектор, проведённый из центра масс до элемента массы dm, и интегрирование осуществляется по всему пространству вокруг центра масс. Иначе его можно определить как
, где r – радиус-вектор, проведённый из центра масс до элемента массы dm, и интегрирование осуществляется по всему пространству вокруг центра масс. Иначе его можно определить как  , где J – момент инерции тела.
, где J – момент инерции тела.