Первичная кристаллизация сталей
О.А. Оленева, О.В. Селиванова, С.В. Беликов
ДИАГРАММА СОСТОЯНИЯ
СИСТЕМЫ ЖЕЛЕЗО – УГЛЕРОД
Учебное пособие
Научный редактор проф., д-р.техн.наук А.А. Попов
Екатеринбург
УДК 544.344.016
ББК 22.317
Д44
Рецензенты:
кафедра физики Уральской государственной горно-геологической академии, проф., д-р физ.-мат. наук И.Г. Коршунов
ст. науч. сотрудник института физики металлов УрО РАН канд. техн. наук Н.В. Катаева.
Оленева О.А.
Д44 Диаграмма состояния системы железо – углерод : учебное пособие / О.А. Оленева, О.В. Селиванова, С.В. Беликов. Екатеринбург: ГОУ ВПО УГТУ – УПИ, 2006. 56 с.
ISBN 978-5-321-00977-2
ISBN 5-321-00977-2
Учебное пособие разработано в связи с отсутствием современного пособия по углубленному изучению диаграммы состояния железо – углерод. В учебном пособии подробно разбираются диаграммы состояния систем железо – цементит и железо – графит. Рассмотрены процессы равновесных фазовых превращений в различных сплавах при охлаждении, а также рассмотрены вопросы образования структур. Пособие предназначено для студентов специальностей 150702 – Физика металлов, 150105 – Металловедение и термическая обработка металлов и направления 150600 - Материаловедение, технология материалов и покрытий.
Библиогр.: 3 назв. Рис. 22. Табл. 4.
УДК 544.344.016
ББК 22.317
ISBN 978-5-321-00977-2 © ГОУ ВПО «Уральский государственный
ISBN 5-321-00977-2 технический университет – УПИ», 2006
Оглавление
Введение………………………………………………………………………….….4
1. Компоненты и фазы в системе железо-углерод…………………4
2. Система железо — цементит (Fe — Fе3С)………………………………8
2.1. Первичная кристаллизация сталей…………………………………………...12
2.2. Вторичная кристаллизация сталей…………………………………………...14
2.3. Превращения в белых чугунах……………………………………………….20
3. Система железо – графит (Fe – Cгр)……………………………………..27
3.1. Чугуны…………………………………………………………………………29
3.2. Процесс графитизации………………………………………………………..32
3.3 Белый чугун……………………………………………………………………37
3.4. Серый чугун……………………………………………………………………38
3.5. Высокопрочный чугун………………………………………………………..39
3.6. Ковкий чугун………………………………………………………………….40
4. Стали……………………………………………………………………………..42
4.1. Влияние углерода……………………………………………………………..42
4.2. Примеси в сталях……………………………………………………………...43
4.3. Легирующие элементы……………………………………………………….46
4.4. Влияние легирующих элементов на фазовые превращения сталей……...48
4.5. Карбиды в легированных сталях…………………………………………….50
4.6. Классификация и маркировка сталей………………………………………..51
Введение
Диаграмма состояния системы железо – углерод является одной из важнейших диаграмм двойных систем, потому что наиболее распространенные в технике сплавы – стали и чугуны – представляют собой сплавы железа с углеродом. В состав сталей и чугунов кроме углерода входят кремний, марганец и другие элементы, но углерод является основным компонентом, оказывающим влияние на структуру и свойства железных сплавов.
Следует отметить, что в учебниках по металловедению разных авторов и разных лет издания, которыми пользуются студенты, координаты некоторых основных точек диаграммы несколько отличаются друг от друга по содержанию углерода и по температуре. Это связано с тем, что в научной литературе периодически появляются сведения об исследовании отдельных участков диаграммы, уточняющие положение точек и линий диаграммы. Однако эти уточнения обычно невелики, не меняют давно установленного общего начертания диаграммы состояния железо – углерод и не вносят каких-либо принципиальных изменений в понимание фазовых превращений в сплавах и их структуры.
Диаграмма железо – углерод должна распространяться от железа до углерода. Железо образует с углеродом химическое соединение: цементит – Fe3C. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму – по частям. Так как на практике применяют металлические сплавы с содержанием углерода до 5 %, то рассматриваем часть диаграммы состояния от железа до химического соединения цементита, содержащего 6,67 % углерода.
1. Компоненты и фазы в системе железо – углерод
Компонентами железоуглеродистых сплавов являются железо, углерод и цементит.
1. Железо– d-переходный металл серебристо-светлого цвета. Температура плавления – 1539 °С. Удельный вес равен 7,86 г/см3.
Наиболее существенной особенностью железа является его полиморфизм. В твердом состоянии железо может находиться в двух модификациях – a и γ. Полиморфные превращения происходят при температурах 911 и 1392 °С. При температуре ниже 911 и выше 1392 °С существует Fea (или α-Fе) с объемно-центрированной кубической решеткой. В интервале температур 911…1392 °С устойчивым является Feγ (или γ-Fе) с гранецентрированной кубической решеткой. При превращении α→γ наблюдается уменьшение объема, так как решетка γ-Fе имеет более плотную упаковку атомов, чем решетка α-Fе. При охлаждении во время превращения γ→α наблюдается увеличение объема. В интервале температур 1392…1539 °С высокотемпературное Fea называют Feδ. Высокотемпературная модификация Fea не представляет собой новой аллотропической формы.
При температуре ниже 768 °С железо ферромагнитно, а выше – парамагнитно. Точку 768 °С, соответствующую магнитному превращению, т.е. переходу из ферромагнитного состояния в парамагнитное, называют точкой Кюри. Модификация Feγ парамагнитна.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (временное сопротивление – σв = 250 МПа, предел текучести – σТ = 120 МПа) и высокими характеристиками пластичности (относительное удлинение – δ =50 %, а относительное сужение – ψ = 80 %). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.
2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 °С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом, равным четырем (температура плавления – 5000 °С).
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Более точные исследования показали, что цементит может иметь переменную концентрацию углерода. Однако в дальнейшем, при разборе диаграммы состояния, сделаем допущение, что Fе3С имеет постоянный состав. Кристаллическая решетка цементита ромбическая, удельный вес 7,82 г/см3 (очень близок к удельному весу железа). При высоких температурах цементит диссоциирует, поэтому температура его плавления неясна и проставляется ориентировочно – 1260 °С.
Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 210 °С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность.
Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов, например азотом; атомы железа – металлами, например марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом.
Если графит является стабильной фазой, то цементит – это метастабильная фаза.  Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2. Феррит (Ф, a) – твердый раствор внедрения углерода в a-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727 °С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539 °С) с предельной растворимостью углерода 0,1 % при температуре 1499 °С (точка J).
Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, временное сопротивление – σв = 300 МПа) и пластичен (относительное удлинение - δ =50 %), магнитен до 768 °С.
3. Аустенит (А, γ) – твердый раствор внедрения углерода в γ-железо (по имени английского ученого Р. Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ-железе 2,14 % при температуре 1147 °С (точка Е). Аустенит имеет твердость 200…250 НВ, пластичен (относительное удлинение – δ =40…50 %), парамагнитен.
При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
4. Цементит – характеристика дана выше.
В железоуглеродистых сплавах присутствуют фазы – цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
5. Графит – характеристика дана выше.
Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо – цементит и железо – графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе – С) - графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат – температура – содержание углерода (рис. 1). Диаграмма состояния системы железо – углерод построена по результатам многочисленных исследований, проведенных учеными разных стран.
Особое место среди них занимают работы Д.К. Чернова. Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной части.
Буквенное обозначение узловых точек в диаграмме является общепринятым как в России, так и за рубежом.
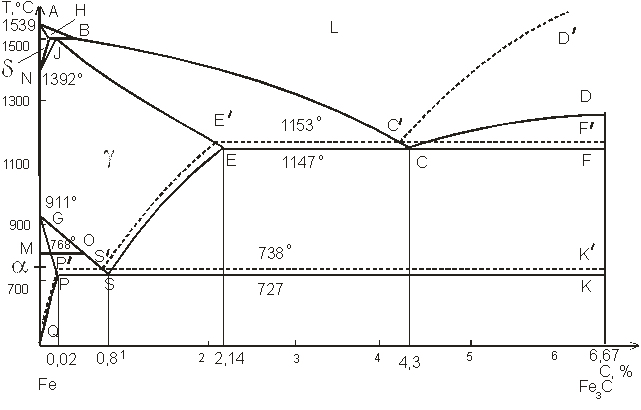
Рис. 1. Общий вид диаграммы состояния системы железо – углерод
2. Система железо — цементит (Fe — Fе3С)
Диаграмма состояния системы железо – цементит изображена на рис. 2. Данные о точках диаграммы приведены в табл. 1. Имеющиеся во всех областях диаграммы фазы видны на рис. 2. Значение всех линий указано в табл. 2.

Рис. 2. Диаграмма состояния системы железо – цементит
Ликвидус по всей диаграмме проходит по линиям АВ, ВС, СD; солидус – по линиям АН, НJ, JЕ, ЕСF.Сплавы железа с углеродом обычно делят на стали и чугуны. Условной границей для такого деления является 2,14 % С (точка E). Сплавы, содержащие углерода менее 2,14 %, относятся к сталям, более 2,14 % – к чугунам.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, обозначаются буквой А. В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс с (от слова chauffage – нагрев) при нагреве и индекс r (от слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии СS обозначается как нагрев выше точки АС3. При охлаждении же этой стали первое превращение должно быть обозначено как Аr3, второе (на линии РSК) – как Аr1.
Таблица 1
Узловые точки диаграммы состояния системы Fе — Fе3С
| Обозначение точки | t,°С | С,% | Значение точки |
| А | Плавление (кристаллизация) чистого железа | ||
| N | Полиморфное превращение δ« γ в чистом железе | ||
| G | Полиморфное превращение α« γ в чистом железе | ||
| Н | 0,1 | δ-твердый раствор, предельно насыщенный углеродом. Участвует в перитектическом превращении | |
| J (I) | 0,16 | Аустенит, возникающий в результате перитектического превращения | |
| В | 0,51 | Жидкая фаза, участвующая в перитектическом превращении | |
| D | 6,67 | Предполагаемая температура плавления Fе3С | |
| Е | 2,14 | Аустенит, предельно насыщенный углеродом | |
| С | 4,3 | Жидкая фаза, испытывающая эвтектическое превращение | |
| F | 6,67 | – | |
| P | 0,02 | Феррит, предельно насыщенный углеродом | |
| S | 0,8 | Аустенит, испытывающий эвтектоидное превращение | |
| K | 6,67 | – | |
| Q | 0,006 | Феррит, предельно насыщенный углеродом |
Таблица 2
Значение линий диаграммы состояния системы Fе — Fе3С
| Линии | Значение линии |
| АВ АН ВС J(I)Е СD НJВ ЕCF РSK (А1) HN JN (А4) ЕS (Аcm) GS (А3) GP PQ МО (А2) | Ликвидус для δ-твердого раствора Солидус для δ-твердого раствора Ликвидус для аустенита Солидус для аустенита Ликвидус для цементита (первичного) Перитектическое превращение: δн+Lв →γJ Эвтектическое превращение: Lс → (γ Е + Fе3С) Эвтектоидное превращение: γS → (αP+ Fе3С) Начало полиморфного превращения δ→γв сплавах при охлаждении Конец полиморфного превращения δ→γв сплавах при охлаждении Линия предельной растворимости углерода в γ-Fе. Начало выделения цементита (вторичного) из аустенита при охлаждении Начало аллотропического превращения γ→ α в сплавах при охлаждении. Начало выделения феррита из аустенита при охлаждении Линия предельной растворимости углерода в α-Fе Начало выделения цементита (третичного) из феррита при охлаждении Переход из ферромагнитного в парамагнитное состояние (768 ºС, т. Кюри) |
Прежде чем перейти к непосредственному разбору на конкретных примерах процессов фазовых превращений, совершающихся в различных сплавах при их охлаждении и нагреве, необходимо сделать следующие замечания.
Всякая диаграмма состояния показывает условия равновесного сосуществования фаз во взятой системе компонентов.
Составы фаз при любой температуре удовлетворяют значениям, определяемым по сопряженным кривым только при условии установившегося физико-химического равновесия и при наличии плоской границы раздела фаз, т. е. при бесконечно большом радиусе кривизны этой поверхности. Если же поверхности раздела контактирующих фаз имеют иной (меньший) радиус кривизны, то создаются иные условия равновесия, в связи с чем изменяется взаимный ход соответствующей сопряженной пары кривых.
Полное физико-химическое равновесие между фазами может быть достигнуто только в специальных лабораторных условиях, а на практике некоторым приближением к этому состоянию может быть случай чрезвычайно медленного охлаждения или нагрева сплава с весьма длительными выдержками во времени при любых искомых температурах.
Условимся, что при разборе сплавов в процессе их превращения при нагреве или охлаждении каждое фиксируемое состояние фаз соответствует равновесному, вытекающему из соответствующих кривых; причем для взятой температуры найденные составы будут относиться ко всему объему фаз, а не только к пограничным контактирующим слоям, где фазовое равновесие устанавливается практически очень быстро. Кроме того, известно, что при всяком фазовом превращении происходит возникновение зародышевых центров и последующий их рост.
При этом согласно законам термодинамики зародышевые центры, способные к дальнейшему росту, т. е. к развитию фазового превращения, могут возникать в исходной материнской фазе не при предельной температуре, определяемой по кривым диаграммы, где фазы находятся в равновесии, а при температуре несколько меньшей, т. е. при наличии некоторого переохлаждения.
Поэтому, когда будем говорить о том, что по достижении какой-то линии диаграммы при нагреве или при охлаждении начинается фазовое превращение, то это надо понимать условно, т.е. они совершаются в «идеальных» условиях.
Первичная кристаллизация сталей
Рассмотрим первичную кристаллизацию сталей, для чего воспользуемся рис. 3.
Сплав 1(0,05 % С). Кристаллизация начнется в точке αи закончится в точке b с образованием δ-твердого раствора. Углерод повышает температуру аллотропического превращения железа δ↔γ. Эта перестройка решетки твердого раствора идет между точками с и d, когда одновременно существуют два разных твердых раствора (состав δ-раствора изменяется по линии НN, γ-раствора – по линии JN). Ниже точки d сплав охлаждается в аустенитном состоянии.

Рис. 3. Левый верхний угол диаграммы состояния Fе – С – первичная кристаллизация сталей
Сплав 2 (0,13 % С). Кристаллизация δ-раствора начнется в точке е и закончится в точке k. При 1499 °C происходит перитектическое превращение:
δH +LB→ γJ.
От точки k до точки п идет перестройка решетки δ→γ,и, наконец, ниже точки п сплав охлаждается в аустенитном состоянии.
Сплав 3 (0,25 % С). Кристаллизация δ-раствора начинается в точке l и заканчивается в точке т. При 1499 °C также происходит перитектическое превращение, по окончании которого в избытке оказывается жидкая фаза. От точки т до точки s продолжается кристаллизация аустенита из жидкой фазы. Ниже точки sсплав охлаждается в аустенитном состоянии.
Сплав 4(0,6% С). Кристаллизация сплава начинается в точке g с образования аустенита и продолжается до точки h. Ниже этой точки сплав охлаждается в аустенитном состоянии.
Таким образом, первичная кристаллизация сталей заканчивается образованием γ-фазы, т. е. аустенита.