Структура и генетика фактора V
Введение
Свертывание крови, в основе которого лежит превращение фибриногена в фибрин, происходит в результате цепи последовательных превращений более чем 10 различных белков, составляющих, в совокупности, систему свертывания крови
Собственно свертывание крови состоит из трех основных этапов: 1) образование фермента, активирующего протромбин; 2) превращение протромбина в тромбин под влиянием фермента, активирующего протромбин; 3) превращение фибриногена в фибрин под влиянием тромбина.
В норме все факторы свертывания крови находятся в неактивном состоянии, или в формах белков-предшественников. Повреждение сосудов становится начальным этапом в каскаде реакций приводящих к свертыванию крови и остановке кровотечений. В этом каскаде ферментативных реакций активированная форма одного фактора свертывания катализирует активацию следующего (см. Приложение 1). В силу каталитической природы процесса факторы, действующие на начальных этапах, требуются в очень малых количествах. Их эффект увеличивается многократно благодаря большому количеству последующих этапов, что обеспечивает в итоге быструю ответную реакцию на травму сосуда.
Коагуляционный фактор V является одним из 12 факторов свертывания крови. Факторы свертывания крови – группа веществ содержащихся в плазме крови и в тромбоцитах, которые обеспечивают своевременное прекращение кровотечений при повреждении сосудов.
Функции фактора V
Фактор V – проакцелерин, плазменный AC-глобулин, или лабильный фактор. Образуется в печени, но, в отличие от других печеночных факторов протромбинового комплекса (II, VII, и X) не зависит от витамина K. Легко разрушается. Содержание фактора V в плазме – 12 – 17 ед/мл (около 0,01 г/л), период полураспада – 15 – 18 часов. Минимальный уровень, необходимый для гемостаза – 10 – 15%.
Фактор VI – акцелерин, или сывороточный AC-глобулин – активная форма фактора V. Исключен из номенклатуры факторов свертывания, признается лишь неактивная форма фермента – фактор V (проакцелерин), который при появлении следов тромбина переходит в активную форму.
Фактор V циркулирует в кровяном русле в неактивной форме до тех пор, пока система коагуляции не активируется по внутреннему или внешнему механизму. Далее фактор V активируется и взаимодействует с коагуляционным фактором X. Активированные формы этих двух факторов Vа и Xа образуют комплекс который преобразует важнейший коагуляционный белок протромбин в его активную форму тромбин. Тромбин затем превращает белок фибриноген в фибрин, который является материалом для образования кровяного сгустка.
Так же фактор свертывания V имеет другую роль в регуляции свертывающей системы через его взаимодействие с активированным протеином С (АПС). АПС обычно инактивирует фактор коагуляции V путем расщепления последнего по специфичным участкам. Это замедляет процесс тромбообразования, предотвращая разрастание тромба. Когда фактор V расщеплен в положении 506, он может совместно с АПС инактивировать фактор VIIа, который является еще одним белком, необходимым для нормального свертывания крови.
Структура и генетика фактора V
Коагуляционный фактор V - гликопротеин (М - 33000), циркулирующий в плазме крови человека и участвующий в коагуляционном каскаде свертывания крови. Ген фактора V локализуется на первой хромосоме человека в позиции 1q23(см. Приложение 2). Ген фактора V человека по протяженности составляет 80 килобаз и состоит из 25 экзонов. Размер экзонов колеблется от 72 до 2820 пар оснований. Размер и число экзонов сходно с геном фактора VIII, за исключением экзона 5. У фактора V домен В кодируется двумя экзонами, у фактора VIII домен В кодируется одним большим экзоном. Размер интронов варьирует от 0,4 до 11 килобаз. 21 из 24 экзон-интронных локализаций у гена фактора FV располагается в тех же положениях, что и у гена фактора F VIII.
Молекула фактора V состоит из нескольких доменов в следующей ориентации: A1, A2, B, A3, C1, C3. Фактор V переходит в активную форму FVa через протеолиз, осуществляемый альфа тромбином и C протеином в трех сайтах - Arg 506, Arg 306, Arg 679. Расщепление тромбином фактора 5 происходит в строго определенных позициях пептида: arg 709/ser 710; arg 1018/thr 1019; arg 1545/ser 1546. Удаление В домена приводит к переводу фактора V (FV) в активную форму Vа, которая состоит из тяжелой цепи (Мr - 105000), формируемой из двух А доменов (А1 и А2) и нековалентно связанной легкой цепи (Mr - 74000), образуемой из одного А домена (А3) и двух С доменов (С1, С2). Фактор V - кофактор сериновой протеазы фактора Xa . Протромбин, факторы FVa и FXa совместно на клеточной или фосфолипидной поверхности с дивалентными катионами кальция формируют конечный протромбиназный комплекс в коагуляционном каскаде. Данный комплекс увеличивает активность фактора Xa в 350000 раз. Фактор FVa имеет общую доменную структуру с фактором F VIIIa, идентичность тяжелых и легких цепей достигает 40%.
Дефицит фактора V
Впервые больной с наследственным дефицитом фактора свертывания был описан в 1947 г. Впоследствии данный фактор получил следующие обозначения: лабильный фактор, проакцелерин, Ас-глобулин, фактор V.
Фактор V синтезируется, как и другие факторы протромбинового комплекса (II, VII, X), в гепатоцитах (клетках печени), но его образование не зависит от витамина К. Он лабилен (изменчив), плохо сохраняется в консервированной крови и плазме, потребляется в процессе свертывания, чем отличается от факторов VII и X. В свежей сыворотке определяются следы фактора V, а через час хранения при 37°С этот фактор уже не определяется. Фактор V, как и фактор II, не сорбируется (вытягивается) из плазмы сульфатом бария.
Дефицит фактора V наследуется по аутосомно-доминантному типу с неполной экспрессивностью патологического гена и по аутосомно-рецессивному типу. Эти данные говорят о полигенности парагемофилии. Об этом же свидетельствует определенная неоднородность нарушений гемостаза у разных больных, в частности сравнительно частое сочетание дефицита фактора V с удлинением времени кровотечения и дефицитом фактора VIII.
Клиника
Выраженность геморрагического синдрома зависит от степени дефицита в плазме больных фактора V, а также от наличия сопутствующих нарушений в других звеньях системы гемостаза, таких как удлинение времени кровотечения, дефицит фактора VIII. Отмечаются мелкие кровоизлияния и кровоподтеки, носовые и десневые, маточные и менструальные кровотечения. Возможны кровотечения из пупочного канатика, желудочно-кишечные кровотечения. У больных с выраженными формами заболевания часты длительные кровотечения при удалении зубов, тонзиллэктомии (удалении миндалин) и при порезах, но полостные операции редко осложняются кровотечениями. Наиболее тяжелая кровоточивость наблюдается у больных с уровнем фактора V ниже 2% и при сочетании дефицита этого фактора с недостаточностью фактора VIII. При заболевании средней тяжести уровень фактора V в плазме составляет 2-6%, при легкой форме болезни - 6-16%. При более высоких показателях фактора V кровоточивость не возникает.
В последние годы мутации в коагуляционном факторе V arg-506-gln и arg-306-gly связывают с развитием ряда мультифункциональных заболеваний, таких как венозный тромбоз, инфаркт миокарда, гемохроматоз.
Диагностика
Дефицит фактора V, как и болезнь Стюарта - Прауэра, сопровождается удлинением протромбинового времени и нарушением показаний активированного тромбопластинового времени, теста генерации тромбопластина и аутокоагуляционной пробы.
Все перечисленные выше нарушения сочетаются с нормальным тромбиновым временем и устраняются добавлением к исследуемой плазме свежей нормальной плазмы. В отличие от этого «старая» нормальная плазма таким корригирующим действием не обладает. Для получения «старой» плазмы ее хранят в холодильнике при 4°С до тех пор, пока ее протромбиновое время не удлинится до 60 си более; такую плазму можно считать практически лишенной фактора V, но содержащей еще достаточное количество факторов II, VII и X. Диагноз уточняют количественным определением фактора V в плазме крови больного.
Правильная диагностика этого заболевания позволяет избежать как ненужной терапии, так и необоснованных отказов в операции из-за лабораторных нарушений.
Лечение
Заместительную терапию при дефиците фактора V проводят свежей донорской кровью или свежезамороженной плазмой. Их следует заготавливать в пластиковых мешках, поскольку при контакте со стеклом ускоряется инактивация фактора V. В особых случаях возможны прямые переливания крови от донора больному. При этом ни в коем случае не используют кровь родителей и других родственников больного.
При больших кровотечениях и подготовке к хирургическим вмешательствам уровень фактора V в плазме должен быть выше 25-30%. Это достигается повторными струйными переливанями свежезамороженной плазмы из расчета 15 мл/кг через каждые 12 ч. Предоперационную подготовку больных лучше начинать за 1-2 дня до хирургического вмешательства. В первые сутки лечения или предоперационной подготовки плазму вводят путем внутривенного вливания в дозе, не превышающей 40-50 мл/кг массы тела. Объем вливаемой крови для взрослого больного может достигать 1,5-2 л донорской плазмы в 2 введения. После этого переходят на введение плазмы из расчета 15 мл/кг массы тела. При малых травмах и операциях (удаление зубов и т. д.) вполне достаточно повысить уровень фактора V в плазме больного не до 25-30%, а лишь до 15-20%. При одновременном дефиците фактора VIII дополнительно назначают криопреципитат.
Мутация Лейдена.
Еще одна патология фактора V связана со специфической мутацией в гене фактора V. Свертывающая система находится под контролем нескольких белков, в том числе белка, называемого активированный протеин C (АПС). АПС обычно инактивирует фактор свертывания крови V, что замедляет процесс свертывания и предотвращает образование слишком больших сгустков. У больных тромбофилией людей с мутацией фактора V Лейдена точечная однонуклеотидная мутация приводит к замене аргинина на глютаминовую кислоту в 506 положении, что в свою очередь придает устойчивость активной форме фактора V к протеазной активности АПС. В результате, процесс свертывания остается активным дольше, чем обычно, что увеличивает вероятность развития неправильных кровяных сгустков. Соответственно, риск образования тромбов повышается.
Мутация Лейдена является наследственным аутосомно-доминантым нарушением свертывания крови. Люди с фактором V Лейдена имеют более высокий риск развития тромбозов, таких как тромбоз глубоких вен (ТГВ). ТГВ наиболее часто возникает в ногах, хотя они могут возникать и в других частях тела, включая мозг, глаза, печень и почки. Тромбофилии связанные с фактором V Лейдена так же увеличивают риск того, что сгустки будут отрываться от своего первоначального месторасположения, попадая в кровь. Эти сгустки могут попадать в легкие, вызывая тем самым легочную эмболию. Хотя мутация фактор V Лейдена увеличивает риск образования тромбов, только у 10% людей с этой мутацией выявлено образование ненормальных тромбов.
Мутация Лейдена так же увеличивает риск прерывания беременности. Женщины с такой мутацией в 2-3 раза чаще подвержены выкидышам или прерыванию беременности во втором и третьем триместре беременности. Некоторые исследования показывают, что мутация фактора V Лейдена может также увеличить риск других осложнений во время беременности, в том числе вызванное беременностью высокое кровяное давление (гестоз), медленный рост плода, и раннее отделение плаценты от стенки матки (отслойка плаценты). Тем не менее, связь между мутацией фактора V Лейдена, и этими осложнения не были подтверждены. Большинство женщин больных тромбофилией, связанной с мутацией фактора V Лейдена, имеют нормальную беременность.
Мутация Лейдена является наиболее распространенной наследственной формы тромбофилии. В среднем от 3-8 % людей с европейской родословной являются гетерозиготами по фактору V Лейдена, и примерно 1 из 5000 человек гомозиготами. Мутация встречается реже в других популяциях.
Другие факторы также повышают риск развития тромбов у людей больных тромбофилией связанной с фактором V Лейдена. Эти факторы включают в себя увеличение возраста, ожирение, травмы, операции, курение, беременность и использование оральных контрацептивов (противозачаточных пилюль) или заместительной гормональной терапии. Риск аномальных сгустков, также значительно выше у людей, которые имеют сочетание лейденской мутации фактора V и другой мутацией в гене фактора V. Кроме того, риск повышается у людей, которые имеют мутацию фактора V Лейдена вместе с мутацией в другом гене, участвующем в системе коагуляции.
Заключение
Фактор V, не смотря на его низкую концентрацию в плазме крови, играет важную роль, в образовании кровяного сгустка, усиливая его прочность, что предотвращает повторные кровотечения. Образование поперечных сшивок в фибриновой сетке является заключительным этапом формирования тромба, потому независимо от пути свертывания крови эффективность этого процесса зависит, в конечном счете, и от концентрации этого фактора. Поэтому патологии связанные с недостатком фактора XIII имеют такие тяжелые последствия для человека. Изучение связи изменения концентраций этого фактора и различных болезней так же повышает интерес к нему, и тем сильнее кажется необходимость в получении препаратов этого фактора.
Список литературы
1. Шмидт Р. И Тевс Г. «Физиология человека » Москва « Мир» 2005г.
2. http://ghr.nlm.nih.gov/gene/F5
3. http://humbio.ru/humbio/har/002102bc.htm#00112267.htm Чарикова Е.В «Гипопроакцелеринемия:генетика; дефицит фактора V; тромбофилия V (заболевание)»
4. http://www.clinlab.info/Plasma_coagulation_factors.shtml
5. http://www.pynny.ru/services-and-rates/179
6. http://ru.wikipedia.org/wiki/Факторы_свертывания_крови
Приложения
Приложение 1
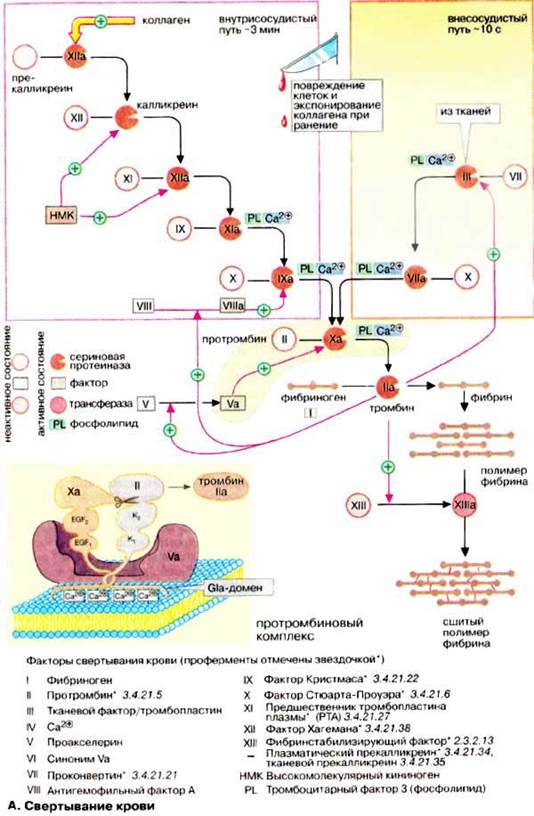
Схема образования кровяного сгустка
Приложение 2
 Расположение гена FV на длинном плече 1
Расположение гена FV на длинном плече 1
хромосомы в позиции 23