Синдром Вольфа-Паркинсона-Уайта
Синдром слабости синусового узла
Синдром слабости синусового узла (СССУ, синдром дисфункции синусового узла) – нарушение ритма, вызванное ослаблением или прекращением функции автоматизма синусно-предсердного узла. При СССУ нарушается образование и проведение импульса из синусового узла в предсердия, что проявляется брадикардией и сопутствующими эктопическими аритмиями. У пациентов с СССУ возможно наступление внезапной остановки сердечной деятельности.
Синдромом слабости синусового узла в основном страдают пожилые пациенты (старше 60-70 лет), как мужчины, так и женщины, хотя СССУ также встречается у детей и подростков. Распространенность данного вида аритмии в общей популяции составляет от 0,03 до 0,05%.
Помимо истинной дисфункции синусового узла, связанной с его органическим поражением, встречаются вегетативные и медикаментозные нарушения функции автоматизма, устраняющиеся лекарственной денервацией сердца либо отменой препаратов, ведущих к подавлению образования и проведения импульса.
Синусовый (синусно-предсердный) узел является генератором импульсов и водителем сердечного ритма первого порядка. Он расположен в зоне устья верхней полой вены в правом предсердии. В норме в синусовом узле зарождаются электрические импульсы с частотой 60—80 в 1минуту. Синусовый узел состоит из ритмогенных пейсмекерных клеток, обеспечивающих функцию автоматизма. Деятельность синусно-предсердного узла регулирует вегетативная нервная система, что проявляется изменениями сердечного ритма сообразно гемодинамическим потребностям организма: учащением сердечных сокращений при физической нагрузке и замедлением в покое и в период сна.
При развитии синдрома слабости синусового узла возникает периодическая или постоянная утрата синусно-предсердным узлом ведущей позиции в формировании сердечного ритма.
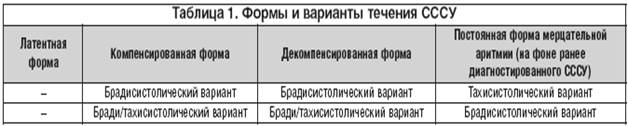
Классификация СССУ
По особенностям клинического проявления выделяют следующие формы синдрома слабости синусового узла и варианты их течения:
1. Латентная форма – отсутствие клинических и ЭКГ-проявлений; дисфункция синусового узла определяется при электрофизиологическом исследования. Ограничений трудоспособности нет; имплантация электрокардиостимулятора не показана.
2. Компенсированная форма:
Ø брадисистолический вариант – слабо выраженные клинические проявления, жалобы на головокружение и слабость. Может быть профессиональное ограничение трудоспособности; имплантация электрокардиостимулятора не показана.
Ø брадитахисистолический вариант – к симптомам брадисистолического варианта добавляются пароксизмальные тахиаритмии. Имплантация электрокардиостимулятора показана в случаях декомпенсации синдрома слабости синусового узла под влиянием противоаритмической терапии.
3. Декомпенсированная форма:
Ø брадисистолический вариант – определяется стойко выраженная синусовая брадикардия; проявляется нарушением церебрального кровотока (головокружением, обморочными состояниями, преходящими парезами), сердечной недостаточностью, вызванной брадиаритмией. Значительное ограничение трудоспособности; показаниями к имплантации служат асистолия и время восстановления функции синусового узла (ВВФСУ) более 3 секунд.
Ø брадитахисистолический вариант (синдром Шорта) – к симптомам брадисистолического варианта декомпенсированной формы добавляются пароксизмальные тахиаритмии (суправентрикулярная тахикардия, мерцание и трепетание предсердий). Пациенты полностью нетрудоспособны; показания к имплантации электрокардиостимулятора те же, что и при брадисистолическом варианте.
4. Постоянная брадисистолическая форма мерцательной аритмии (на фоне ранее диагностированного синдрома слабости синусового узла):
Ø тахисистолический вариант – ограничение трудоспособности; показаний к имплантации электрокардиостимулятора нет.
Ø брадиситолический вариант - ограничение трудоспособности; показаниями к имплантации электрокардиостимулятора служат церебральная симптоматика и сердечная недостаточность.
Развитию брадисистолической формы мерцательной аритмии может предшествовать любая из форм дисфункции синусового узла.
В зависимости от регистрации признаков слабости синусового узла при холтеровском ЭКГ-мониторировании выделяют латентное (признаки СССУ не выявляются), интермиттирующее (признаки СССУ выявляются при снижении симпатического и возрастании парасимпатического тонуса, например, в ночные часы) и манифестирующее течение (признаки СССУ выявляются при каждом суточном ЭКГ-мониторировании).
Синдром слабости синусового узла может протекать остро и хронически, с рецидивами. Острое течение синдрома слабости синусового узла часто наблюдается при инфаркте миокарда. Рецидивирующее течение СССУ может быть стабильным или медленно прогрессирующим.
По этиологическим факторам различаются первичная и вторичная формы синдрома слабости синусового узла: первичная вызывается органическими поражениями синусно-предсердной зоны, вторичная — нарушением ее вегетативной регуляции.
Этиология
К случаям первичного синдрома слабости синусового узла относится дисфункция, вызванная органическими поражениями синоатриальной зоны при:
Ø кардиальной патологии - ИБС, гипертонической болезни, кардиомиопатии, пороках сердца, миокардитах, хирургических травмах и трансплантации сердца;
Ø идиопатических дегенеративных и инфильтративных заболеваниях;
Ø гипотиреозе, дистрофии костно-мышечного аппарата, старческом амилоидозе, саркоидозе, склеродермическом сердце, злокачественных опухолях сердца, в стадии третичного сифилиса и др.
Ишемия, вызванная стенозом артерии, питающей синусовый узел и синоатриальную зону, воспаление и инфильтрация, кровоизлияние, дистрофия, локальный некроз, интерстициальный фиброз и склероз вызывают развитие на месте функциональных клеток синусно-предсердного узла соединительной ткани.
Вторичный синдром слабости синусового узла обусловлен внешними (экзогенными) факторами, воздействующими на синусный узел. К экзогенным факторам относят гиперкалиемию, гиперкальциемию, лечение лекарственными препаратами, снижающими автоматизм синусового узла (b-адреноблокаторами, клофелином, допегитом, резерпином, кордароном, верапамилом, сердечными гликозидами и др.).
Особо среди внешних факторов выделяют вегетативную дисфункцию синусового узла (ВДСУ). ВДСУ часто наблюдается в связи с гиперактивацией блуждающего нерва (рефлекторной или длительной), вызывающей урежение синусового ритма и удлинение рефрактерности синусового узла.
Тонус блуждающего нерва может повышаться при физиологических процессах: во сне, во время мочеиспускания, дефекации, кашля, глотания, тошноты и рвоты, пробы Вальсальвы. Патологическая активация блуждающего нерва может быть связана с заболеваниями глотки, мочеполового и пищеварительного трактов, имеющих обильную иннервацию, а также при гипотермии, гиперкалиемии, сепсисе, повышении внутричерепного давления.
ВДСУ чаще наблюдается у подростков и молодых людей в связи со значительной невротизацией. Стойкий синусовый брадикардический ритм также может отмечаться у тренированных спортсменов в связи с выраженным преобладанием вагусного тонуса, однако, такая брадикардия не является признаком синдрома слабости синусового узла, т. к. нарастание частоты сердечных сокращений происходит адекватно нагрузке. Вместе с тем, у спортсменов может развиваться истинная СССУ в сочетании с другими нарушениями ритма, обусловленные дистрофией миокарда.

Клиника
Варианты клинического течения синдрома слабости синусового узла разнообразны. У части пациентов клиника СССУ длительный период времени может отсутствовать, у других отмечаются выраженные нарушения ритма, сопровождающиеся в тяжелых случаях головными болями, головокружением, синдромом Морганьи-Адамса-Стокса. Возможно расстройство гемодинамики в результате уменьшения ударного и минутного объема выброса, сопровождающихся, в том числе, развитием кардиальной астмы, отека легких, коронарной недостаточностью (стенокардией, реже – инфарктом миокарда).
В клинике синдрома слабости синусового узла выделяют две основные группы симптомов: церебральные и кардиальные.
Церебральная симптоматика при маловыраженных нарушениях ритма проявляется усталостью, раздражительностью, забывчивостью, эмоциональной лабильностью. У пожилых пациентов наблюдается снижение интеллекта и памяти.
При прогрессировании СССУ и недостаточности мозгового кровообращения церебральная симптоматика нарастает. Развиваются предобморочные состояния и обмороки, которым предшествует появление шума в ушах, резкой слабости, ощущение замирания или остановки сердца. Обмороки кардиального генеза при синдроме Морганьи-Эдемс-Стокса протекают без предвестников и судорог (исключение – случаи длительной асистолии).
Кожные покровы бледнеют, холодеют, покрываются холодным потом, АД резко снижается. Провоцировать обмороки может кашель, резкий поворот головы, ношение тесного воротника. Обычно обмороки проходят самостоятельно, однако при затяжных обморочных состояниях может потребоваться оказание неотложной помощи.
Выраженная брадикардия может вызывать дисциркуляторную энцефалопатию, характеризующуюся усилением головокружения, появлением мгновенных провалов в памяти, парезов, «проглатыванием» слов, раздражительностью, инсомнией, снижением памяти.
Кардиальные проявления синдрома слабости синусового узла начинаются с ощущений пациентом замедленного или нерегулярного пульса, болей за грудиной (в связи с недостатком коронарного кровотока). Присоединяющиеся аритмии сопровождаются сердцебиением, перебоями в работе сердца, одышкой, слабостью, развитием хронической сердечной недостаточности.
При прогрессировании СССУ нередко присоединяется вентрикулярная тахикардия или фибрилляция, повышающие вероятность развития внезапной сердечной смерти.
Среди других органических проявлений синдрома слабости синусового узла могут отмечаться олигурия, обусловленная почечной гипоперфузией; нарушения со стороны желудочно-кишечного тракта, перемежающаяся хромота, мышечная слабость в связи с недостаточностью оксигенации внутренних органов и мышц.
Объективно выявляются синусовая брадикардия (особенно ночная), сохраняющаяся при физической нагрузке, синоаурикулярная блокада и эктопические ритмы (мерцание и трепетание предсердий, пароксизмальная тахикардия, суправентрикулярная, реже желудочкая экстрасистолия). После периода эктопических ритмов восстановление нормального синусового ритма замедлено и наступает после предшествующей длительной паузы.

Диагностика
Наиболее характерным признаком синдрома слабости синусового узла служит брадикардия, встречающаяся в 75% случаев, поэтому предположить наличие СССУ следует у любого пациента с выраженным урежением сердечного ритма.
Установление наличия брадикардии производится при помощи ЭКГ-регистрации ритма во время появления характерной симптоматики. В пользу синдрома слабости синусового узла могут свидетельствовать следующие электрокардиографические изменения: синусовая брадикардия, синоатриальная блокада, остановка деятельности синусового узла, депрессия синусового узла в постэкстрасистолический период, синдром тахи-брадикардии, внутрипредсердная миграция водителя ритма.
В диагностике преходящей брадикардии используется холтеровское суточное мониторирование ЭКГ на протяжении 24-72 часов. Мониторирование с большей вероятностью и частотой позволяет зафиксировать вышеозначенные феномены, проследить их связь с нагрузкой и реакцию на лекарственные препараты, выявить бессимптомное течение синдрома слабости синусового узла.
Для диагностики СССУ применяется атропиновая проба: при синдроме слабости синусового узла после введения 1 мл 0,1% атропина частота синусового сердечного ритма не превышает 90 ударов в минуту.
Следующим этапом диагностики СССУ служит ЭФИ - электрофизиологическое исследование. Путем введения чрезпищеводного электрода (ЧПЭКГ) пациенту проводится стимуляция ритма до 110-120 в мин., и после прекращения стимуляции по ЭКГ оценивается скорость восстановления синусовым узлом ритма сокращений. При паузе, превышающей 1,5 см, можно предположить наличие синдрома слабости синусового узла.
При выявлении измененной функции синусового узла проводится дифференциальная диагностика между истинным СССУ, обусловленным органическим поражением водителя ритма, и вегетативной или медикаментозной дисфункцией синусового узла.
Для выявления кардиопатологии проводится УЗИ сердца, КТ и МРТ сердца.
Лечение
Объем лечебных мероприятий при синдроме слабости синусового узла зависит от степени нарушения проводимости, остроты нарушения ритма, этиологии, выраженности клинической симптоматики.
При отсутствии или минимальных проявлениях СССУ проводится терапия основного заболевания и динамическое наблюдение кардиолога.
Медикаментозное лечение СССУ проводится при умеренных проявлениях бради- и тахиаритмий, однако, оно малоэффективно.
Основным методом лечения синдрома слабости синусового узла является постоянная электрокардиостимуляция. При выраженной клинике СССУ, вызванной брадикардией, удлинении ВВФСУ до 3-5 сек., наличии признаков хронической сердечной недостаточности показана имплантация электрокардиостимулятора, работающего в demand-режиме, т. е. вырабатывающего импульсы при падении частоты сердечных сокращений до критических показателей.
Абсолютными показаниями к электрокардиостимуляции служат:
Ø хотя бы однократное возникновение приступа Морганьи-Адемса-Стокса;
Ø брадикардия < 40 уд. в мин., ВВФСУ более 3 сек.;
Ø головокружения, пресинкопальные состояния, коронарная недостаточность, высокая артериальная гипертензия;
Ø сочетание брадикардии с другими видами аритмий, требующих назначения противоаритмических препаратов, что невозможно при нарушении проводимости.

Прогноз
Течение синдрома слабости синусового узла обычно имеет тенденцию к прогрессированию, поэтому в отсутствии лечения клиническая симптоматика усугубляется. Неблагоприятно на прогноз СССУ влияют имеющиеся органические заболевания сердца.
В значительной мере прогноз СССУ определяется проявлением дисфункции синусового узла. Наиболее неблагоприятным сочетанием является синусовая брадикардия и предсердные тахиаритмии; менее неблагоприятный прогноз – при сочетании с синусовыми паузами; удовлетворительный – наличие изолированной синусовой брадикардии. Такой прогноз обусловлен вероятностью развития тромбоэмболических осложнений при каждом из вариантов течения, являющихся причиной летальности у 30-50% пациентов с синдромом слабости синусового узла.
В целом СССУ увеличивает процент летальности в среднем на 4-5% ежегодно, причем развитие внезапной сердечной смерти может наступить в любой из периодов заболевания.
Продолжительность жизни пациентов с СССУ при отсутствии лечения вариабельна и может составлять от нескольких недель до 10 и более лет.
Профилактика
Основные принципы профилактики синдрома слабости синусового узла сводятся к правилам здорового образа жизни.
Ø Отказ от алкоголя и табака.
Ø Рациональное и сбалансированное питание (употребление в пищу продуктов с высоким содержанием клетчатки (овощи, фрукты, зелень), калия и магния (мед, курага, тыква, кабачки, грецкие орехи)). Есть нужно 5-6 раз в день небольшими порциями, исключить прием пищи на ночь. Следует ограничить прием крепкого чая и кофе.
Ø Регулярная физическая активность. Профилактика фибрилляции предсердий включает умеренную физическую активность: утреннюю зарядку, прогулки на свежем воздухе, плавание. По рекомендации врача в спортивную программу можно включать ходьбу на лыжах, бег трусцой.
Ø Исключение интенсивных психоэмоциональных нагрузок (стрессы, конфликтные ситуации на работе и дома). Для устранения волнения можно принимать седативные (успокаивающие) препараты растительного происхождения: настои валерианы, пустырника и т.д. Для хорошего самочувствия полезно отдыхать в дневное время, спать ночью.
Ø Контроль нормальной массы тела.
Ø Контроль уровня сахара крови.
Ø Отказ от бесконтрольного приема препаратов.
Синдром Вольфа-Паркинсона-Уайта
Синдром Вольфа Паркинсона Уайта (аббревиатура — WPW) — одна из главных причин нарушений сердечного ритма. На сегодняшний день более половины всех катетерных процедур составляют операции по деструкции дополнительных атриовентрикулярных соединений. Синдром распространен среди лиц всех возрастов, в том числе детей. До 70% страдающих синдромом — практически здоровые люди, поскольку изменения, происходящие при WPW не оказывают влияния на гемодинамику.
Этиология
По своей сути синдром WPW представляет собой преждевременного возбуждение желудочка, зачастую со склонностью к наджелудочковой тахикардии, трепетанию и мерцанию предсердий, фибрилляции. Наличие синдрома вызвано проводимостью возбуждения по дополнительным пучкам, которые выступают как соединители между предсердиями и желудочками. Существует два анатомических варианта синдрома:
v с добавочными АВ-волокнами:
Ø через левое париетальное АВ соединение;
Ø через аортально-митральное фиброзное соединение;
Ø от ушка левого предсердия;
Ø нижние парасептальные;
Ø верхние парасептальные;
Ø через правое париетальное АВ соединение;
Ø связанные с аневризмой коронарного синуса или средней вены сердца;
Ø от ушка правого предсердия;
Ø
v со специализированными АВ-волокнами:
Ø входящие в правую ножку пучка Гиса (атрио-фасцикулярные);
Ø входящие в миокард правого желудочка.
Наиболее часто синдром WPW связан с добавочными АВ соединениями, похожими по структуре на рабочий миокард и не обладающими декрементными свойствами, то есть работающими по принципу «все или ничего».
Классификация
Ø Манифестирующий синдром WPWустанавливается пациентам при наличии сочетания синдрома предвозбуждения желудочков (дельта волна на ЭКГ) и тахиаритмии. Среди пациентов с синдромом WPW самая распространенная аритмия атриовентрикулярная реципрокная тахикардия (АВРТ). Термин «реципрокная» является синонимом термина «re-entry» – механизма данной тахикардии.
Ø Скрытый синдром WPW устанавливается, если на фоне синусового ритма у пациента отсутствуют признаки предвозбуждения желудочков (интервал PQ имеет нормальное значение, нет признаков ∆-волны), тем не менее имеется тахикардия (АВРТ с ретроградным проведением по ДПЖС).
Ø Множественный синдром WPW устанавливается, если верифицируются 2 и более ДПЖС, которые участвуют в поддержании re-entry при АВРТ.
Ø Интермиттирующий синдром WPW характеризуется преходящими признаками предвозбуждения желудочков на фоне синусового ритма и верифицированной АВРТ.
Ø Феномен WPW.Несмотря на наличие дельта волны на ЭКГ, у некоторых пациентов возможно отсутствие аритмии. В этом случае ставится диагноз феномен WPW (а не синдром WPW).
Клиника
У большинства пациентов не обнаруживается никаких проявлений синдрома. Это затрудняет диагностирование, что приводит к тяжелым нарушениям: экстрасистолия, трепетание и мерцание предсердий.
У больных с более отчетливой клинической картиной, основным проявлением заболевания (50% исследованных случаев) является пароксизмальная тахиаритмия. Последняя проявляется в фибрилляции предсердий (у 10-40% пациентов), наджелудочковой реципрокной тахиаритмии (у 60-80% пациентов), трепетании предсердий (5% случаев).
В некоторых случаях признаки преждевременного возбуждения желудочков преходящи (транзиторный или преходящий синдром WPW). Случается, предвозбуждение желудочков проявляется лишь в результате целенаправленных воздействий — чреспищеводная стимуляция предсердий, либо после введения финоптина или АТФ (латентный синдром WPW). В ситуациях, когда пучок способен быть проводником импульсов лишь в ретроградном направлении, говорят о скрытом синдроме WPW.
Диагностика
Явный синдром имеет ряд типичных ЭКГ-признаков:
Ø Короткий интервал P — R (P — Q) — менее 0,12 с.
Ø Волна Δ. Её появление связано со «сливным» сокращением желудочков (возбуждение желудочков сначала через дополнительный проводящий путь, а затем через AB-соединение). При быстром проведении через AB-соединение волна Δ имеет больший размер. При наличии AB-блокады желудочковый комплекс полностью состоит из волны Δ, так как возбуждение на желудочки передается только через дополнительный путь.
Ø Расширение комплекса QRS более 0,1 с за счет волны Δ.
Ø Тахиаритмии: ортодромная и антидромная наджелудочковые тахикардии, фибрилляция и трепетание предсердий. Тахиаритмии возникают обычно после наджелудочковой экстрасистолы.
Иногда на ЭКГ фиксируется переходящий синдром WPW. Это говорит о том, что попеременно функционируют оба пути проведения импульса — нормальный (АВ-путь) и дополнительный (пучок Кента). В таком случае видны то нормальные комплексы, то деформированные.
Однако наиболее достоверными и точными являются методы внутрисердечного электрофизиологического исследования, в частности эндокардиальное (предоперационное) и эпикардиальное (интраоперационное) картирование. При этом с помощью сложной методики определяют область наиболее ранней активации (предвозбуждения) миокарда желудочков, которая соответствует локализации дополнительного аномального пучка.
Лечение
Терапию синдрома WPW можно разделить на три части. Первая – экстренное или неотложное купирование пароксизмов тахикардии. Вторая – терапия для профилактики приступов и третья – радикальное устранение субстрата тахикардии. Необходимость и выбор планового лечения определяется частотой приступов и их тяжестью, наличием сопутствующей патологии, особенностями аномального проведения и наличием риска внезапной смерти, а также желанием пациента и спецификой его профессиональной деятельности.
Для лечения больных, страдающих синдромом WPW в сочетании с ФП, возможно использование медикаментозных средств, электрической кардиоверсии или хирургических методов. Если приступы тахиаритмий не сопровождаются гемодинамическими нарушениями, то возможно применение антиаритмических препаратов (ААП) IA, IC и III классов, способных блокировать проведение по ДПП. Если же у пациента развиваются нарушения гемодинамики, то методом выбора является РЧА или операция на открытом сердце.
Согласно рекомендациям Американской коллегии кардиологов, Американской ассоциации сердца и Европейского общества кардиологов (2006), основными медикаментозными средствами для лечения синдрома WPW в сочетании с ФП являются
ААП IA класса – прокаинамид, дизопирамид, хинидин,
IC класса – пропафенон и флекаинид, а также
III класса – ибутилид, соталол и амиодарон.
ААП IA, IC и III классов изменяют электрофизиологические свойства миокарда предсердий – удлиняют время реполяризации кардиомиоцитов, тем самым увеличивая продолжительность эффективного рефрактерного периода, либо увеличивают время их деполяризации, снижая скорость проведения импульсов, что приводит к увеличению длины волны re-entry. Это сопровождается снижением ЧСЖ и восстановлением синусового ритма при пароксизме ФП.
ААП I класса, подавляя транспорт ионов натрия через «быстрые» натриевые каналы клеточной мембраны кардиомиоцитов, снижают скорость деполяризации и увеличивают время реполяризации клеток миокарда, удлинняя таким образом их потенциал действия, что сопровождается замедлением проведения импульса по проводящей системе сердца и уменьшением ЧСЖ. Кроме того, они удлиняют эффективный рефрактерный период ДПП и блокируют проведение (в большей степени антероградное) по пучку Кента.
В отличие от других препаратов этого класса, хинидин также уменьшает поступление ионов кальция в кардиомиоциты, что приводит к снижению возбудимости миокарда. С другой стороны, благодаря выраженной антихолинергической активности этот препарат может даже повышать проводимость в АВ-узле, способствуя тем самым трансформации ФП в ФЖ. Именно поэтому применение хинидина в медицинской практике в настоящее время ограничено.
Дизопирамид в большей степени, чем другие ААП I класса, удлиняет рефрактерный период АВ-узла. Некоторые авторы полагают, что применение этого препарата для лечения приступов ФП у больных с синдромом WPW имеет преимущество перед хинидином и прокаинамидом из-за незначительного аритмогенного эффекта.
ААП IС класса блокируют потенциалзависимые натриевые каналы значительно сильнее, чем ААП IА класса, что приводит к большему замедлению процесса деполяризации клеток миокарда. Благодаря этому они значительно снижают скорость антеро- и ретроградного проведения импульса по ДПП, АВ-узлу и миокарду предсердий, но практически не оказывают влияния на процесс реполяризации и, соответственно, на рефрактерный период кардиомиоцитов.
К сожалению, практически все вышеперечисленные препараты обладают дозозависимым аритмогенным эффектом. При этом ААП IС класса имеют наибольшую аритмогенность. Именно способность провоцировать аритмии является основным ограничивающим фактором длительного профилактического применения препаратов этой группы.
Блокируя калиевые каналы кардиомиоцитов, ААП III класса значительно удлиняют процесс реполяризации и, соответственно, рефрактерный период кардиомиоцитов предсердий и желудочков, клеток пучка Гиса, волокон Пуркинье, а также антеро- (в большей степени) и ретроградный рефрактерные периоды ДПП. Благодаря этим свойствам указанные препараты успешно восстанавливают синусовый ритм у большинства больных с ФП на фоне синдрома WPW.
Амиодарон, помимо угнетения калиевых каналов, блокирует также натриевые и кальциевые каналы кардиомиоцитов, благодаря этому он обладает более выраженным антиаритмическим действием по сравнению с другими ААП III класса.
Медикаментозное лечение больных с пароксизмами ФП, не всегда успешно и, как правило, требует постоянного приема ААП. Следует помнить, что ряд препаратов (блокаторы медленных кальциевых каналов, β-адреноблокаторы, сердечные гликозиды) может увеличивать рефрактерный период АВ-соединения и улучшать проведение импульсов через ДПП, вызывая ФЖ. В связи с этим их применение в таких ситуациях противопоказано.
Согласно рекомендациям Американской коллегии кардиологов, Американской ассоциации сердца и Европейского общества кардиологов (2006), пациентам, у которых медикаментозная терапия неэффективна или ФП протекает с частым желудочковым ответом и связанной с ним гемодинамической нестабильностью, следует выполнять электрическую кардиоверсию для профилактики ФЖ. В целом электрическая кардиоверсия – относительно безопасная лечебная процедура. Однако при ее проведении возможны такие осложнения, как тромбоэмболии, снижение артериального давления, отек легких, увеличение активности ферментов в крови, связанное с повреждением скелетных мышц и миокарда, синусовая брадикардия и повышение температуры тела.
Хирургические методы лечения синдрома WPW предусматривают разрушение ДПП либо с помощью катетера (чаще РЧА), либо во время операции на открытом сердце. Согласно последним (2010) рекомендациям Европейского общества кардиологов, РЧА является основным методом лечения больных с ФП на фоне синдрома WPW. Считают, что она позволяет предотвратить внезапную сердечную смерть у этой категории пациентов (уровень доказательcтв IA). Больным с наличием явных ДПП и перенесшим внезапную сердечную смерть показана ургентная РЧА (IC). Плановую РЧА выполняют «бессимптомным» пациентам (при наличии ДПП по данным стандартной ЭКГ), имеющим высокую вероятность развития ФП или определенный профессиональный риск (пилоты, водители общественного транспорта, спортсмены) (IB). Решение о проведении РЧА «бессимптомным» больным должно приниматься индивидуально в каждом конкретном случае и только после всестороннего обследования и детального обсуждения с пациентом (или членами его семьи) соотношения рисков возникновения внезапной сердечной смерти и осложнений вмешательства (IIaB).
Радиочастотная абляция включает в себя несколько видов, которые разнятся принципом использования катетера. Технологически операции состоит из двух этапов:
· ввод через кровеносный сосуд гибкого и тонкого проводящего катетера к источнику аритмии в полости сердца;
· передача радиочастотного импульса с целью разрушения патологического участка ткани сердечной мышцы.
Операции проводятся под анестезией исключительно в стационарных условиях. Поскольку операция малоинвазивна, она показана даже лицам пожилого возраста. В результате применения радиочастотной абляции зачастую наступает полное выздоровление пациента.
Пациенты, страдающие синдромом WPW, должны периодически наблюдаться у кардиохирурга или аритмолога. Профилактика заболевания в виде антиаритмической терапии хотя и важна, но вторична.
Профилактика
Существуют два основных пути предупреждения повторных эпизодов ФП у больных с синдромом WPW: фармакологический и хирургический. Первый подход предполагает длительный прием ААП. На сегодняшний день по ряду причин, этот путь не является оптимальным:
1) аритмии при синдроме WPW отличаются высокой частотой ритма и связаны с потенциальной угрозой для жизни, а ответ на медикаментозную терапию вариабелен и непредсказуем;
2) некоторые препараты могут парадоксально увеличивать частоту пароксизмов или ЧСЖ во время эпизодов тахикардии;
3) нельзя не считаться и с риском развития системных побочных эффектов, например, дисфункции щитовидной железы, фотосенсибилизации или поражения легких при приеме амиодарона;
4) синдром WPW часто встречается у детей и лиц молодого возраста, у которых продолжительное применение ААП особенно нежелательно. Именно поэтому основным методом профилактики рецидивов ФП при синдроме WPW является РЧА ДПП.
Учитывая, что даже при бессимптомном течении синдрома WPW имеется риск возникновения ФП, рекомендуют постоянно наблюдать за такими пациентами и, особенно, за спортсменами.
Литература
1. Сычев О.С. Нарушения ритма сердца // Руководство по кардиологии / Под ред. В.Н. Коваленко. – К.: Морион, 2008.
2. Ватутин Н.Т., Калинкина Н.В. Синдром преждевременного возбуждения желудочков // Синдромы в кардиологии.– Донецк: Каштан, 2010.– С. 146–147.
3. Интернет-источники:
https://www.weblancer.net/users/weisser/portfolio/1884284.html
http://www.rmj.ru/articles_8441.htm
http://www.eurolab.ua/encyclopedia/565/43960/
http://www.evrika.ru/show/8065