ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
(ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ)
Все химические процессы сопровождаются энергетическими эффектами, т.е. выделением или поглощением энергии в том или ином виде.
Изучением энергетических эффектов химических реакций занимается термохимия. Термохимия – это раздел термодинамики, изучающий энергетические эффекты различных химических процессов, направление и пределы их самопроизвольного протекания.
Термодинамические свойства системы можно выразить с помощью нескольких функций состояния системы. Важная особенность функций состояния – их независимость от способа достижения данного состояния системы. Функции состояния:U – внутренняя энергия, H - энтальпия, S - энтропия и G – изобарно-изотермический потенциал или энергия Гиббса.
В любом процессе соблюдается закон сохранения энергии, выражаемый равенством:
Q=DU+А (1)
где Q- теплота (неупорядоченная форма передачи энергии);
DU - внутренняя энергия;
А- работа (упорядоченная форма передачи энергии).
Выражение (1) является математическим выражением первого законатермодинамики.Из выражения (1) следует, что теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии (DU) и на совершение работы (А).
Под работой подразумевается сумма всех видов работы против сил, действующих на систему со стороны внешней среды. Это работа против сил внешнего электрического поля, против сил гравитационного поля, работа расширения и т.д.
Для химических взаимодействий наиболее характерна работа расширения:
А =Р •DV (2)
Тогда выражение (1) записывается так:
Qp=DU+pDV (3)
т.к. DU=U2-U1 и DV=V2-V1, то
Qp=(U2-U1)+р(V2-V1)=(U2+рV2)-(U1+рV1) (4)
Сумму (U+рV)- называют энтальпиейсистемы
Н=U+pV (5)
Подставив (5) в выражение (4), получим:
Qp=H2-H1=DH (6)
Энтальпия (Н) – функция состояния (т.к. из выражения (6) видно, что значение Н зависит от конечного и начального состояния системы), которая характеризует теплосодержание системы.
Так же как и для внутренней энергии, абсолютное значение энтальпии системы экспериментально определить невозможно, но можно найти изменение энтальпии при переходе системы из одного состояния в другое.
При экзотермических процессах энтальпия уменьшается (DН<0), а при эндотермических – увеличивается (H>0).
В основе термохимических расчетов лежит Закон Гесса:тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
В основе большинства расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом сумм энтальпий образования исходных веществ.
(7).
Уравнение (7) позволяет определить как тепловой эффект реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Энтропию системы S можно рассматривать как меру неупорядоченности ее состояния.
Энтропия, как и энтальпия, и внутренняя энергия – функция состояния системы, поэтому изменение энтропии DS в ходе превращения системы определяется только начальным и конечным состоянием системы и не зависит от пути протекания процесса.
Процессы, при которых ΔS>0:
1). Расширение газов;
2). Фазовые превращения, при которых вещество переходит от твердого к жидкому и газообразному состояниям;
3). Растворение кристаллических веществ и т.д.
Процессы, при которых ΔS<0:
1). Сжатие газов:
2). Конденсация и кристаллизация веществ и т.д.
Поскольку энтропия S есть функция состояния, то изменение энтропии DS (химической реакции), равно разности между значениями абсолютной энтропии продуктов и реагентов при температуре и давлении, при которых протекает реакция. Для химической реакции в стандартных условиях:
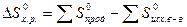
Многие процессы протекают без подвода энергии извне. Такие процессы называются самопроизвольными. Примерами самопроизвольных химических процессов могут служить образование ржавчины на металлах, растворение солей в воде и т.д. Чтобы управлять такими процессами, необходимо знать, каковы движущие силы и критерии самопроизвольных химических реакций. В любом химическом процессе проявляются две тенденции:
1) Стремление к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы. Эта тенденция при изобарно-изотермических условиях характеризуется энтальпийным фактором процесса и количественно выражается через DН.
2) Стремление к разъединению частиц, к беспорядку, которое характеризуется возрастанием энтропии. Данная тенденция характеризуется энтропийным фактором и количественно выражается произведением Т×DS.
Эти факторы, которые характеризуют две противоположные тенденции процесса не могут по отдельности быть критериями самопроизвольного протекания процесса.
Критерием принципиальной осуществимости процессов, протекающих в закрытой системе при T=const и P=const, является изменение в ходе процесса термодинамической функции состояния, называемой изобарно-изотермическим потенциалом (G)
DG=H-TDS
Или просто изобарным потенциалом (синонимы: энергия Гиббса, свободная энергия).
Условия принципиальной возможности протекания процесса при постоянных температуре Т и давлении Р: DG<0.Процесс принципиально не возможен в данных условиях, если DG>0.В системе наступает химическое равновесие, если DG=0
DG – функция состояния, т.е. ее значение не зависит от пути протекания процесса, а лишь от исходного и конечного состояния системы. Поэтому
DGх.р. = SDGобрпродуктов - SDGобрисх.веществ
ПРИМЕР 1. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению РСl5(Г) = РСl3(Г) + Сl2(Г).
РЕШЕНИЕ: Когда начнется диссоциация пентахлорида фосфора, в системе установится равновесие РСl5(Г) « РСl3(Г) + Сl2(Г). и нам нужно найти температуру, при которой DG(Х.Р.) = 0. Для этого воспользуемся соотношением DG(Х.Р.) = DН(Х.Р.) — ТDS(Х.Р.),. При DG(Х.Р.) = 0
DН(Х.Р.)
DН(Х.Р.) = ТDS(Х.Р.) Т = —————
DS(Х.Р.)
Величины DНХ.Р. и DSХ.Р. найдем из уравнений функций состояния:
DНХ.Р. = SDН0ПРОД. — SDН0ИСХ. И DSХ.Р. = SS0ПРОД. — SS0ИСХ.
DНХ.Р. = DН0(РСl3(Г)) + DН0(Сl2(Г)) — DН0(РСl5(Г)) Из приложения:
DНХ.Р. = —306,35 + 0 — (—398,94) = 92,59 кДж
DSХ.Р. = S0(РСl3(Г)) + S0(Сl2(Г)) — S0(РСl5(Г)) Из приложения:
DSХ.Р = 311,66 + 222,95 — 352,71 = 181,90 Дж/К = 0,18190 кДж/К
DНХ.Р. 92,59
Т = ——— = ———— = 509 К
DSХ.Р. 0,18190
Следовательно, при температуре ~ 509 К установится равновесие. Выше этой температуры будет доминировать процесс диссоциации пентахлорида фосфора, ниже — процесс его образования.
ПРИМЕР 2:На основании стандартных теплот образования и абсолютных стандартных энтропий веществ (см. приложение 1) вычислите DG0298 реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г).
РЕШЕНИЕ: DG=H-TDS. DН и DS – функции состояния, поэтому
1) DНХ.Р. = SDН0ПРОД. — SDН0ИСХ. , DНХ.Р = DН0(СО2(г)) + DН0(Н2(г)) - DН0(СО(г)) - DН0(Н2О(ж))
Из приложения: DНХ.Р = (-393,51 + 0) – (-110,52 – 285,84) = +2,85 кДж.
2) DSХ.Р. = SS0ПРОД. — SS0ИСХ., DS Х.Р = D S 0(СО2(г)) + D S 0(Н2(г)) - D S 0(СО(г)) - D S 0(Н2О(ж))
Из приложения: DS Х.Р = (213,65 + 130,59) – (197,91 + 69,94 = +76,39 Дж\K = 0,07639кДж/К.
3) DG=H-TDS, где Т = 298К; DG = +2,85 – 298∙0,07639 = -19,91кДж.
Ответ: DG = -19,91кДж.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
21. Проанализируйте энтальпийный и энтропийный факторы в реакции
FеО + Сu ↔ СuО + Fе. Возможна ли эта реакция при стандартных условиях? Можно ли подобрать температуру, выше или ниже которой реакция термодинамически была бы разрешена?
22. При каких температурах начинается восстановление железа
Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г)
23. При какой температуре меняется направление процесса в системе: 4НСl(Г) + О2(Г) ↔ 2Н2О(Г) + 2Сl2(Г)? Хлор или кислород является более сильным окислителем при стандартных условиях?
24. Пользуясь стандартными величинами DG0 химических веществ (приложение), вычислите DG реакций: РbО2(К) + Рb(К) ↔ 2РbО(К) и SnО2(К) + Sn(К) ↔ 2SnО(К). Какие степени окисления более характерны для свинца и олова?
25. При каких температурах возможен процесс восстановления Fе3О4 по уравнению:
Fе3О4(К) + СО(Г) ↔ 3FеО(К) + СО2(Г)? Возможна ли эта реакция при стандартных условиях?
26.Проанализируйте энтальпийный и энтропийный факторы в реакции получения муравьиного альдегида Н2СО(Г) по реакции: СО(Г) + Н2(Г) ↔ Н2СО(Г)Возможна ли эта реакция при стандартных условиях? При каких температурах реакция термодинамически разрешена?
27. Рассчитав ΔG реакций, найдите, какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 — можно получить по реакции взаимодействия соответствующих оксидов с СО2 при стандартных условиях? Какая реакция идет наиболее энергично?
28. При каких температурах возможен процесс восстановления:
Fе2О3(К) + 3Н2(Г) ↔ 2Fе(К) + 3Н2О(Г)?
29. При каких температурах станет возможным протекание реакции: WО3(К) + 3С(ГРАФИТ) ↔ W(К) + 3СО(Г)?
30. Азотное удобрение — нитрат аммония при неосторожном обращении (или умышленно) может самопроизвольно взрываться по реакции NН4NО3(К) ↔ N2О(Г) + 2Н2О(Г).Может ли самопроизвольно разлагаться хлорид аммония по реакции NН4Сl(К) ↔ NН3(Г) + НСl(Г)? Ответ докажите, сопоставив для обеих реакций величины ΔG.
31. При каких температурах хлор может разлагать воду по уравнению: 2Сl2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НСl(Г)? Почему повышение температуры способствует этому процессу?
32. При каких температурах начинается восстановление железа Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г) ?
33. Пользуясь стандартными величинами DG0 химических веществ (приложение), вычислите DG реакций: Fе2О3(К) + Fе(К) ↔ 3FеО(К) и РbО2(К) + Рb(К) ↔ 2РbО(К). Какие степени окисления более характерны для железа и свинца?
34. При каких температурах начинается восстановление железа
Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г) ?
35. Можно ли получить при стандартных условиях кислород по реакциям: 2Сl2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НСl(Г) и 2F2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НF(Г)? На основании полученных данных расположите F2, Сl2 и О2 в ряд по окисляющей способности при н.у.
36. При каких температурах процесс диссоциации хлористого аммония по уравнению: NН4Сl(К) ↔ NН3(Г) + НСl(Г) станет преобладающим? Идет ли он при стандартных условиях?
37. Вычислите, при какой температуреначнется образование пентахлорида фосфора, протекающая по уравнению:
PCl3(г) + Cl2(г) ↔ PCl5(г)
38. Проанализируйте энтальпийный и энтропийный факторы в реакции Fе2О3(К) + 3С(ГРАФИТ) ↔ 2Fе(К) + 3СО(г) При каких температурах реакция термодинамически разрешена?
39. При каких температурах возможно самопроизвольное протекание реакции 2СО(Г) + 2Н2(Г) ↔ СН4(Г) + СО2(Г)?
40.При каких температурах возможно самопроизвольное протекание процесса 2NО(Г) + О2(Г) ↔ 2NО2(Г)
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическим равновесием называется состояние системы, при котором скорость образования продуктов реакции (скорость прямой реакции) равна скорости их превращения в исходные реагенты (скорость обратной реакции).
Скорость химической реакции – изменение количества вещества за единицу времени в единице реакционного пространства.
Таким образом, химическое равновесие—это равновесие динамическое, при котором происходит непрерывное образование и разложение веществ. Концентрации реагентов при установившемся равновесии называются равновесными и обозначают квадратными скобками [ ].
В общем случае для гомогенной реакции вида
аА(г) + вВ(г) ↔ дД (г)+ еЕ(г)
константа равновесия выражается равенством
Кс = [Д]д [Е]е / [А]а [В]в. ( 1 )
В выражение константы равновесия гетерогенной реакции, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются постоянными. Площадь поверхности также не влияет на значение константы равновесия в гетерогенном процессе, потому что и прямая, и обратная реакции протекают на одной площади поверхности.
В общем случае для гетерогенного процесса
аА(г) + вВ(тв) = еЕ(г) + дД(г)
константа равновесия выражается равенством
Кс = [Е]е [Д]д / [А]а (2)
Связь между исходными и равновесными концентрациями реагентов и продуктов реакции показана в таблице:
| Исходная концентрация реагентов | СА | СВ | СД | СЕ | Исходная концентрация продуктов |
| (-) Израсходованная концентрация | ΔСА | ΔСВ | ΔСД | ΔСЕ | ( +) Образовавшаяся концентрация |
| Равновесная концентрация реагентов | [А] | [В] | [Д] | [Е] | Равновесная концентрация продуктов |
Примечание: для реагентов: [А] = СА – ΔСА; для продуктов: [Д] = СД + ΔСД.
ΔСА : ΔСВ : ΔСД : ΔСЕ = а : в : д : е (где а, в, д, е – количество молей веществ А, В, Д, Е, участвующих в реакции).
Если в условии задачи не указаны исходные концентрации продуктов реакции, то они принимаются равными нулю.
РАСЧЕТ КОНСТАНТ РАВНОВЕСИЙ
СисхСА СВ 0 0
аА + вВ = dD + eE
∆∆А ∆В ∆D ∆E
[ ][A] [B] [D] [E]
КС = [D]d[E]e/[A]a[B]b
ТИП 1: СА=1моль/л; СВ=1моль/л; [D]=0,1моль/л; КС=?
Сисх 1 ? 0 0
А + 2В = D + 3E
∆-0,1 -0,2 +0,1 +0,3
[ ]0,9 0,8 0,1 0,3
KC = 0,1 (0,3)3/0,9 (0,8)2=0,005
ТИП 2: CА=1моль/л; [D]=0,1моль/л; КС=1; СВ=?
Сисх 1 ? 0 0
А + 2В = D + 3E
∆-0,1 -0,2 +0,1 +0,3
[ ] 0,9 Х 0,1 0,3
КС = 0,1 (0,3)3/0,9 Х2 =1
СВ = Х + 0,2
ТИП 3: СА=1моль/л; СВ = 1моль/л; КС =1; [ ] = ?
Сисх1 1 0 0
А + В = D + E
∆-Х - 2Х +Х +3Х
[ ]1-Х 1-2Х Х 3Х
КС = Х (3Х)3/(1-Х0(1-2Х)2=1
ПРИМЕР 1:В системе А (г) + 2В(г) = Д(г) равновесные концентрации равны: [А] = 0,06 моль/л, [В] = 0,12 моль/л, [Д] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
РЕШЕНИЕ: Константа равновесия данной реакции выражается уравнением: Кс = [Д] / [А] [В]2.
Подставляя в него данные задачи, получаем:
Кс = 0,216 / 0,06 (0,12)2 = 2,5.
Для нахождения исходной концентрации вещества А учтем, что, согласно уравнению реакции, из 1 моля А образуется 1 моль Д. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества Д, то при этом было израсходовано 0,216 моля А Таким образом, исходная концентрация вещества А равна:
СА = [А] +Δ СА = 0,06 + 0,216 = 0,276 моль/л;
Для нахождения исходной концентрации вещества В, учтем, что согласно уравнению реакции, из 2 молей В образуется 1 моль Д. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества Д, то при этом было израсходовано 0,216·2 = 0,432 моля В. Таким образом, исходная концентрация вещества В равна: СВ = [В] + ΔСВ = 0,21 + 0,432 = 0,552 моль/л.
ОТВЕТ: СА = 0,276 моль/л, СВ = 0,552 моль/л, Кс = 2,5.
Переход системы из одного равновесного состояния к другому называется смещением или сдвигом равновесия.
Характер смещения химического равновесия под влиянием внешних воздействий можно прогнозировать, применяяпринцип Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму.
1. Повышение температуры приводит к смещению химического равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. в сторону эндотермической реакции;
2. Повышение давления вызывает смещение химического равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления;
3. Удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции;
4. Уменьшение концентрации одного из исходных веществ приводит к сдвигу химического равновесия в направлении обратной реакции.
ПРИМЕР 2: Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению PCl5(г)↔ PCl3(г)+ Cl2(Г),∆H = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить химическое равновесие в сторону прямой реакции – разложения РС15?
РЕШЕНИЕ: Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье (см. выше): А) так как реакция разложения РС15 эндотермическая, т.е. протекает с поглощением тепла (∆Н>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
Б) так как в данной системе разложение РС15 ведет к увеличению числа молей газообразных веществ (из одного моля газа образуются два моля газообразных веществ), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
В) чтобы сместить равновесие в сторону прямой реакции (при Т и Р – соnst), можно увеличить концентрацию РС15 или уменьшить концентрацию РС13 или С12.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
41.В гомогенной системе А(г) + 2В (г)↔ С(г) равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
42.Вгомогенной газовой системе А(г)+В(г)↔С(г)+D(г)равновесие установилось при концентрациях: [ В] = 0,05 моль/л и [ С] = 0,02 моль/л. Константа равновесия системы равна 0,4. Вычислите исходные концентрации веществ А и В. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево ? Дайте обоснованный ответ.
43. Равновесие гомогенной системы 4HCI (г) + О2 ↔ 2 Н2О (г) + 2CI2 (г) установилось при следующих концентрациях реагирующих веществ: [Н2О] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [НС1] = 0,20 моль/л; [О2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
44..Вычислите константу равновесия для гомогенной системы
СО(г)+Н2О (г) ↔CO2(г) +Н2 (г) если равновесные концентрации реагирующих веществ: [CO]= 0,004 моль/л; [Н2О]=0,064 моль/л; [СО2] = 0,016 моль/л; [Н2] = 0,016 моль/л. Рассчитайте константу равновесия и исходные концентрации воды и СО? Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
45. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: ССО = 0,10 моль/л; С Н2О= 0,40 моль/л. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
46. Константа равновесия гомогенной системы N2(г) + 3H2(г) ↔ 2NH3(г) при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/ л. Вычислите равновесную и исходную концентрацию азота. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
47. При некоторой температуре равновесие гомогенной системы
2NO(г)+О2(г)↔2NO2(г) установилось при следующих концентрациях реагирующих веществ: [NO] =0,2 моль/л; [О2] = 0,1моль/л; [NO2] = 0,1моль/л. Вычислите константу равновесия и исходные концентрации NO и О2. Изменением каких факторов (Р,С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
48. В гомогенной системе 2NO(г) + Cl2(г) ↔ 2NOCl(г) исходные концентрации оксида азота и хлора составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
49. В гомогенной системе CO(г) + Cl2(г) ↔ COCl2(г) равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3моль/л; [COCl2] = 1,2моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и оксида азота. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
50. При состоянии равновесия в системе N2(г) + 3H2(г) ↔ 2NH3(г) концентрации участвующих веществ равны: [N2] = 3 моль/л; [H2] = 9моль/л; [NH3] = 4 моль/л. Определить исходные концентрации водорода и азота. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
51. Константа равновесия реакции FeO(тв)+ CO(г) ↔ Fe(тв) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли: ССО = 0,05моль/л; ССО2 = 0,01моль/л. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
52. Равновесие в системе Н2(г) + J2(г) ↔ 2HJ(г) установилось при следующих концентрациях: [H2] = 0,025моль/л; [J2] = 0,005 моль/л; [HJ] = 0,09моль/л. Определить исходные концентрации иода и водорода. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
53. При некоторой температуре равновесие в системе 2NO2(г) ↔ 2NO(г) + O2(г) установилось при следующих концентрациях: [NO2] = 0,006моль/л; [NO] = 0,024моль/л. Найти константу равновесия реакции и исходную концентрацию диоксида азота. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
54. После смешивания газов А и В в системе А + В ↔ С + Д устанавливается равновесие при следующих концентрациях: [В] = 0,05моль/л; [С] = 0,02моль/л. Константа равновесия реакции равна 0,04. Найти исходные концентрации веществ А и В. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
55. Найти константу равновесия реакции N2O4(г) ↔ 2NO2(г), если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия продиссоциировало 50% N2O4. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
56. В замкнутом сосуде протекает реакция АВ(г) ↔ А(г) + В(г). Константа равновесия реакции равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось? Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
57. При некоторой температуре равновесные концентрации в системе 2SO2(г) + O2(г) ↔ 2SO3(г) составляли соответственно [SO2]=0,04моль/л, [O2]=0,06моль/л, [SO3]=0,02моль/л. Вычислить константу равновесия и исходные концентрации оксида серы (1V) и кислорода. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
58. Реакция CO(г) + Cl2(г) ↔ COCl2(г) протекает в объеме 20л. Состав равновесной смеси 0,28г СО, 0,355г Cl2 и 0,495г COCl2. Вычислить константу равновесия реакции и исходную концентрацию Сl2. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.
59. При некоторой температуре равновесие в системе 2NO2(г) ↔ 2NO(г) + O2(г) установилось при следующих концентрациях: [NO2] = 0,006моль/л; [NO] = 0,012моль/л. Найти константу равновесия реакции и исходную концентрацию диоксида азота. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы вправо? Дайте обоснованный ответ.
60. В гомогенной системе 2NO(г) + Cl2(г) ↔ 2NOCl(г) исходные концентрации оксида азота и хлора составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 50% NO. Изменением каких факторов (Р, С) можно сместить химическое равновесиеданной системы влево? Дайте обоснованный ответ.