Общие свойства ферментов, механизм действия
Ферменты обладают всеми свойствами белков. Однако по сравнению с белками, выполняющими другие функции в клетке, ферменты имеют ряд специфических, присущих только им свойств.Зависимость активности ферментов от температуры. Температура может влиять по-разному на активность фермента. При высоких значениях температуры может происходить денатурация белковой части фермента, что негативно сказывается на его активности. При определенных (оптимальных) значениях температура может влиять на скорость образования фермент-субстратного комплекса, вызывая увеличение скорости реакции. Температура, при которой каталитическая активность фермента максимальна, называется температурным оптимумом фермента. Различные клеточные ферменты имеют собственные температурные оптимумы, которые определяются экспериментально. Для ферментов животного происхождения температурный оптимум находится в интервале 40 - 50°С.
Зависимость активности фермента от рН-среды. Большинство ферментов проявляет максимальную активность при значениях рН, близких к нейтральным. Лишь отдельные ферменты "работают" в сильно кислой или сильно щелочной среде. Например, активность пепсина - фермента, гидролизующего белки в желудке, - максимальна при рН 1,5 - 2,5. В щелочной среде "работают" ферменты, локализованные в кишечнике. Изменение оптимального для данного фермента значения рН-среды может привести к изменению третичной стурктуры фермента, что скажется на его активности. С другой стороны, при изменении рН может измениться
ионизация субстрата, что повлияет на образование фермент-субстратного комплекса.
Влияние на активность ферментов активаторов и ингибиторов. К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов - Сl-. Катионы действуют на ферменты по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других - способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию.
Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия различных химических соединений разнообразны.
Специфичность действия ферментов - одно из главных их свойств. Специфичность - это избирательность фермента по отношению к субстрату (или субстратам). Специфичность действия ферментов объясняется тем, что субстрат должен подходить к активному центру как "ключ к замку". Это образное сравнение сделано Э.Фишером в 1894 г. Он рассматривал фермент как жесткую структуру, активный центр которой представляет собой "слепок" субстрата. Однако этой гипотезой трудно объяснить групповую специфичность ферментов, т.к. конфигурация "ключей" (субстратов), подходящих к одному "замку", слишком разнообразна. Такое несоответствие получило объяснение в 50-е гг. XX в. в гипотезе Д. Кошланда. Она получила название гипотезы "вынужденного соответствия".
По гипотезе Д. Кошланда, молекула фермента не жесткая, а гибкая, эластичная, поэтому информация фермента и его активного центра может изменяться при присоединении субстрата или других лигандов.
Механизм действия фермента, исходя из работ Брауна, Михаэлиса и Ментен можно представить поэтапно:
1. образование фермент-субстратного комплекса (субстрат прикрепляется к активному центру фермента).
2. на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (Еп) и субстрат (8) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации - энергия, необходимая для перевода всех молекул 1 моля 8 в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер (см. наглядный материал). Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа.
3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне.
7) Классификация и номенклатура ферментов. Общая характеристика классов и основных подклассов.
Номенклатура и классификация ферментов. Современная классификация ферментов основана на природе катализируемых ими химических превращений. В основу классификации берется тип реакции, катализируемой ферментом. Согласно решению, принятому в 1972 г комиссией по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии (IUPAC),
ферменты разделяют на 6 классов:
1. Оксидоредуктазы - катализируют окислительно-восстановительные реакции
2. Трансферазы - перенос групп
3. Гидролазы - гидролиз
4. Лиазы - негидролитическое расщепление субстрата
5. Изомеразы - изомеризация
6. Лигазы (синтетазы)- синтез с использованием энергии (АТФ)
Номенклатура ферментов.
1. Тривиальное название (пепсин, трипсин).
2. Название фермента может складываться из названия субстрата с прибавлением окончания «аза» (аргиназа гидролизует аминокислоту аргинин).
3. Добавление окончания «аза» к названию катализируемой реакции (гидролаза катализирует гидролиз, дегидрогеназа - дегидрирование органической молекулы, т.е. отнятие протонов и электронов от субстрата).
4. Рациональное название - название субстратов и характер катализируемых реакций (АТФ + гексоза гексозо-6-фосфат + АДФ. Фермент: АТФ: ^-гексоза-6-фосфотрансфераза).
5. Индексирование ферментов (каждому ферменту присваиваются 4 индекса или порядковых номера): 1.1.1.1 - АДГ, 1.1.1.27 - ЛДГ.
8) Энергетический обмен, стадии. Связь между отдельными этапами.
Энергетический обмен стадии. Связь между отдельными этапами Энергетический обмен — это совокупность химических реакций постепенного распада органических соединений, сопровождающихся высвобождением энергии, часть которой расходуется на синтез АТФ. Синтезированная АТФ становится универсальным источником энергии для жизнедеятельности организмов. Первый этап — подготовительный. В желудочно-кишечном тракте многоклеточных организмов он осуществляется пищеварительными ферментами. У одноклеточных — ферментами лизосом. На первом этапе происходит расщепление белков до аминокислот, жиров до глицерина и жирных кислот, полисахаридов до моносахаридов, нуклеиновых кислот до нуклеотидов. Этот процесс называют пищеварением.
Второй этап — бескислородный (гликолиз). Происходит в цитоплазме клеток. Главным источником энергии в клетке является глюкоза. Ее бескислородное расщепление называют анаэробным гликолизом. Он состоит из ряда последовательных реакций по превращению глюкозы в лактат. Его присутствие в мышцах хорошо известно уставшим спортсменам.
В ходе гликолиза образуется большое количество энергии, часть которой рассеивается в виде тепла, а часть используется на синтез АТФ.
Суммарное уравнение реакций гликолиза выглядит следующим образом:

Третий этап — кислородный, состоящий из цикла Кребса и окислительного фосфорилирования. Он стал возможным после накопления в атмосфере достаточного количества молекулярного кислорода. Происходит в митохондриях клеток.
9. Общая характеристика и классификация важнейших витаминов. Алиментарные и вторичные гипо-и авитаминозы. Гипервитаминозы.
— группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная по химической природе группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи. Автотрофные организмы также нуждаются в витаминах, получая их либо путём синтеза, либо из окружающей среды. Так, витамины входят в состав питательных сред для выращивания организмов фитопланктона[1]. Большинство витаминов являются коферментами или их предшественниками[2].Витамины содержатся в пище (или в окружающей среде) в очень малых количествах, и поэтому относятся к микронутриентам. К витаминам не относят микроэлементы и незаменимые аминокислоты[2]. По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы. А.ВодорастворимыеВитамин В1 (тиамин);Витамин В2 (рибофлавин);Витамин РР (никотиновая кислота, никотинамид, витамин В3);Пантотеновая кислота (витамин В5);Витамин В6 (пиридоксин);Биотин (витамин Н);Фолиевая кислота (витамин Вс, В9);Витамин В12 (кобаламин);Витамин С (аскорбиновая кислота);Витамин Р (биофлавоноиды).Б. ЖирорастворимыеВитамин А (ретинол);Витамин D (холекальциферол);Витамин Е (токоферол);Витамин К (филлохинон).
Авитаминоз– отсутствие какого-либо витамина или нескольких витаминов (полиавитаминоз). Бывает при неполноценном питании или нарушении работы органов, связанных с пищеварением. А также может быть следствием особенностей обмена веществ в детском и пожилом возрасте. Гиповитаминоз– недостаток витаминов. При недостатке витаминов снижается работоспособность, ухудшается аппетит и ослабевает иммунитет. Появляется раздражительность и постоянная усталость. Если не повысить потребление витаминов, тогда организм не сможет нормально усваивать и извлекать полезные вещества из поступающей пищи, в результате начнет ухудшаться состояние тканей (кожи, мышцы, слизистых) и функции организма (рост, интеллектуальное и физическое развитие). При этом гиповитаминоз может особо не проявляться и длиться годами, нанося вред здоровью.
10. Углеводы пищи и их значение. Переваривание и всасывание углеводов в желудочно-кишечном тракте. Роль печени в обмене углеводов.
. Углеводы пищи и их значение . переваривание всасывание углеводов в жкт и роль печени в обмене углеводов
Суточная норма углеводов в пище составляет 400-500 г. Основными углеводами пищи являются:
1. крахмал - разветвленный гомополисахарид из глюкозы. Мономеры линейных участков соединены -1,4-гликозидными связями, а в местах разветвления -1,6 связями;
2. дисахариды - сахароза (глк-(-1,2)-фру), лактоза (гал-(бета-1,4)-глк), мальтоза (глк-(-1,4)-глк).
При переваривании углеводов в желудочно-кишечном тракте происходит ферментативный гидролиз гликозидных связей и образование моносахаридов, главным из которых является глюкоза. Гидролиз крахмала начинается в полости рта при участии амилазы слюны, которая частично расщепляет внутренние -1,4-гликозидные связи, образуя менее крупные, чем крахмал молекулы - декстрины. Далее гидролиз крахмала продолжается в верхнем отделе кишечника под действием панкреатической амилазы, также расщепляющей -1,4-гликозидные связи. В результате из крахмала образуются дисахаридные остатки мальтозы и изомальтозы (глк-(-1,6)-глк). Гидролиз всех дисахаридов происходит на поверхности клеток кишечника и катализируется специфическими ферментами: сахаразой, лактазой, мальтазой и изомальтазой. Эти гликозидазы синтезируются в клетках кишечника.Всасывание моносахаридов из кишечника в кровь осуществляется путем облегченной диффузии. Если концентрация глюкозы в кишечнике невелика, то ее транспорт может происходить за счет градиента концентрации ионов натрия, создаваемого Na+, K+-AТФ-азой.
Глюкоза играет главную роль в метаболизме, так как именно она является основным источником энергии. Глюкоза может превращаться практически во все моносахариды, в то же время возможно и обратное превращение.
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы вкрови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается При оценке углеводной функции печени необходимо иметь в виду, что соотношение между процессами утилизации и образования глюкозы регулируется прежде всего нейрогуморальным путем при участии желез внутренней секреции.
11) Глюконеогенез. Гликогенолиз. Характеристика и роль этих процессов. Гликогено́лиз — биохимический процесс расщепления гликогена до глюкозы, осуществляется главным образом в печени и мышцах[1] и не требует затрат энергии[2]. Основная задача гликогенолиза — поддержание постоянного уровня глюкозы в крови[3]. Регуляция гликогенолиза осуществляется совместно с регуляцией гликогеногенеза по типу переключения одного на другое. Важнейшими гормонами, участвующими в регуляции гликогеногенеза, являются инсулин, глюкагон и адреналин[4]. Гликоген, запасаемый в тканях животных, и крахмал, запасаемый растениями, могут быть мобилизованы клеткой для получения энергии при помощи гликогенолиза — фосфоролитический реакции, осуществляемой, прежде всего, ферментами гликогенфосфорилазой[en] (или крахмалфосфорилазой[en] у растений).
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
12) Судьба глюкозы и гликогена в клетках.
Попав в клетку, глюкоза сразу же фосфорилируется. Фосфорилирование глюкозы решает сразу несколько задач: фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула отрицательно заряжена и отталкивается от фосфолипидной поверхности мембраны;• наличие заряженной группы обеспечивает правильную ориентацию молекулы в активном центре фермента;• уменьшается концентрация свободной (нефосфорилированной) глюкозы, что способствует диффузии новых молекул из крови. гликоген является основной формой хранения глюкозы в животных клетках. Откладывается в виде гранул вцитоплазме во многих типах клеток (главным образом печени и мышц). При недостатке в организме глюкозы гликоген под воздействием ферментов расщепляется до глюкозы, которая поступает в кровь. Регуляция синтеза и распада гликогена осуществляется нервной системой и гормонами. Наследственные дефекты ферментов, участвующих в синтезе или расщеплении гликогена, приводят к развитию редких синдромов — гликогенозов.
13) Пути распада глюкозы в (гликогена в клетках) тканях, общее представление, отличие и сходство в этих процессах.
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.Этот процесс включает несколько стадий (рис. 7-33).Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата;Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы. Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
14) Роль ЦТК, БО, ОФ в обмене веществ
Обмен веществ – это совокупность тесно связанных между собой противоположных процессов – ассимиляции (анаболизм) и диссимиляции (катаболизм). Обмен веществ включает 4 этапа: 1 этап – переваривание. Это механическое и ферментативное расщепление сложных веществ, которое происходит в ЖКТ под действием соответствующих гидролаз; 2 этап – всасывание – это транспорт продуктов распада из просвета кишечника во внутреннюю среду организма
3 этап – промежуточный обмен – это превращение в клетках или тканях организма всосавшихся веществ; 4 этап – выделение конечных продуктов обмена.
1,,Роль ЦТК – 1) это единственный процесс, где окисляется АУК, 2) в ЦТК сходятся все метаболические процессы, 3) ряд промежуточных продуктов ЦТК используется для синтеза различных веществ, т.е. пластическая роль ЦТК. Так, альфа-КГ является предшественником глу и глн, сукцинилКоА, или АЯК необходима для синтеза порфиринов, ЩУК ключевой продукт глюко[нэо]генеза, 4) источник восстановленных ДГ-аз для БО.
2,,БО является то, что все ферменты сначала восстанавливаются, а затем должны окислиться, т.е. ОР-азы, участвующие в процессе тканевого дыхания, попеременно могут находиться то в окисленном, то в восстановленном состояниях и они обладают ОВП. Расположение ферментов в цепи БО обусловлено величиной ОВП. Они располагаются в порядке повышения ОВП. Наименьшим потенциалом обладают НАД-зависимые ПФ, самый большой ОВП у молекулярного кислорода – показать на табл. Выход энергии на каждом этапе БО зависит от разности ОВП двух соседних ферментативных систем.
БО состоит из следующих стадий – На 1-ом этапе БО происходит окисление субстрата ПФ, при этом НАД восстанавливается. Количество энергии, выделяемой на этом этапе, невелико
3,,ОФ контролирует скорость БО, осуществляя так называемый дыхательный контроль. Дыхательный контроль – это свойство неповрежденных митохондрий. При наличии всех компонентов БО, но при отсутствии АДФ скорость БО замедляется. При большом количестве АДФ и малом содержании АТФ скорость БО увеличивается.
В настоящее время можно доказать тесную связь между БО и ОФ, используя определенные вещества и ряд других факторов – разобщители БО и ОФ, например, нитро- и галогенопроизводные фенолов, некоторые антибиотики, цианиды, СО, тироксин, прогестерон. Различают 4 типа разобщения БО и ОФ – 1) вещества, избирательно увеличивающие проницаемость митохондрий для водорода или ОН (протонофоры – нитрофенолы, СЖК и др.). 2) вещества, увеличивающие проницаемость митохондрий для щелочных и щелочно-земельных катионов. 3) алкилирующие вещества – ковалентно связываются с компонентами ОФ (АДФ, АТФ). 4) факторы, разрушающие мембраны митохондрий – детергенты, ультразвук и др. При разобщении БО и ОФ, энергия, образующаяся в БО, рассеивается в виде тепла, а синтез АТФ резко падает.
Ци́кл трикарбо́новых кисло́т (цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́[1][2]) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные[en] остатки (СН3СО–) окисляются до диоксида углерода
15. Глюконеогенез, возможные предшественники, последовательность реакций. Цикл Кори и глюкозо-аланиновый цикл: физиологическое значение.
Глюконеогенез. Цикл кори и глюкозо- аланиновый цикл: физиологическое значение Цикл Кори — совокупность биохимических ферментативных процессов транспорта лактата из мышц печень, и дальнейшего синтеза глюкозы из лактата, катализируемое ферментами глюконеогенеза. . Глюкозо-аланиновый цикл. Этот цикл выполняет две функции 1) переносит аминогруппы из скелетных мышц в печень, где они превращаются в мочевину, и 2) обеспечивает работающие мышцы глюкозой, поступающей с кровью из печени, где для ее образования используется углеродный скелет аланина.
16. Пентозофосфатный путь окисления глюкозы, сущность, значение, распространение.
Пентозофосфа́тный путь (пентозный путь, гексозомонофосфатный шунт[1], путь Варбурга — Диккенса — Хорекера[2]) — альтернативный путь окисления глюкозы (наряду с гликолизом и путём Энтнера — Дудорова), включает в себя окислительный и неокислительный этапы.Суммарное уравнение пентозофосфатного пути: 3 глюкозо-6-фосфат + 6 NADP+ → 3СО2 + 6 (NADPH + Н+) + 2 фруктозо-6-фосфат[en] + глицеральдегид-3-фосфат[3]. Пентозофосфатный путь распространён у растений и животных, а у большинства микроорганизмов имеет только вспомогательное значение[2]. Ферменты пентозофосфатного пути располагаются в цитозоле и животных, и растительных клеток; кроме того, в клетках млекопитающих они располагаются также в эндоплазматическом ретикулуме, а у растений — в хлоропластах[4].
17. Конечные продукты обмена углеводов. Реакции в результате которых они образуются. Выделение.
Конечными продуктами распада углеводов в тканях являются вода и углекислый газ. Конечными продуктами биологического окисления являются вода и двуокись углерода. Субстратами биологического окисления являются продукты превращений жиров, белков и углеводов. Окисление биологическое — совокупность окислительно-восстановительных реакций, протекающих в биологических объектах. Под процессом окисления понимают потерю веществом электронов или электронов и протонов одновременно (потерю водородных атомов) или присоединение кислорода. Реакции противоположного направления характеризуют процесс восстановления. Восстановителями называют вещества, теряющие электроны, окислителями — вещества, приобретающие электроны. Окисление биологическое составляет основу тканевого, или клеточного, дыхания (процесса, в результате которого ткани и клетки поглощают кислород и выделяют углекислый газ и воду) — главного источника энергии для организма. Веществом, принимающим (акцептирующим) электроны, т. е. восстанавливающимся, является молекулярный кислород, превращающийся в анион кислорода O——. Водородные атомы, отщепляемые от органического вещества — субстрата окисления (SH2), превращаются при потере электронов в протоны или положительно заряженные катионы водорода:
SH2→S→2H; 2Н→2H+ + 2e: ½O2→О; О→2е→O——; 2H+ + O——→H2O+55 ккал. В результате реакции между катионами водорода и анионами кислорода образуется вода, а реакция сопровождается выделением значительного количества энергии на каждые 18 г воды). В качестве побочного продукта биологического окисления образуется углекислый газ.
18. Липиды пищи, биологическое значение, переваривание, всасывание в желудочно-кишечном тракте. Роль и состав мицелл.
С пищей поступает большое количество липидов – 60-80г/сут. Рекомендуется поступление липидов на уровне 30% суточного калоража, причем доля растительных липидов от этого общего количества должна быть не менее 30%. Основными липидами пищи являются следующие:ТАГ – 99% пищевых липидов – 1) энергетический материал, окисление 1 г ТАГ сопровождается выделением 38,9кДж (9,3ккал) энергии. В ТАГах тела здорового человека массой 70кг одновременно заключено 140млнкалорий (140тыс ккал). Это в 100 раз больше, чем может дать весь гликоген организма; 2) источники эндогенной воды, окисление 100 г дает 107мл воды. Это имеет особое значение для животных, впадающих в спячку; 3) механическая, или защитная функция – органы находятся в жировых капсулах; 4) структурная роль – ТАГ в небольших количествах входят в мембраны; 5) ТАГ участвуют в теплорегуляции – плохие проводники тепла.ФЛ делятся на 2 группы: фосфоглицериды (ФХ, ФС, ФЭА, ФИ, кардиолипины, плазмологены) и сфинглилипиды (церамиды и сфингомиелины). Выполняют:структурную роль – из общего количества липидов мембран составляют более 50 % и образуют билипидный слой;входят в состав транспортных форм липидов – мицелл, ХМ и ЛП и участвуют в эмульгировании, переваривании, всасывании и транспорте липидов по организму;
некоторые ФЛ участвуют в свертывании крови, например, ФЭА и ФС;липотропное действие – ФЛ предохранют печень от ожирения;
19. Химия желчи. Строение парных желчных кислот и желчных пигментов. Роль желчных кислот в переваривании и всасывании липидов. Биохимия желчекаменной болезни.
Химия желчи. Строение парных желчных кислот и желчных пигмнтов. Роль желчных кислот в переваривании и всасывании липидов Желчь – жидкий секрет желтовато-коричневого цвета, отделяется печеночными клетками. В сутки у человека образуется 500–700 мл желчи (10 мл на 1 кг массы тела). Желчеобразование происходит непрерывно, хотя интенсивность этого процесса на протяжении суток резко колеблется. Вне пищеварения печеночная желчь переходит в желчный пузырь, где происходит ее сгущение в результате всасывания воды и электролитов Соли желчных кислот обладают способностью значительно уменьшать поверхностное натяжение. Благодаря этому они осуществляют эмульгирование жиров в кишечнике, растворяют жирные кислоты и нерастворимые в воде мыла. Нейтрализация кислоты. Желчь, рН которой немногим более 7,0, нейтрализует кислый химус, поступающий из желудка, подготавливая его для переваривания в кишечнике. Экскреция . Желчь – важный носитель экскрети-руемых желчных кислот и холестерина. Кроме того, она удаляет из организма многие лекарственные вещества, токсины, желчные пигменты и различные неорганические вещества, такие, как медь, цинк и ртуть. Строение парных желчных кислот может быть представлено в следующем виде:

20) Роль стенки кишечника и жировой ткани в обмене липидов.
В обмене липидов участвуют все клетки организма, но особое значение имеют 3 органа и 1 ткань – стенка кишечника, легкие, печень, жировая ткань.
В стенке кишечника происходят следующие процессы обмена липидов: 1) распад мицеллы, 2) b-МАГи используются для липогенеза — ресинтеза ТАГов (образование специфических для организма ТАГов, процесс идет по моноглицеридному пути). Однако в стенке кишечника возможен также синтез ТАГ по фосфатидному пути. 3) a-МАГи подвергаются липолизу до СЖК и глицерина под действием липазы кишечных клеток, 4) образование ХМ, 5) липонеогенез, 6) образование ФЛ (небольшое количество), 7) незначительное образование ЭХ. Роль жировой ткани в обмене липидов. В жировой ткани интенсивно протекает липогенез (образование ТАГов). Это место депонирования ТАГов. Также протекает липонеогенез, образование ФЛ, липолиз. Образованные при липолизе глицерин и СЖК транспортируются кровью к органам и тканям.
21) Роль печени в обмене липидов.
В печень поступают продукты переваривания липидов пищи В печени происходят следующие процессы:
I.анаболические процессы –
липогенез (образование ТАГ), который осуществляется фосфатидным путем,
Синтез ФЛ (80%)3)синтез ХС (80% всего ХС синтезируется в печени),4)преимущественно в печени идет образование ЭХ и только в печени они депонируются,5)синтез кетоновых тел ( только в печени)6)синтез ЛП (только в печени, хотя считается, что ЛПВП также образуются в стенке кишечника)7)синтез СЖК8)липонеогенез
II. катаболические процессы —липолиз;b-окисление СЖК;окисление глицерина;окисление ХС до ЖчК (только в печени).
22) Липогенез, липолиз, липонеогенез, характеристика и роль этих процессов.
Липогенез (Lipogenesis)процесс, при котором глюкоза и другие вещества из содержащихся в пище углеводов превращаются в организме в жирные кислоты Липо́лиз — процесс расщепления жиров на составляющие их жирные кислоты под действием липазы.
Липолиз протекает в митохондриях, куда жирные кислоты доставляются с помощью переносчика — карнитина. В процессе липолиза происходят циклические превращения молекул жирных кислот с отщеплением от них двухуглеродных производных KoA (CH3—CO—SKoA) (β-окисление жирных кислот) или одноуглеродных производных KoA (α-окисление жирных кислот); протекание одного цикла окисления жирной кислоты, сопровождается синтезом по одной молекуле ФАДН и НАДН.Фермент триглицеридлипаза расщепляет триглицериды на диглицериды и жирные кислоты, на следующей стадии активны диглицеридлипаза и моноглицеридлипаза. В результате работы этих ферментов образуются конечные продукты липолиза — глицерин и жирные кислоты.
23. Конечные продукты обмена липидов. Процессы, в результате которых они образуются. Выделение.
Жиры пищи под действием ферментов желудочного, поджелудочного и кишечного соков (при участии желчи) расщепляются на глицерин и ясирные кислоты (последние подвергаются омылению) . Из глицерина и жирных кислот в эпителиальных клетках ворсинок тонкого кишечника синтезируется жир, свойственный организму человека. Жир в виде эмульсии поступает в лимфу, а вместе с ней — в общий кровоток. Суточная потребность в жирах в среднем составляет 100 г. Избыточное количество жира откладывается в соединительнотканной жировой клетчатке и между внутренними органами. При необходимости эти жиры используются как источник энергии для клеток организма. При расщеплении 1 г жира выделяется наибольшее количество энергии — 38,9 кДж. Конечными продуктами распада жиров являются вода и углекисльш газ. Жиры могут синтезироваться из углеводов и белков.
24) Белки пищи, их значение, азотистый баланс, особенности обмена, переваривание и всасывание белков в желудочно-кишечном тракте. Роль составных частей сока в переваривание белков.
Азотистый баланс - это соотношение количества азота, поступившего в организм с пищей и выделенного. Так как основным источником азота в организме является белок, то по азотистому балансу можно судить о соотношении количества поступившего и разрушенного в организме белка. А значит и о наличии или отсутствии мышечного роста. Белки относятся к незаменимым веществам, необходимым для жизни, роста и развития организма. Недостаточность белка в организме приводит к развитию алиментарных заболеваний. Положительный азотистый баланс – это синоним анаболизма, а отрицательный азотистый баланс - синоним катаболизма.
Белки используются как пластический материал для построения различных тканей и клеток организма, а также гормонов, ферментов, антител и специфических белков. Белки — необходимый фон для нормального обмена в организме других веществ, в частности витаминов, минеральных солей.
Белки участвуют и в поддержании энергетического баланса организма. Белки пищи в процессе пищеварения распадаются на аминокислоты, которые, поступая из кишечника в кровь и далее в ткани, используются для синтеза белка организма.
Из 80 известных аминокислот в науке о питании интерес представляют 22—25 аминокислот, которые наиболее часто представлены в белках продуктов питания, используемых человеком.
25) Химический состав, свойства нормального желудочного сока, значение соляной кислоты в желудочном пищеварении. Физико-химические свойства желудочного сока, виды кислотности. Исследования желудочного сока. Определение дебит часа НСІ.
Желудочный сок — сложный по составу пищеварительный сок, вырабатываемый различными клетками слизистой оболочки желудка. Париетальные клетки фундальных желёз желудка секретируют соляную кислоту — важнейшую составляющую желудочного сока. Основные её функции: поддержание определённого уровня кислотности в желудке, обеспечивающего превращение пепсиногена впепсин, препятствование проникновению в организм болезнетворных бактерий и микробов, способствование набуханию белковых компонентов пищи, её гидролиз, стимулирует выработку секрета поджелудочной железы
Бикарбонаты НСО3− необходимы для нейтрализации соляной кислоты у поверхности слизистой оболочки желудка и двенадцатиперстной кишки в целях защиты слизистой от воздействия кислоты.
Пепсин является основным ферментом, с помощью которого происходит расщепление белков. Существует несколько изоформ пепсина, каждая из которых воздействует на свой класс белков. Пепсины получаются из пепсиногенов, когда последние попадают в среду с определённой кислотностью. За продукцию пепсиногенов в желудке отвечают главные клетки фундальных желёз.
Основные химические компоненты желудочного сока:[1]
вода (995 г/л);хлориды (5—6 г/л);сульфаты (10 мг/л);фосфаты (10—60 мг/л);гидрокарбонаты (0—1,2 г/л) натрия, калия, кальция, магния;аммиак (20—80 мг/л
26.Роль печени в обмене белков.
Печень играет центральную роль в обмене белков. Она выполняет следующие основные функции: синтез специфических белков плазмы; образование мочевины и мочевой кислоты; синтез холина и креатина; трансаминирование и дезаминирование аминокислот, что весьма важно для взаимных превращений аминокислот, а также для процесса глюконеогенеза и образования кетоновых тел. Печень является единственным органом, где синтезируются такие важные для организма белки, как протромбин, фибриноген, проконвертин и проакцелерин. При заболеваниях печени определение фракционного состава белков плазмы (или сыворотки) крови нередко представляет интерес как в диагностическом, так и в прогностическом плане Большая часть мочевой кислоты также образуется в печени, где много фермента ксантиноксидазы, при участии которого оксипурины (гипо-ксантин и ксантин) превращаются в мочевую кислоту. Нельзя забывать о роли печени и в синтезе креатина.
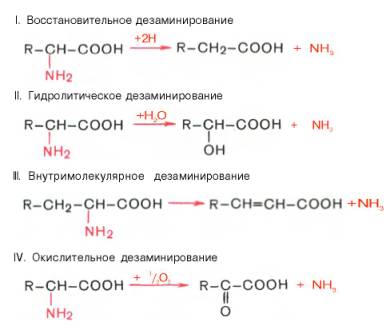
27) Дезаминирование аминокислот в животном организме. Виды, значение процесса.
Дезаминирование — отщепление аминогруппы от аминокислоты, приводящее к выделению азота в виде аммиака, поэтому процесс распада белков, сопровождающийся образованием аммиака, получил название аммонификации. Судьба углеродного скелета аминокислоты при дезаминировании различна. Процесс может происходить при участии молекулярного кислорода
Доказано существование 4 типов дезаминирования аминокислот (отщеплениеаминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
28) Образование и превращение безазотистого остатка аминокислот в тканях.
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез (см. раздел 7). Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими.
29) Пути образования аммиака в организме, его утилизация.
– продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование.
Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке.

30) Конечные продукты обмена белков, процессы в результате которых они образуются, химическая природа, выделение.
Конечные продукты обмена белков. Процессы в результате которых они образуются . хим. Природа. Выделение. Конечными продуктами распада белков в организме являются вода, углекислый газ и азотсодержащие вещества: аммиак, мочевая кислота и др. Аммиак, являющийся для организма вредным веществом, в печени превращается в мочевину, Продукты распада белков, как и других питательных веществ, выводятся из организма наружу через органы выделения.
31) Образование химическая природа прямого и непрямого билирубина. Количественное определение билирубина в крови. Диагностическое определение билирубина в сыворотке крови при болезни печени и крови.
Билирубин – желто-красный пигмент, продукт распада гемоглобина и некоторых других компонентов крови. Билирубин находится в составе желчи. Анализ билирубина показывает, как работает печень человека, определение билирубина входит в комплекс диагностических процедур при многих заболеваниях желудочно-кишечного тракта. В сыворотке крови встречается билирубин в следующих формах: прямой билирубин и непрямой билирубин. Вместе эти формы образуют общий билирубин крови, определение которого имеет важное значение в лабораторной диагностике.
Нормы общего билирубина: 3,4 - 17,1 мкмоль/л – для взрослых и детей (кроме периода новорожденности) . У новорожденных билирубин высокий всегда - это так называемая физиологическая желтуха.
Норма прямого билирубина: 0 - 3,4 мкмоль/л.
Анализ билирубина может показать отклонение от нормы билирубина. В большинстве случаев изменение уровня билирубина - признак серьезных заболеваний в организме человека.
Повышенный билирубин – симптом следующих нарушений в деятельности организма:
недостаток витамина В 12
острые и хронические заболевания печени
рак печени
гепатит
первичный цирроз печени
токсическое, алкогольное, лекарственное отравление печени
желчнокаменная болезнь.
Если прямой билирубин выше нормы, то для врача эти показатели билирубина – повод поставить следующий диагноз:
острый вирусный или токсический гепатит
инфекционное поражение печени, вызванное цитомегаловирусом, вторичный и третичный сифилис
холецистит
желтуха у беременных
гипотиреоз у новорожденных.
Повышение билирубина может указать на необходимость дополнительного обследования организма.
32) . Биологическая роль воды и ее обмен в организме, регуляция обмена воды.
Из неорганических веществ, входящих в состав клетки, важнейшим является вода. Количество ее составляет от 60 до 95% общей массы клетки. Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того что она входит в их состав, для многих организмов это еще и среда обитания. Роль воды в клетке определяется ее уникальными химическими и физическими свойствами, связанными главным образом с малыми размерами молекул, с полярностью ее молекул и с их способностью образовывать друг с другом водородные связи. Вода как компонент биологических систем выполняет следующие важнейшие функции: Вода — универсальный растворитель для полярных веществ, например солей, Сахаров, спиртов, кислот и др. Вещества, хорошо растворимые в воде, называются гидрофильными. Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно; соответственно возрастает реакционная способность вещества. Именно по этой причине большая часть химических реакций в клетке протекает в водных растворах. Ее молекулы участвуют во многих химических реакциях, например при образовании илигидролизе полимеров. В процессе фотосинтеза вода является донором электронов, источником ионов водорода и свободного кислорода. Система регуляции обмена воды в организме включает центральное, афферентное и эфферентное звенья. • Центральное звено системы контроля обмена воды — центр жажды (водорегулирующий). Его нейроны находятся в основном в переднем отделе гипоталамуса. Этот центр связан с областями коры большого мозга, участвующими в формировании чувства жажды или водного комфорта. • Афферентное звено системы включает чувствительные нервные окончания и нервные волокна от различных органов и тканей организма (слизистой оболочки полости рта, сосудистого русла, желудка и кишечника, тканей), дистантные рецепторы (главным образом зрительные и слуховые).