Будут ли изотоническими 10%-ные растворы глюкозы и фруктозы? Растворы. Коллигативные свойства
Образцы тестов.
Растворы. Коллигативные свойства.
Вариант 1
Часть А
1.Количественной характеристикой процесса электролитической диссоциации электролита является:
1) степень диссоциации
2) константа растворимости
3) степень ионизации
4) константа нестойкости
2.Степень диссоциации слабого электролита увеличивается при:
1) добавлении одноименного иона
2) увеличении концентрации раствора
3) разведении раствора
4) охлаждении раствора
3.Взаимосвязь константы диссоциации и степени диссоциации слабого электролита описывается законом:
1) Гульдберга-Вааге
2) В.Оствальда
3) М.К.Сеченова
4) О.Генри
4.Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
5.Коэффициент активности иона тем больше, чем:
1) больше концентрация электролита
2) меньше концентрация электролита
3) меньше растворимость электролита
4) не зависит от концентрации электролита
6.Ионная сила раствора – это:
1) произведение концентрации иона на квадрат его заряда
2) произведение концентрации иона на его заряд
3) сумма произведения концентрации ионов на квадрат их зарядов
4) полусумма произведения концентрации ионов на квадрат их зарядов
7.Коэффициент активности ионов (fi) в очень разбавленных растворах равен:
1) 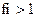
2) 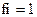
3) 
4) 
8.Ионная сила плазмы крови человека равна 0,15 м, заменителем плазмы крови является:
1) 0,7 м раствор глюкозы
2) 0,15 м раствор карбоната натрия
3) 0,9% раствор хлорида натрия
4) 1,9% раствор хлорида натрия
9.Смешали 200г 20%-ного и 300г 10%-ного растворов глюкозы. Массовая доля вещества в полученном растворе равна в %:
1)15
2)16
3)18
4)14
Сосудосуживающим действием обладает гидрохлорид адреналина. Его терапевтическая доза составляет 0,5 мл 0,1%-ного раствора. Рассчитайте массу (г) адреналина, содержащуюся в этом растворе (плотность раствора равна 1г/мл) .
1) 0,5
2) 0,0005
3) 0,005
4) 0,1
При понижении осмотического давления крови происходит: а) усиление мочевыделения; б) увеличение потовыделения; в) выход жидкости из сосудистого русла, прекращение ее обратного всасывания; г) избыточное накопление жидкости в тканях
1) а, б
2) в, г
3) б, в
4) а, б, в, г
12.Раствор, содержащий 20 г вещества в 400 г воды кипит при температуре 100,22 °С (К H2O = 0,52 град.·кг/ моль). Молярная масса растворенного вещества равна:
1) 115 г/моль
2) 110 г/моль
3) 125 г/моль
4) 118 г/моль
В живых организмах большое увеличение ионной силы плазмы крови при введении многозарядных ионов приводит к: а) уменьшению степени ионизации белков и нуклеиновых кислот; б) дегидратация полиэлектролитов; в) уменьшению количества свободной воды; г) изменению конформации полиэлектролитов.
1) а, б, в
2) б, в, г
3) а, 6, г
4) а, б, в, г
14.Молярная масса вещества 40 г/моль. Ккр=1.86. Температура замерзания раствора, состоящего из 300 г воды и 20 г растворенного вещества, составляет:
1) -2.7 0С
2) -1.7 0С
3) -3.1 0С
4) -0.93 0С
15.При введении больному 20%-ного раствора глюкозы наблюдается:
1) осмотический шок
2) осмотический конфликт
3) изменения осмотического давления не происходит
4) повышение рН крови
16.Осмотическое давление крови составляет при 37°С:
1) 500-600 кПа
2) 750-800 кПа
3) 360-400 кПа
4) 200-300 кПа
17.Температура замерзания сантимоляльного раствора NaCL по сравнению с сантимоляльным раствором глюкозы:
1) выше
2) ниже
3) их температуры замерзания одинаковы
4) зависит от давления
Будут ли изотоническими 10%-ные растворы глюкозы и фруктозы?
1) да
2) нет
3) будут осмолярными
4) будут осмоляльными
19.В 5%-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
20.Осмотическое давление пропорционально:
1) молярной концентрации
2) молярной концентрации эквивалента
3) моляльной концентрации
4) мольной доле вещества
21.Давление паров растворителя над раствором при увеличении концентрации вещества:
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала увеличивается, затем уменьшается
22.Температурой кипения жидкости является температура, при которой давление ее паров становится…
1) равным внешнему давлению
2) меньше внешнего давления
3) больше внешнего давления
4) зависит от формы сосуда
23.Криоскопические и эбуллиоскопические постоянные зависят от:
1) природы растворителя
2) температуры
3) природы растворенного вещества
4) числа частиц растворенного вещества
24.При добавлении этанола к воде температура кипения:
1) понижается
2) повысится
3) не изменится
4) зависит от формы сосуда
25.В 200 г. физиологического раствора ( 0,9% NaCl) содержится NaCl :
1) 18 г.
2) 1.8 г.
3) 0.18 г.
4. 0.018 г.
26.Гидратная теория электролитической диссоциации была предложена::
1) С.Аррениусом
2) Д.И.Менделеевым
3) О.Генри
4) Г.Льюис
27.Электролитическая диссоциация сопровождается:
1) увеличением энтропии и уменьшением энергии Гиббса
2) увеличением энтропии и увеличением энергии Гиббса
3) уменьшением энтропии и увеличением энергии Гиббса
4) энтропия и энергия Гиббса не изменяется
28.Только сильные электролиты перечислены в ряду:
1) H2S, HCl, H2SO4
2) HClO4,KCl, HNO3
3) HCN, CH3COOH, NH4OH,
4) NaOH, H2Se, HI
29.Электрический ток не проводят водные растворы:
1) ацетата Na
2) хлорид метиламмония
3) муравьиной кислоты
4) глицерина
30.Диссоциацию глюкозы описывает уравнение:
1) С6Н12О6 → 6С4++12Н+ + 6О2-
2) глюкоза не диссоциирует
3) С6Н12О6 → 12Н+ + 6СО-
4) С6Н12О6 → 6С4+ + 6Н2О
Вариант 2
Часть А
1. Для сильных электролитов понятие «активность ионов» характеризует:
1) степень диссоциации
2) взаимодействие между ионами и растворителем
3) степень гидратации
4) эффективную концентрацию ионов
2. Константа диссоциации слабого электролита зависит от:
1) концентрации
2) разбавления
3) природы вещества и растворителя
4) давления
3. Способность электролита диссоциировать на ионы характеризуется:
1) степенью диссоциации
2) константой растворимости
3) константой Генри
4) константой нестойкости
4. Концентрация иона SO42- в 0,01 м растворе соли Al2(SO4)3:
1) 0,01 м
2) 0,02 м
3) 0,03 м
4) 0,05 м
5. С увеличением ионной силы раствора коэффициент активности иона в уравнении  :
:
1) уменьшается
2) увеличивается
3) не изменяется
4) вначале увеличивается, затем остается постоянным
6. Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м