Приготовление раствора определенной массовой концентрации (%)
Краткая справка
Дисперсная система – система, состоящая из дисперсной фазы и дисперсной среды.
Дисперсная фаза – совокупность раздробленных частиц, количественной мерой которых является условный диаметр L (м) или степень дисперсности D=1/L (м-1).
Классификация ДС по степени дисперсности:
1) молекулярно-дисперсные (L<10-7м);
2) тонко-дисперсные, коллоидные (а=10-7-10-5м);
3) грубодисперсные (L>10-5м).
Относительное понижение давления пара над раствором зависит от мольной концентрации электролита:
P10, P – давление пара растворителя и раствора;
n – число молей растворенного неэлектролита;
N – число молей растворителя.
Криоскопическая константа Ккр. – величина, показывающая на сколько градусов раствор, состоящий из 1 моля неэлектролита и 1000 г. Данного растворителя, замерзает ниже, чем чистый растворитель.
Tзам*ML
Ккр. = 1000*m
L – масса растворителя;
m - масса растворяемого вещества;
M – молекулярная масса растворяемого вещества.
Концентрации растворов – количественное содержание растворяемого вещества в данном растворе.
Процентная концентрация (%) – массовое содержание растворяемого вещества в 100г раствора.
Молярная концентрация (М) – число молей растворяемого вещества в 1л раствора.
Моляльная концентрация (С*m) – число молей растворяемого вещества в 1000г растворителя.
Нормальная концентрация (N) – число грамм-эквивалентов вещества в 1л раствора.
Растворы электролитов – ионные проводники с полярным или ионным типом связи в полярных растворителях, проводящих электрический ток.
Электролитическая диссоциация – распад веществ с ионным или полярным типом связи под действием полярных молекул растворителя.
Растворы элементов характеризуются активностью: а = y*c;
у – коэффициент активности
с – концентрация
Растворение – физико-химический процесс взаимодействия растворимого вещества с растворителем (сольватация, гидратация). При растворении сильных электролитов осуществляется межионное взаимодействие, количественной характеристикой которого является ионная сила:
Для количественной характеристики реакции среды (кислая, щелочная) применяют водородный показатель (pH).
Среда:
1) нейтральная: аН+=10-7 (pH=7)
2) кислая: аН+>10-7 (pH<7)
3) щелочная: аН+<10-7 (pH>7)
Произведение растворимости – произведение концентраций ионов малорастворимого электролита, содержащееся в свободном виде в насыщенном растворе при стандартных условиях.
Гидролиз – реакция химического обменного взаимодействия растворимого вещества с водой.
Гидролизу подвергаютсяся соли:
1) сильные основы и слабые кислоты (Na2CO3);
2) слабые основы и сильные кислоты (MgCl2);
3) слабые основы и слабые кислоты (MgCO3).
Растворы – однофазные системы переменного состава из 2-х и более компонентов.
Экспериментальная часть
Опыт 5.2.1.
Приготовление раствора определенной массовой концентрации (%).
Рассчитаем весовое количество соли для приготовления 250 мл раствора. Концентрация NH4Cl = 7%.
 Дано: Решение:
Дано: Решение:
Vр-ра = 250мл VNH4Cl = 17,5 мл
(NH4Cl) = 7% M(NH4Cl) = 53,5 г/моль
 m(NH4Cl) = ?
m(NH4Cl) = ? 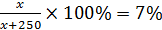

x = 0,07x + 17,5
0,93x = 17,5
x = 18,8 г
m(NH4Cl) = 18,8 г
fэкв = 1 / заряд катиона * индекс при катионе (количество катионов в соединении) = 1/(1*1) = 1
Мэкв = M(NH4Cl) / fэкв (NH4Cl) = 53,5 / 1 = 53,5 г/моль-экв.
18,8 – 250 мл
Х – 1000 мл
Х = 18,8 * 1000 / 250 = 75,2 г
См = 75,2 / 53,5 = 1,4 моль/л
Сн = X / Мэкв = 75,2 / 53,5 = 1,4 г-экв./л
N(NH4Cl) = 18,8 / 53,5 = 0,35
Опыт 5.2.2.