М’язові волокна та їх структурна організація
РОЗДІЛ 13. БІОХІМІЯ М’ЯЗОВОЇ СИСТЕМИ
Теоретична частина
Рухова активність є основою усіх пристосувальних реакцій людини і тварин до змін зовнішнього середовища. Будь-який рух людини відбувається в результаті скорочення органів руху і сили – м’язів. М’язова тканина займає перше місце за об’ємом серед інших тканин людини. В організмі дорослого чоловіка на м’язи припадає 40-45% маси тіла (у жінок того ж віку маса м’язів зазвичай менша, з чим і пов’язані статеві відмінності в проявах м’язової сили і рівня фізичної працездатності), у людей похилого віку – 30%, дітей – близько 25%. У спортсменів силовиків маса м’язів може досягати 50-55%, а у культуристів – 60-70% загальної маси тіла.
М’язи – основний біохімічний перетворювач потенціальної (хімічної) енергії в кінетичну (механічну). Ефективне перетворення хімічної енергії в механічну можливе при дотриманні певних умов:
− сталого забезпечення хімічною енергією (в м’язах хребетних хімічна енергія зосереджена в молекулах АТФ і креатинфосфату);
− існування засобів регуляції механічної активності (швидкості, тривалості і сили скорочення);
− забезпечення нервовою системою контролю процесу перетворення;
− забезпечення механізму повернення системи у вихідний стан.
За своїми властивостями м’язи характеризуються великою еластичністю, пластичністю та скоротливістю.
М’язові волокна та їх структурна організація
В організмі хребетних існує три типи м’язів: скелетні, серцеві (міокард) та гладкі. Вони відрізняються морфологічно, біохімічно і функціонально. Скелетні та серцеві м’язи мають поперечну смугастість; в гладких м’язах вона відсутня. Скелетні м’язи функціонують довільно, серцеві і гладкі – мимовільно. Скелетні м’язи прикріплені в основному до кісток, що і обумовлює їх назву.
Для розуміння біохімії м’язової діяльності найбільший інтерес представляє функціонування скелетних м’язів.
Окремі м’язи різних частин тіла оточені оболонкою сполучної тканини і мають складну морфологічну будову. Кожний м’яз складається з пучка м’язових волокон, які містять багаточисельні скоротливі нитки – міофібрили (рис. 13.1).
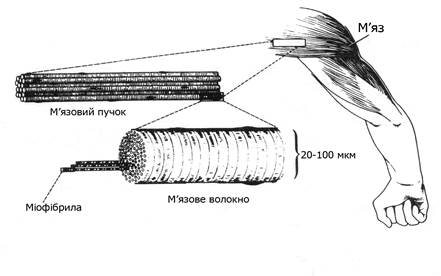
Рис. 13.1. Структурна організація скелетних м’язів людини
М’язове волокно − структурна одиниця скелетних м’язів, багатоядерна циліндричної форми видовжена поперечносмугаста клітина. Кожне м’язове волокно має велику кількість (1 тис. і більше) м’язових ниток – міофібрил. У різних людей в одних і тих же м’язах може бути різна кількість волокон, що впливає на їх силові властивості, процеси адаптації до м’язової роботи. Чим більше в м’язах волокон, тим вища можливість прояву максимальної сили м’язів. Товщина окремих м’язових волокон – 10-100 мкм, довжина – від 1-2 до 10-12 см. При народженні дитини товщина м’язових волокон становить близько 1/5 товщини волокон дорослих людей. Діаметр м’язових волокон значно зростає під впливом систематичних фізичних навантажень.
В скелетних м’язах є кілька типів м’язових волокон, які відрізняються скоротливими і метаболічними властивостями. До основних типів волокон відносяться червоні, білі та проміжні волокна. Саркоплазма червоних волокон містить багато міоглобіну, який і надає їм відповідного забарвлення, а також численні мітохондрії. М’язи, в яких переважають червоні волокна, скорочуються повільніше, але довго і без ознак втоми. Білі волокна містять менше міоглобіну та мітохондрій, але більше глікогену і глюкози. В білих волокнах вища АТФ-азна активність міозину. М’язи, що складаються здебільшого з білих волокон, швидко переходять від стану спокою до максимальної активності, скорочуються значно швидше, але раніше втомлюються, оскільки вичерпуються запаси глікогену, а глюкоза з крові надходить повільно.
М’язове волокно покрите тонкою еластичною мембраною − сарколемою (від грец. sarkós − м’ясо, плоть і lemma − шкірка, шкаралупа). Сарколема відіграє важливу роль у виникненні і проведенні збудження. Вона володіє вибірковою проникністю для різних речовин і має транспортні системи за допомогою яких підтримується різна концентрація йонів Na+, К+, Cl- всередині клітини і в міжклітинній рідині, що призводить до виникнення на її поверхні мембранного потенціалу. Утворення мембранного потенціалу дії під впливом нервового імпульсу – необхідна умова виникнення збудження м’язового волокна.
Внутрішній простір м’язового волокна заповнений внутрішньоклітинною рідиною − саркоплазмою. До її складу входить саркоплазматичний матрикс і ретикулум.
Саркоплазматичний матрикс – це рідина, в яку занурені скоротливі елементи м’язового волокна – міофібрили. Крім міофібрил до складу матрикса входять гранули глікогену, крапельки жиру, фосфатні речовини та інші малі молекули і йони, pозчинні білки (16,5–21,0 %).
В кожному м’язовому волокні знаходиться до 1000 і більше міофібрил. Це спеціалізовані скоротливі структури діаметром 1-3 мкм. До складу міофібрил входять товсті міозинові і тонкі актинові філаменти.
Просторове розташування міофіламентів визначає посмугованість скелетних м’язів, яку добре видно під мікроскопом. Тонкі Z-мембрани (телофрагма-Т), до яких прикріпляються тонкі філаменти, ділять міофібрили на саркомери. Саркомер – це основна структурно-функціональна скоротлива одиниця міофібрили (рис. 13.2). В саркомерах актинові філаменти розташовані між міозиновими, які мають довгі «хвости» і «головки». Головки міозинових молекул повернуті в косому напрямі до актинових ниток і мають назву поперечних містків.
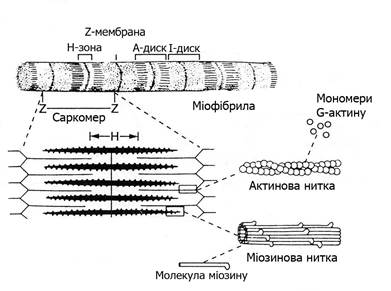
Рис. 13.2. Будова саркомера
Поперечна посмугованість міофібрил є наслідком чергування ділянок саркомера з сильним і слабким заломленням променів. В тій частині саркомера, де розміщені тільки тонкі нитки (диск І), заломлення променів невелике. В місцях перекриття товстих і тонких ниток (диск А) заломлення променів подвійне, а тому вони виглядають темними. Всередині диска А тонких ниток немає – це Н-зона, вона світла. Посередині диска А поперек проходить мембрана – ізофрагма (М), вона взаємозв’язана з телофрагмою (Z-лінією) і з сарколемою.
Міофібрили згруповані в пучки (колонки) по 4-10 штук в кожному. Колонки тісно зв’язані з транспортною системою м’язового волокна (саркоплазматичною сіткою), по якій циркулюють поживні речовини і розповсюджується електрична хвиля збудження.
Саркоплазматичний ретикулум (СР) − це внутрішньоклітинна мембранна система, якаскладається з поперечних (Т-трубочок) і поздовжніх трубочок, розташованих між міофібрилами паралельно до них (рис. 13.3). На внутрішній мембрані розташовані білки, які здатні зв’язувати йони Са2+. Основна функція СР – регуляція йонів Кальцію в просторі між актином та міозином, рівень якого змінюється при скороченні-розслаблені від 10-5 до 10-7 моль/л. Під дією нервового імпульсу СР виділяє йони Са2+, а після припинення його дії знову поглинає. На мембрані СР розміщені також рибосоми, де проходить біосинтез білків.

Рис. 13.3. Схема розміщення Т-систем
і саркоплазматичного ретикулуму у м’язовому волокні
В м’язовій клітині по ходу міофібрил знаходяться мітохондрії (саркосоми). Мітохондрії виконують функції «енергетичних станцій» м’язового волокна, оскільки в них утворюється АТФ – енергія для м’язового скорочення. Їх кількість зумовлює функціональну активність м’язів. До складу мітохондрій входять білки, жири, вуглеводи, нуклеїнові кислоти, а також велика кількість ферментів, які беруть безпосередню участь у процесах ресинтезу АТФ. Найбільше мітохондрій в постійно працюючому серцевому м’язі.
Непосмугована м’язова тканина. Гладенькі м’язи утворюють стінки внутрішніх органів (органів травної системи, бронхів, кровоносних і лімфатичних судин, сечового міхура, матки, тощо), шкіри і залоз. На відміну від посмугованої м’язової тканини міофібрили гладеньких м’язів не мають посмугованості. До їх складу входить білок тономіозин (різновидність актоміозину), а також леатонін, функцією якого є підтримання тривалого тонічного напруження. Цьому сприяє хаотичне розташування скоротливих білків у волокнах гладеньких м’язів. Довжина клітин гладеньких м’язів залежить від органу, до складу якого вони входять (20-500 мкм), діаметр – 5-20 мкм.
Гладенькі м’язи менш збудливі, ніж поперечносмугасті, вони мають більш тривалий рефрактерний період і невелику швидкість поширення нервового імпульсу (2-15 см/с). Збудження по непосмугованих м’язах може вільно передаватися з одного волокна на інше. Ці та інші морфофізіологічні особливості гладеньких м’язів зумовлюють ряд відмінних ознак їх функціонування.
Хімічний склад м’язів
Вагомий внесок у вивчення біохімії м’язової тканини зробили вчені української біохімічної школи – О.В.Палладін, Д.Я.Фердман, С.О Костерин і особливо М.Д.Курський.
Хімічний склад м’язів вивчається не в окремо взятих мікроскопічних елементах, а в загальній масі. В скелетних м’язах теплокровних тварин міститься 73-78% води і 22-27% сухого залишку. Сухий залишок складають: білки – 17-21%, глікоген – 0,5-3,0%, фосфоліпіди – 0,02-1,0%, холестерин – 0,02-0,23%, креатинін – 0,003-0,005%, АТФ – 0,25-0,40%, креатин і креатинфосфат – 0,2-0,55%, карнозин – 0,2-0,3%, молочна кислота − 0,01-0,02%, неорганічні речовини – 1,0-1,5%. В м’язах холоднокровних тварин води дещо більше − 80-82%.
В працюючому до втоми м’язі вміст води зростає до 80-83%. Причиною цього є значне утруднення відтоку води від напруженого м’яза. Вміст води в м’язах, як і в організмі вцілому, залежить від віку. Чим молодший організм, тим більше в його м’язах води.
Білки м’язової тканини поділяють на три групи: саркоплазматичні (35%), міофібрилярні (45%) та білки м’язової строми (20%).
До білків саркоплазми належать білки-ферменти, що каталізують процеси окисного фосфорилювання (локалізовані у мітохондріях), ферменти гліколізу, азотистого і ліпідного обміну (містяться у саркоплазмі). До цієї групи належать також міоглобін, глобулін Х, міоальбумін, міоген.
Особливу роль виконує міоглобін. У м’язових клітинах кисневий обмін здійснюється завдяки міоглобіну. Міоглобін більш споріднений до кисню, ніж гемоглобін. Сполучаючись з киснем крові, цей білок забезпечує депонування 15% кисню. У тренованих мʼязах кількість міоглобіну значно більше, ніж у нетренованих, завдяки чому значно збільшується киснева ємність організму. У процесі посилення м’язової роботи міоглобін віддає свій кисневий запас мітохондріям, де відбувається ресинтез АТФ в аеробних умовах (окиснювальне фосфорилювання). Багато міоглобіну в м’язах дельфіна, тюленя (15–30 % від cухого залишку м’язової тканини), а також у людей, професія яких вимагає тривалої затримки дихання (збирачі перлин, спортсмени підводного плавання тощо).
Міоген є гетерогенною фракцією білків м’язів. Цей простий глобулярний білок становить у середньому близько 30% їх загальної маси. Складається з міогену А і міогену В. Міоген А володіє ферментативною активністю альдолази (розщеплює 1,6-дифосфат до фосфодіоксіацетону і 3-фосфогліцеринового альдегіду). Міоген В ферментативно неактивний.
Глобулін Х – гетерогенний білок, що залишається в м’язовій тканині після виділення міогенової фракції. За хімічними властивостями він подібний до глобулінів. Володіє ферментативною активністю. Становить у середньому 20% загальної кількості білків тканини.
Міоальбумін.За хімічними властивостями цей білок м’язів подібний до альбумінів крові. Його багато в м’язах ембріонів і в гладеньких м’язах.
Міофібрилярні білки представлені скоротливими білками − міозином, актином, актоміозином, а також регуляторними білками − тропоніном, тропоміозином, α- та β-актинінами. Міофібрилярні білки забезпечують скоротливу функцію м’язів.
Міозин є одним з основних скоротливих білків м’язів і становить 55% від загальної кількості м’язових білків. З нього побудовані товсті нитки міофібрил. За хімічною природою – глобулін. В молекулі міозину розрізняють довгу фібрилярну частину і глобулярні структури (головки). Фібрилярна частина складається з двох поліпептидних ланцюгів, скручених у спіраль (рис. 13.4 а). В складі молекули міозину шість субодиниць: два важкі поліпептидні ланцюги (молекулярна маса 200 тис.) і чотири легкі (молекулярна маса 1500-2700), розміщені в глобулярній частині. Основною фунцією фібрилярної частини міозину є здатність утворювати добре впорядковані пучки міозинових філаментів або товсті протофібрили (рис. 13.4 б, в).

Рис. 13.4. Схема будови молекули міозину (а), міозинового пучка (б), міозинової нитки (в)
На головках молекули міозину розміщені активний центр АТФ-ази і актинзв’язуючий центр, які забезпечують гідроліз АТФ і взаємодію з актиновими філаментами.
В присутності йонів Ca2+ підвищується АТФ-азна активність міозину і швидкість гідролізу АТФ:
Ca2+-АТФ-аза
АТФ + Н2О → АДФ + Н3РО4 + енергія (∆Gº=30 кДж/моль).
Енергія використовується для зміни конформації міозину і генерації напруги між товстими і тонкими нитками в м’язі, що скорочується. За допомогою йонів Mg2+ міозин здатний приєднувати молекули АТФ і АДФ, а також взаємодіяти з молекулами актину, що знаходяться в складі тонких ниток міофібрил.
Міозин відрізняється від інших білків своєю нестійкістю, навіть при оптимальних умовах; при зберіганні він поступово змінюється і втрачає свої вихідні властивості. Особливо чутливий міозин до слідів металів. При повільній денатурації молекули агрегують (злипаються) і розчинність міозину знижується.
Актин – другий скоротливий білок м’язів, який складає основу тонких ниток (рис. 13.5).Виділений з м’язів у 1942 році угорським дослідником Ф.Б. Штраубом. Є глобулярним білком. Актин може бути у вигляді мономеру (М=70000), а також у вигляді димеру (М=140000). Відповідно до цього є дві форми актину: глобулярна (G-А) і фібрилярна (F-А), які можуть переходити одна в одну. Перетворення глобулярної форми актину на фібрилярну зумовлюється поєднанням окремих глобул у ланцюг. G-А – глобулярний білок з молекулярною масою 42 тис., складає 25% загальної маси м’язового білка. В присутності йонів Mg2+ актин полімеризується з утворенням нерозчинного філамента у вигляді спіралі і перетворюється у F-А. G- та F-актин не володіють ферментативною активністю. Кожна молекула G-А здатна зв’язувати один йон Са2+ і одну молекулу АТФ чи АДФ. Процес полімеризації актину проходить за наступним механізмом:
n(G-А-АТФ) → (G-А-АДФ) + F-А + nФн
Актин здатний взаємодіяти з міозином, утворюючи актоміозиновий комплекс у молярному співвідношенні приблизно 1:1. Актоміозиновий комплекс може дисоціювати в присутності АТФ і Mg2+. Актоміозин знаходиться в усіх м’язових волокнах людини та тварин, забезпечуючи процеси скорочення м’язів та рух органел клітин.
До складу тонких ниток входять і мінорні білки – тропоміозин, тропонін, актиніни.

Рис. 13.5. Схема будови актинової нитки
Тропоміозин (Тм) – структурний білок актинової нитки. За властивостями подібний до міозину. До складу тропоміозину входять 18 амінокислот, особливо багато лізину, аланіну, глутамінової кислоти. Являє собою витягнуту у вигляді тяжа молекулу (молекулярна маса 50 тис.). Два поліпептидні ланцюги Тм обгортають актинові нитки (рис. 13.5). На кінцях кожної молекули тропоміозину розміщені білки тропонінової системи, наявність якої характерна лише для поперечно-смугастих м’язів.
Тропонін (Тн) – регуляторний білок актинової нитки. Складається із трьох субодиниць – ТнТ, ТнІ, ТнС. Тропонін Т (ТнТ) забезпечує зв’язування з тропоміозином, тропонін І (ТнІ) – блокує (інгібує) взаємодію актину та міозину, тропонін С (ТнС) – Са2+-зв’язуючий білок (чотири йони Са2+ на одну молекулу білка). Тропонін-тропоміозинова система за відсутності йонів Са2+ в стані спокою гальмує змикання поперечних містків з актиновими нитками і блокує АТФ-азну активність міозинових головок.
Крім цих білків у м’язовому скороченні приймають участь і α- та β-актиніни. b-актинін знаходиться на вільних кінцях актинового філаменту в центрі саркомера. Він впливає на полімеризацію актину. Із Z-мембрани виділені a-актинін (М=180 кДа), філамін (М=240 кДа), десмін (М=50 кДа). Філамін і a-актинін виявлені всередині Z-мембран. Ці білки утворюють поперечні містки між актиновими нитками, збираючи їх в пучки і прикріпляючи їх до Z-мембран. Десмін локалізований на периферії Z-мембран та в місцях, де вони з’єднуються з сарколемою.
Білки м’язової строми – це білки, які залишаються в м’язовій тканині після екстракції білків саркоплазми та міофібрил сольовими розчинами. Становлять 15-20% загальної кількості білків м’язів. До їх складу входятьструктурні (колаген, еластин, нейрокератин) і ферментні(АТФ-аза, АМФ-аміногідролаза) білки.
Ліпіди мʼязів представлені нейтральними жирами, стеринами, стеридами, гліколіпідами, фосфатидами. М’язи містять в середньому близько 1% ліпідів, але в їх розподілі, а також у співвідношенні окремих ліпідів в різних м’язах є суттєві відмінності. Загальний вміст стеринів і стеридів коливається в межах 0,03-0,23%, фосфатидів – 0,4-1%.
Нейтральні жири м’язів є резервними жирами, які розташовуються між окремими м’язовими волокнами в сполучній тканині; їх присутність не є обов’язковою. Холестерин і фосфатиди – необхідні складові частини всіх м’язів. Серцевий м’яз містить приблизно в два рази більше холестерину і фосфатидів, ніж скелетна мускулатура; в гладеньких м’язах багато холестерину і мало фосфоліпідів. В деякій мірі між вмістом ліпідів і працездатністю м’яза спостерігається певний взаємозв’язок: м’язи, які постійно працюють з великим навантаженням містять більше холестерину і фосфоліпідів. Відповідно у вмісті цих речовин існують значні індивідуальні коливання, зумовлені рівнем рухової активності відповідних м’язів.
При голодуванні в першу чергу використовуються резервні жири. Нейтральні жири, холестерин і фосфоліпіди залишаються в складі м’язової тканини. Згодом, при тривалому голодуванні, на енергетичні цілі використовуються не лише жири, а й білки м’язів.
Екстрактивні речовини м’язової тканини − це органічні і мінеральні сполуки, які добре екстрагуються водою з подрібненої м’язової тканини. Органічні сполуки поділяють на азотовмісні й безазотисті.
Азотовмісні екстрактивні речовини становлять близько 1% загальної маси м’язів. Вміст небілкового азоту в складі м’язової тканини досягає 0,3-0,9% (300-350 мг%). До них належать АТФ і продукти її розщеплення − АДФ, АМФ, вільні амінокислоти, креатин, креатинфосфат, креатинін, карнозин, карнітин, ансерин, аміак, пуринові та піримідинові сполуки, поліпептиди. Більшість цих речовин перебуває у фосфорильованому стані.
Найбільше значення в енергозабезпеченні м’язової діяльності має відкритий в 1835 році креатин, який синтезується з трьох амінокислот: гліцину, аргініну, метіоніну. Спочатку в нирках з гліцину і аргініну під впливом відповідних ферментних систем утворюється гуанідиноцтова кислота, а з неї і метіоніну в тканинах печінки синтезується креатин.
Креатин з кровʼю надходить у м’язову тканину. Тут, під впливом ферменту креатинкінази, він фосфорилується і перетворюється на креатинфосфат. Понад 50% креатину перебуває у вигляді креатинфосфату, який міститься у скелетних м’язах, серці, мозку, нервовій тканині і приймає участь в енергетичному обміні. Скелетні м’язи, на відміну від інших органів, здатні утримувати значні кількості креатину.
Біологічна роль креатинфосфату полягає у підтриманні в тканинах сталого вмісту АТФ. Вміст креатинфосфату у м’язах в стані спокою у 5-8 разів більший, ніж АТФ, що повністю забезпечує сталий рівень АТФ в період фізичного навантаження. При відсутності м’язових скорочень, під час гліколізу та окисного фосфорилування, поповнюються запаси АТФ і посилюються процеси утворення креатинфосфату.
Кінцевим продуктом обміну креатинфосфату є креатинін, який утворюється при спонтанному неферментативному гідролізі креатинфосфату і виділяється із сечею.
Ансерин – природний дипептид, утворюється з амінокислот 1-метилгістидину і β-аланіну, під час метилування карнозину. Ансерин міститься в м’язах більшості хребетних тварин, в інших тканинах організму він практично відсутній. Біологічна роль ансерину пов’язана з фізіологічною функцією м’язів – забезпеченням скоротливості м’язових волокон. М’язи, що несуть значне функціональне навантаження, відзначаються високим вмістом ансерину.
Вважають, що ансерин впливає на фосфорилуюче окиснення та синтез макроергічних сполук на мембранах мітохондрій, посилює процеси вуглеводного обміну, забезпечує нормальне функціонування клітинних структур та м’язових волокон.
Карнітин − належить до вітаміноподібних сполук. Його ще називають вітаміном ВТ. Молекулярна маса карнітину − 161200. Завжди присутній у тканинах рослинних і тваринних організмів, а також в клітинах бактерій та мікроорганізмів. Значна кількість карнітину міститься у м’язовій тканині. Для деяких видів тварин карнітин є необхідним фактором росту, оскільки він не синтезується в їх організмі. В організмі людини карнітин може частково синтезуватися з лізину.
Біологічна роль карнітину полягає в його участі у багатьох обмінних реакціях організму. Наприклад, він стимулює процеси β-окиснення жирних кислот – є кофактором, який забезпечує транспорт залишків жирних кислот крізь мембрани з цитоплазми в мітохондрії.
Карнозин – природний дипептид, що утворюється з амінокислот гістидину і β-аланіну. Цей імідазолвмісний дипептид входить до складу азотистих сполук, добре розчинний у воді і нерозчинний в етанолі. Значний вміст карнозину виявлено в скелетних м’язах – 150-1000 мг на 100 г тканини. Бере участь в обміні речовин у скелетних м’язах, посилює частоту та силу м’язових скорочень шляхом підвищення ефективності роботи йонних насосів м’язової тканини.
Карнозин є попередником ансерину. У м’язах ссавців (у розрахунку на сиру масу) міститься 0,2-0,3% карнозину, 0,09-0,15% ансерину і 0,02-0,5% карнітину.
Серед амінокислот в м’язовій тканині багато глутаміну і глутамінової кислоти та їхніх амідів (близько 75% усіх амінокислот). Зв’язаний амоніак у вигляді глутаміну використовується тканиною для амінування пуринових і піримідинових основ, карбонових кислот, а його надлишок з кров’ю надходить у печінку, де з нього синтезується сечовина.
У незначних кількостях в м’язах містяться сечова кислота, аденін, гуанін і продукти їх дезамінування – гіпоксантин і ксантин.
До безазотистих екстрактивних речовин м’язів належать глікоген (3-4%) та продукти анаеробного та аеробного обміну вуглеводів: молочна кислота; гексозофосфати (глюкозо-1-фосфат, глюкозо-6-фосфат, фруктозо-1-фосфат та інші); тріозофосфати (фосфодіоксіацетон, 3-фосфогліцериновий альдегід); глюкоза; янтарна кислота; вітамін С; інозит тощо.
Глікоген знаходиться в саркоплазмі у вільному стані або в комплексі з білками. Вміст глікогену в скелетних м’язах коливається в значних межах (від 0,3 до 3%) і залежить від кількості вуглеводів у їжі та ступеня тренованості. При тренуванні збільшується кількість вільного глікогену. Глікоген використовується в м’язах як основний енергетичний субстрат при напруженій роботі. Вже навіть при роботі м’язів тривалістю 0,5-1 хв. кількість глікогену в них різко знижується.
Особливості хімічного складу серцевого і гладеньких м’язів.Серцевий м’яз багатий на воду (78-79%). Сухий залишок, який складає 21-22% маси серця на 80% складається з білків. За своїми властивостями білки серцевого м’язу мало відрізняються від білків скелетних м’язів. Відмінності пов’язані, перш за все, з кількісним складом окремих білків і білкових фракцій. В серцевому м’язі менше креатину (приблизно в два рази) і аденозинтрифосфорної кислоти, проте більше глутаміну і глутамінової кислоти. Вміст глікогену в серцевому м’язі близько 0,5% і майже не змінюється в процесі виконання фізичних вправ. В скелетних м’язах при виконанні напруженої фізичної роботи концентрація цього енергосубстрату може зменшуватися в 2-3 рази.
Порівняно багатий серцевий м’яз на фосфатиди при окисненні яких виробляється значна кількість енергії, необхідної для скорочення міокарду.
Гладенькі м’язи містять близько 75% води. Основу їх сухого залишку складають актоміозин, креатин, АТФ. У складі гладеньких м’язів виявлені сліди ансерину і карнозину; вони бідніші на фосфатиди, багатші на холестерин, тропоміозин та білки строми.
Обмін речовин у м’язах
М’язова тканина характеризується високим ступенем метаболізму. Обмін речовин у м’язі в стані спокою знаходиться на відносно низькому рівні, а під час виконання роботи може зростати більше ніж у 100 разів. За таких умов необхідна мобілізація великих обсягів енергії. Джерелом енергії є реакції анаеробного глікогенолізу і циклу трикарбонових кислот. При виконанні роботи великої потужності в тканині різко зростає вміст молочної кислоти, зменшується вміст глікогену, макроергічних сполук тощо. При цьому накопичується багато продуктів обміну, деякі з них – шкідливі для організму.
Хімічні процеси в працюючому ізольованому м’язі. На початку XIX століття Й. Берцеліус припустив, що при роботі м’яза утворюється молочна кислота. Це припущення знайшло своє підтвердження в дослідженнях Ю. Лібіха, який встановив наявність молочної кислоти в автолізованих м’язах (м’ясі).
Вивчаючи хімічний склад м’язів, Флетчер і Гопкінс (1907) вперше використали метод їх сильного охолодження. Ними було показано, що вміст молочної кислоти в м’язах в стані спокою дуже незначний і що вона утворюється при роботі. Була також встановлена пряма залежність між інтенсивністю утворення молочної кислоти і величиною виконаної м’язом роботи. При втомі м’яза в ньому виявляли велику кількість молочної кислоти. Було показано, що втомлений м’яз в присутності кисню поступово відновлює свою працездатність, причому, паралельно з цим зменшується вміст молочної кислоти.
О. Мейєргоф встановив, що в м’язі, який активно скорочується, молочна кислота виробляється в процесі розпаду глікогену. При розщепленні глікогену, який знаходиться в 1 г м’яза, до молочної кислоти вивільняється 1-2 ккал енергії, яка може бути використана для виконання роботи. В організмі за таких умов може накопичитися близько 100 г молочної кислоти.
Тривалий час вченим був відомий тільки один процес енергозабезпечення м’язової роботи, який не потребував кисню – розпад глікогену з утворенням молочної кислоти. Близько 20% утвореної при роботі в анаеробних умовах молочної кислоти аеробно окиснюється з утворенням вуглекислого газу і води. Відновлена при цьому енергія використовується для зворотного ресинтезу використаного глікогену із другої частини (80%) молочної кислоти. Вуглеводи вважались єдиним джерелом енергії, яке забезпечує роботу м’язів.
В 1927 році у зв’язку з відкриттям у м’язах хребетних тварин креатинфосфатної кислоти, утворення молочної кислоти при роботі м’язів в анаеробних умовах не могло вже вважатися єдиним джерелом енергії. Виявилось, що при роботі м’язів зменшується кількість креатинфосфатної кислоти та зростає вміст креатину і фосфатної кислоти. Розпад креатинфосфатної кислоти завжди супроводжувався вивільненням енергії.
В 1930 році Лундсгаардом встановлена можливість роботи м’язів без утворення молочної кислоти. Вчений встановив, що при повному гальмуванні (інгібуванні) гліколізу монойодоцтовою кислотою молочна кислота не утворюється взагалі, але скорочення м’язів продовжується. При цьому спостерігається енергетичний розпад креатинфосфату.
Таким чином, вчені прийшли до висновку, що робота м’язів можлива не лише в анаеробних умовах, а й при використанні креатинфосфату, ресинтез (відновлення) якого здійснюється за рахунок реакцій гліколізу.
В подальшому детальне вивчення м’язів, яке проводив Г. Ембден, показало, що головним джерелом енергії м’язової діяльності є реакція розщеплення АТФ.
Обмін речовин в м’язах при виконанні роботи. Робота м’язів викликана імпульсами, які йдуть до них по рухових нервах від центральної нервової системи. Посилена робота м’язів викликає їх втому і накопичення молочної кислоти та продуктів розпаду АТФ та КрФ. Молочна кислота і аміак легко дифундують із м’язів в кров і вміст їх в крові при посиленій роботі значно зростає. Одночасно з током крові до м’язів доставляються поживні речовини (глюкоза, ацетооцтова кислота тощо), які ними використовуються. Тому робота м’язів в цілісному організмі, яка відбувається за сприятливих умов, більш тривала та ефективна, ніж робота ізольованого м’язу.
При правильному поєднанні періодів роботи та відпочинку м’язи можуть працювати тривалий час без накопичення в них молочної кислоти, продуктів розпаду АТФ та КрФ, а також без ознак втоми. Тільки в тих випадках, коли розпад енергетично важливих речовин в м’язових волокнах в період скорочення проходить більш інтенсивно, ніж їх синтез в період розслаблення, в м’язах накопичується молочна кислота, аміак, креатин і фосфатна кислота. За таких умов м’язи поступово втомлюються і для відновлення їх працездатності необхідний тривалий проміжок відпочинку.
На початковій стадії роботи м’язів спостерігається інтенсивне використання накопичених в них запасів АТФ, КрФ та глікогену. Ця стадія роботи характеризується переважанням в м’язах процесів, які не потребують участі кисню і проходять в анаеробних умовах. При продовженні роботи на перший план виступають аеробні процеси, які супроводжуються використанням поживних речовин, які надійшли до м’язів з кров’ю.
Особливості обміну речовин в серцевому м’язі. Серцевий м’яз функціонує безперервно, в той час як для скелетних м’язів характерним є чергування роботи і відпочинку. Міокард дорослої людини за одне скорочення виштовхує в аорту близько 60 мл крові, за 1 хв. – 5 л, за 1 год. – 300 л, за добу – 7,2 т. Серце ритмічно працює упродовж всього життя людини. Уже незначні зміни ритму роботи серця призводять до порушення кровообігу, що викликає істотні зміни забезпечення організму киснем і поживними речовинами.
Для серцевого м’яза характерний аеробний шлях розщеплення вуглеводів. Високий вміст в серцевому м’язі міоглобіну забезпечує певний запас кисню, який використовується у випадку підвищення потреби в ньому, зокрема при посиленні роботи серця. Окисні процеси відбуваються у мітохондріях м’язових волокон. Частину енергії, у вигляді АТФ, серцевий м’яз отримує внаслідок окиснення жирних кислот і гідрооксикислот, а також реакцій пентозного шляху.
Переважання в серцевому м’язі аеробних процесів енергозабезпечення над анаеробними призводить до того, що при розпаді глікогену в ньому накопичується значна кількість молочної кислоти. Крім того, в серці інтенсивно окиснюється молочна кислота, яка доставляється кров’ю по системі коронарних судин. При посиленій роботі скелетних м’язів утворена в них молочна кислота частково поступає в кров. В печінці вона перетворюється в глікоген, а в серцевому м’язі − піддається аеробному окисненню.
При інтенсивній м’язовій роботі посилюється доставка до серцевого м’язу молочної кислоти, яка утворюються в скелетних м’язах, отже, створюються сприятливі умови для живлення серця. Цей факт цікавий з фізіологічної точки зору. Він є прикладом кореляційної координації функції органів. При посиленій роботі м’язів зростає інтенсивність кровообігу. Об’єм роботи серця зростає, і одночасно з цим до серця доставляється в збільшеній кількості молочна кислота, яка використовується в якості енергосубстрату.
Заклякання м’язів. Після смерті припиняється кровообіг і м’язова тканина позбавляється поживних речовин. Уповільнюється, а згодом припиняється видалення продуктів розпаду, реакція середовищ стає кислою, м’язи вкорочуються і тверднуть. Розвивається трупне заклякання – посмертне тверднення м’язів і пов’язана з ним нерухомість суглобів. Воно може настати через кілька хвилин або годин після клінічної смерті. Швидкість заклякання мʼязів залежить від наявності в тканині глікогену, кислих продуктів обміну (молочної кислоти, вуглекислоти) і навколишньої температури. В тканині різко зменшуються запаси глікогену, АТФ, КрФ, глюкози тощо. Незабаром вони зникають зовсім. Внаслідок значного зростання вмісту молочної кислоти і фосфатів і збільшення кислотності, відбувається коагуляція білків. Ці процеси швидше настають у скелетних, повільніше – у гладеньких м’язах. Через деякий час заклякання м’язів припиняється і вони знову стають м’якими. Відсутність у трупа заклякання м’язів є важливою ознакою небезпечної хвороби – сибірської виразки.