НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА БИОМЕМБРАН И МЕТОДЫ ИХ ИССЛЕДОВАНИЯ
Липидный компонент мембран определяет механические, оптические, электрические (R, C) и осмотические (непроницаемость для ионов и проницаемость для воды) свойства.
С точки зрения электродинамики мембрана представляет собой диэлектрик с относительной диэлектрической проницаемостью от 2 до 6. Селективная проницаемость мембран и различия в концентрации для ионов разных знаков приводит к образованию двойного электрического слоя. Экспериментально показано, что между внутренней и наружной сторонами мембраны существует разность потенциалов в 50-80 мВ (в некоторых случаях более 200 мВ). Учитывая толщину мембраны (7-8 нм), это даёт для напряженности электрического поля в мембране ~ 104 ÷ 105 В·см–1 (пробой воздуха происходит при напряжённости 3∙104 В·см–1).
Поверхность мембраны представляют собой границу раздела: вода-белок. Силы поверхностного натяжения, действующие на этой границе, стремятся сократить площади белковых монослоёв на внутренней и наружной поверхностях мембраны. Это приводит к сжатию липидного бислоя. Измерения коэффициента поверхностного натяжения дали значения 0,1 ÷ 1 мН/м, что хорошо согласуется с данными по белкам.
Вязкость липидного слоя мембран на два порядка выше вязкости воды и равна 30÷100 мПа·с (сравнима с вязкостью подсолнечного масла). Многие болезни связаны с отклонением микровязкости липидной фазы от нормы. Например, канцерогенез связан со снижением ее, а при старении организма вязкость возрастает.
Изменение состояния липидной молекулы, связанное с изменением температуры или химической модификацией жирнокислотного "хвоста", или же с изменением заряда головки, сопровождается изменением площади, которая приходится в мембране на одну молекулу. К такому же результату приводит воздействие на мембраны лекарственных препаратов, например, анестетиков.
Липиды биологических мембран при обычных физиологических условиях (температура, давление, химический состав окружающей среды и т.д.) находятся преимущественно в жидкокристаллическом состоянии. Такие структуры очень чувствительны к изменению температуры, давления, химического состава и электродинамических характеристик окружения. По этой причине, при изменении внешних условий липиды мембраны могут испытывать локальные или генерализованные фазовые переходы I рода из жидкокристаллического в гель-состояние, которое иногда условно называют твердокристаллическим. Для переходов I рода характерно скачкообразное изменение внутренней энергии и плотности вещества. При этом возможно появление разных кристаллических модификаций. Это превращение обусловлен о сложными физическими свойствами фосфолипидов. В жидкокристаллическом состоянии бислой имеет меньшую толщину, меньшую вязкость, меньшую упорядоченность молекул, бóльшую ионную проводимость, бóльшую растворимость веществ, чем в твердом состоянии. Различна и конформация (структура) молекул в жидком и твердом состояниях. Это подтверждается данными рентгеноструктурного анализа. В жидкой фазе молекулы фосфолипидов имеют структуру октаэдров и могут образовывать полости («кинки»), которые способны перемещаться. Внедрившись в такую полость любые молекулы получают возможность диффундировать вместе с «кинком» по мембране.
Для исследования некоторых физических свойств биологических мембран используется метод флюоресцентного анализа. Сама мембрана в нормальном состоянии не флюоресцирует. Поэтому, при использовании этого метода, в мембрану необходимо вводить молекулы или молекулярные группы, способные к флюоресценции – флюоресцентные зонды и метки. С этой целью используют молекулы диметиламинохалкона (ДМХ), анилин-нафталин-сульфонат (АНС) и другие вещества. Флюоресцентный анализ дает возможность исследовать подвижность молекул в мембране, оценить вязкость липидной фазы (микровязкость) и некоторые другие свойства. Увеличение вязкости приводит к смещению спектра флюоресценции в область более коротких волн. Микровязкость можно оценить и по степени поляризации флюоресцентного излучения: Мембрана освещается полностью поляризованным светом. Излучение флюоресценции оказывается лишь частично поляризованным. Чем больше подвижность флюоресцирующей молекулы, тем меньше вязкость, тем меньше степень поляризации.
Наиболее полное представление об агрегатном состоянии липидных бислоев дают методы радиоспектроскопии – электронный парамагнитный резонанс (ЭПР) и ядерный магнитный резонанс (ЯМР).
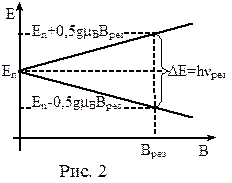 ЭПР – это явление резкого возрастания поглощения энергии электромагнитного излучения резонансной частоты νрез. системой парамагнитных частиц, помещённой в постоянное магнитное поле. Такие частицы обладают неспаренными электронами, а значит и нескомпенсированным магнитным моментом атома (например, свободные радикалы). Будучи помещёнными в постоянное магнитное поле, такие атомы испытывают расщепление энергетических уровней (рис.2). Переходы между уровнями соответствуют микроволновому диапазону электромагнитного излучения.
ЭПР – это явление резкого возрастания поглощения энергии электромагнитного излучения резонансной частоты νрез. системой парамагнитных частиц, помещённой в постоянное магнитное поле. Такие частицы обладают неспаренными электронами, а значит и нескомпенсированным магнитным моментом атома (например, свободные радикалы). Будучи помещёнными в постоянное магнитное поле, такие атомы испытывают расщепление энергетических уровней (рис.2). Переходы между уровнями соответствуют микроволновому диапазону электромагнитного излучения.
 Спектром ЭПР называют зависимость энергии E, поглощённой исследуемым веществом, от величины индукции B магнитного поля (рис.3). Если в структуре электронных оболочек атомов неспаренные электроны отсутствуют, то для исследования таких веществ используют спин-метки и спин-зонды, обладающие такими электронами. Эти соединения вводят в изучаемую структуру в процессе химического синтеза. В качестве спин-меток и спин-зондов используют соединения, представляющие собой различные нитроксильные радикалы (
Спектром ЭПР называют зависимость энергии E, поглощённой исследуемым веществом, от величины индукции B магнитного поля (рис.3). Если в структуре электронных оболочек атомов неспаренные электроны отсутствуют, то для исследования таких веществ используют спин-метки и спин-зонды, обладающие такими электронами. Эти соединения вводят в изучаемую структуру в процессе химического синтеза. В качестве спин-меток и спин-зондов используют соединения, представляющие собой различные нитроксильные радикалы (  ), которые можно присоединить к любому атому углерода углеводородной цепочки молекул липидов. При этом метка замещает какую-либо группу, образуя с молекулой ковалентные связи. Соединения-зонды встраиваются в молекулы липидов и удерживаются там электростатическими или гидрофобными силами.
), которые можно присоединить к любому атому углерода углеводородной цепочки молекул липидов. При этом метка замещает какую-либо группу, образуя с молекулой ковалентные связи. Соединения-зонды встраиваются в молекулы липидов и удерживаются там электростатическими или гидрофобными силами.
 Применение ЭПР основано на том, что форма спектра (вид графика поглощения) зависит от свойств окружения зонда или метки, а в первую очередь от микровязкости среды (рис.4). По характеру изменения спектра ЭПР можно безошибочно обнаружить не только перемещения хвоста с присоединённой сигнальной группой, но и определить скорость латеральной диффузии (D ≈ 1,8·10-8 см2с-1). Было установлено, что скорость поперечного перемещения (флип-флоп) липидов в 103 раз меньше, чем латерального. В жидкокристаллической фазе жирнокислотные цепи фосфолипидов обладают значительно большей подвижностью, чем в твердой фазе. Методом ЭПР установлено снижение подвижности липидов при увеличении содержания холестерина, перекисном окислении и действии ряда лекарственных препаратов. Увеличение подвижности отмечено при тиреотоксикозах и ряде других патологий. Недостаток метода: внедрение зонда или метки изменяет химическую структуру молекул фосфолипидов.
Применение ЭПР основано на том, что форма спектра (вид графика поглощения) зависит от свойств окружения зонда или метки, а в первую очередь от микровязкости среды (рис.4). По характеру изменения спектра ЭПР можно безошибочно обнаружить не только перемещения хвоста с присоединённой сигнальной группой, но и определить скорость латеральной диффузии (D ≈ 1,8·10-8 см2с-1). Было установлено, что скорость поперечного перемещения (флип-флоп) липидов в 103 раз меньше, чем латерального. В жидкокристаллической фазе жирнокислотные цепи фосфолипидов обладают значительно большей подвижностью, чем в твердой фазе. Методом ЭПР установлено снижение подвижности липидов при увеличении содержания холестерина, перекисном окислении и действии ряда лекарственных препаратов. Увеличение подвижности отмечено при тиреотоксикозах и ряде других патологий. Недостаток метода: внедрение зонда или метки изменяет химическую структуру молекул фосфолипидов.
Этого недостатка лишён метод ядерного магнитного резонанса (ЯМР). Ядерный магнитный резонанс – это явление резкого возрастания поглощения энергии электромагнитных волн определённой частоты (νрез) системой парамагнитных ядер, помещенных в постоянное магнитное поле. Частота переменного электромагнитного поля νрез меньше, чем при ЭПР. В структуре биологических объектов содержится много водорода, ядра которого (протоны,  ) являются парамагнитными. Это дает возможность применять при изучении подвижности молекул фосфолипидов метод ЯМР.
) являются парамагнитными. Это дает возможность применять при изучении подвижности молекул фосфолипидов метод ЯМР.