РОБОТА 6.2. ВИЗНАЧЕННЯ ФЕРМЕНТАТИВНИХ ВЛАСТИВОСТЕЙ СЛИНИ
У слині людини та деяких тварин (свині) є амілолітичні ферменти – амілаза та мальтаза (глюкозідаза). У слині коней кількість амілолітичних ферментів незначна, у жуйних вони майже відсутні. Фермент амілаза розщеплює крохмаль до дисахариду мальтози, а мальтаза, в свою чергу, розщеплює мальтозу до глюкози.
Мета роботи
1) встановити наявність амілолітичних ферментів у слині людини і свині та їх відсутність у слині собаки і теляти;
2) встановити, що дія ферментів слини проявляється тільки за певних умов середовища. Матеріали і обладнання. Розбавлена слина свині, теляти, собаки, людини, 1%-ний розчин крохмалю, 10%-ний розчин NаОН, 0,5%-ний розчин соляної кислоти, розчин Люголя, водяна баня, термометр, олівець по склу, штативи, нумеровані пробірки, лієчка з ватою для збирання слини людини, скляні палички, мірні піпетки.
Хід роботи
Розбавлену слину людини отримують перед початком досліду. Для цього в ротову порожнину зі стакана набирають воду. Через 1–2 хвилини воду разом зі слиною фільтрують.
Протокол досліду
| № п/п | Вміст пробірки | Результати |
| 1. 2. 3. 4. 5. 6. 7. | 1 мл слини людини + 2 мл 1%-ного крохмального клейстеру 1 мл слини свині + 2 мл 1%-ного крохмального клейстеру 1 мл слини теляти + 2 мл 1%-ного крохмального клейстеру 1 мл слини собаки + 2 мл 1%-ного крохмального клейстеру 1 мл прокип’яченої слини людини + 2 мл 1%-ного крохмального клейстеру 1 мл слини людини + 5 крап. 0,5%-ного розчину НС1 + 2 мл 1%-ного крохмального клейстеру 1 мл слини людини + 5 крап. 10 %-ного NaОН + 2 мл 1%-ного крохмального клейстеру |
Спочатку в пробірку наливають слину, а потім додають розчин крохмального клейстеру. Пробірки струшують, фіксують час і поміщають у водяну баню за температури 38–40 °С на 10 хвилин. Через 10 хвилин пробірки виймають з водяної бані, ставлять у штатив, і в кожну вносять по декілька крапель розчину Люголя. Читають реакцію на йод і записують результати та висновки.
Контрольні питання
1. Які фізико-хімічні властивості слини?
2. Ферменти слини жуйних та особливості слиновиділення у цих тварин.
3. Яке значення слини?
4. Оптимальні умови, необхідні для дії слинних ферментів.
5. Особливості слини, виділеної різними залозами.
РОБОТА 6.3. НАКЛАДАННЯ ФІСТУЛИ НА ШЛУНОК ТВАРИН
Операція з накладання шлункової фістули проводиться для отримання шлункового соку, який секретують залози шлунка. Методика накладання фістули на шлунок була вперше запропонована хірургом В. А. Басовим в 1842 році. Фістульних тварин можна використовувати не тільки для отримання шлункового соку, але й для запису моторики шлунка, а разом з езофаготомією – і для отримання чистого шлункового соку.
Мета роботи. Ознайомити студентів з основними хірургічними прийомами під час підготовки тварин до хронічних експериментів.
Матеріали і обладнання. Тварина (собака, порося), фіксаційний столик, набір хірургічних інструментів, перев’язувальний та шовний матеріал, спирт, йод, 2,5%-ний розчин аміназину, 10%-ний розчин гексеналу, шприци, ін’єкційні голки, фізіологічний розчин, 0,3%-ний розчин НСl, фістульна трубка.
Хід роботи
Накладання шлункової фістули у собаки за В. А. Басовим
За добу до операції тварині не дають корму. Перед операцією підшкірно вводять 2,5%-ний розчин аміназину в дозі 1,0–1,5 мл на 10 кг живої ваги. Через 20–30 хв собаку фіксують на операційному столику на спині. Операційне поле голять та дезінфікують розчином йоду. По білій лінії черевної стінки роблять розріз довжиною 5–6 см. Виймають шлунок. На середині передньої стінки шлунка, ближче до великої кривизни, накладають кисетний шов, захоплюючи ним серозний та м’язовий шари. Зовні від кисетного шва, на відстані 2 см, накладають 2 підтримуючі шви, один поряд з другим. У середині кисетного шва скальпелем розрізають стінку шлунка. Через розріз у порожнину шлунка вводять фістульну трубку. Краї рани завертають всередину, кисетний шов затягують і зав’язують хірургічним вузлом. Шлунок знову поміщають в черевну порожнину, а фістульну трубку біля кисетного шва покривають сальником. Зовнішній кінець трубки через отвір рани виводять на поверхню черевної стінки біля переднього краю рани. Підтримуючі шви пропускаємо через черевну стінку. На операційну рану пошарово накладають вузлові шви. Під підтримуючі шви підкладають марлеві валики і зав’язують ці шви. Рану закривають колоїдною пов’язкою. Підтримуючі шви знімають на третю добу, а шкіряні – через 7 днів після операції.
Операція ізольованого шлуночка у поросяти за І.П.Павловим
За добу до операції тварину витримують голодною. Фіксують на операційному столику черевом вверх. Для наркозу у вушну вену вводять 10%-ний розчин гексеналу з розрахунку
0,05 г на 1 кг маси тіла.
Після обробки операційного поля роблять розріз черевної стінки по білій лінії, довжиною 10–12 см. Виймають шлунок і ближче до великої кривизни, на ділянці передбаченого ізольованого шлунка, накладають два кишкових затискувачі. Перев’язують великі судини і розрізають обидві стінки шлунка в напрямку від його пілоричної частини до кардіальної, не доходячи до неї 4–6 см. Тампоном, змоченим розчином 0,3%-ної соляної кислоти, протирають слизову оболонку ізольованого клаптика. Згортають його марлевою салфеткою, змоченою фізіологічним розчином. У місці з’єднання ізольованого клаптика з шлунком перерізають і видаляють слизову оболонку, оголюючи ділянку підслизової шириною 1,5–2 см. Накладають три кисетних шви, щоб запобігти проходженню корму з великого шлунка в маленький. Безперервним швом зашивають слизову оболонку великого шлунка, а потім маленького так, щоб краї завернулись всередину. Другий поверх швів накладають на серозний та м’язовий шари. Знімають кишкові жоми. На вільному кінці маленького шлуночка залишають отвір для введення фістульної трубки й фіксують кисетним швом. Ранову поверхню шлунків покривають сальником і опускають в черевну порожнину так, щоб кінець фістульної трубки знаходився на зовнішній поверхні черевної стінки. Розріз черевної стінки зашивають трьома поверхами вузлових швів. На сьомий день шкіряні шви знімають. Після операції тварину 10 днів витримують на особливій дієті.
Контрольні питання
1. Що таке фістула?
2. Хто і коли вперше запропонував фістулу шлунка?
3. Ким вперше розроблені фістульні методики для дослідження різних відділів травного каналу?
4. Які переваги фістульного методу в порівнянні з гострими дослідами?
5. У чому полягають переваги та недоліки шлункової фістули за В.А. Басовим?
6. Чим відрізняється ізольований шлунок за І.П. Павловим від шлуночка за Гайденгайном?
РОБОТА 6.4. СЕКРЕЦІЯ ШЛУНКОВОГО СОКУ
Для вивчення закономірностей соковиділення на різні види корму та для отримання чистого шлункового соку без домішків слини і кормових речовин використовують тварин з ізольованими шлуночками.
Секреція шлункового соку проходить у дві фази.
Перша фаза –складнорефлекторна, під час якої шлунковий сік виділяється в результаті подразнення рецепторів ротової порожнини під час прийому корму, а також за сприймання запаху корму, його виду. Фаза продовжується 0,5–1,5 год.
Друга фаза– нейрогуморальна. Вона обумовлена впливом екстрактивних речовин корму та продуктів його розщеплення, які всмоктались в кров. Тривалість цієї фази 4–6 год.
Мета роботи1) прослідкувати за секрецією соку в ізольованому шлуночку під час годівлі поросяти за І.П. Павловим; 2) визначити реакцію шлункового соку; 3) визначити роль механорецепторів у секреції шлункового соку.
Матеріали і обладнання.Порося з ізольованим шлуночком за І.П. Павловим, або собака з фістулою шлунка за В.А. Басовим, станок, стакан для збирання шлункового соку, мірний циліндр або градуйована пробірка, 5-хвилинний пісковий годинник, лакмусовий папір, корм.
Хід роботи
Секреція шлункового соку у поросяти з ізольованим шлуночком за І.П. Павловим
Перед дослідом тварину витримують на голодній дієті 16–18 год. Поміщають в станок, до фістули прикріплюють стаканчик для збирання соку. Впродовж перших 15 хв з інтервалом 5 хв збирають шлунковий сік, заміряють його кількість (для встановлення фону секреції), потім тварині згодовують 0,5 кг вареної картоплі і продовжують визначати шлункову секрецію протягом 1–1,5 год через кожні 5 хвилин. За допомогою лакмусового папірця визначають реакцію соку. Ведуть протокол досліду та будують графік секреції шлункового соку.
Роль механорецепторів у секреції шлункового соку
Тварину, що була на голодній дієті, поміщають в станок, підвішують стаканчик для збирання шлункового соку. Визначають фон секреції, для чого декілька разів через кожні 5 хв збирають шлунковий сік та заміряють його кількість. Потім гумовий балон вводять через фістулу і гумовою грушею надувають. Балон тримають в шлунку 15–20 хв, а потім виймають. Шлункову секрецію визначаємо під час подразнення і після нього. Визначають реакцію шлункового соку лакмусовим папером. Ведуть протокол досліду, замальовують графік секреції шлункового соку.
Контрольні питання
1. Особливості шлункової секреції у свиней.
2. Фази секреції шлункового соку та їх механізм.
3. Вплив різних видів кормів на інтенсивність секреції соку.
4. Роль механорецепторів слизової оболонки шлунка.
5. Вплив симпатичної та парасимпатичної нервової систем на секрецію шлункового соку та моторику шлунка.
РОБОТА 6.5. ДІЯ ФЕРМЕНТІВ ШЛУНКОВОГО СОКУ НА БІЛКИ
Шлунковий сік –прозора рідина, до складу якої входить 0,4–0,8% сухої речовини. У зв’язку з наявністю соляної кислоти, має кислу реакцію. У шлунковому соці є декілька видів ферментів: пепсин розщеплює білки до альбумоз і пептонів; хімозин (ренін) – зумовлює зсідання білка молока; шлункова ліпаза – розщеплює, в основному, жири на гліцерин та жирні кислоти. Крім ферментів у шлунковому соці є соляна кислота та шлунковий слиз.
Мета роботи
1) визначити травну силу пепсину і реніну на білки та казеїноген молока;
2) встановити роль соляної кислоти в активації ферментів та травленні білків;
3) визначити протеолітичну активність шлункового соку.
Матеріали і обладнання.Натуральний шлунковий сік, нейтралізований шлунковий сік, кип'ячений шлунковий сік, 0,5%-ний розчин соляної кислоти, фібрин, паличка Метта, пробірки, штативи, піпетки на 2 мл, спиртівка, водяна баня, олівець по склу, термостат, термометр.
Хід роботи
Дія шлункового соку на фібрин
Дослід проводять у чотирьох пронумерованих пробірках за такою схемою:
| № пробірки | Реактиви | Результати |
| 1. | 2 мл 0, 5%-ної соляної кислоти + 2 нитки фібрину | |
| 2. | 2 мл натурального шлункового соку + 2 нитки фібрину | |
| 3. | 2 мл нейтралізованого шлункового соку + 2 нитки фібрину | |
| 4. | 2 мл прокип’яченого шлункового соку + 2 нитки фібрину |
Всі пробірки ставлять у водяну баню за tо 38–40°С на 30 хвилин, після чого записують результати дослідів.
Дія шлункового соку на білки молока
Дослід проводять у чотирьох пронумерованих пробірках за такою схемою:
| № пробірки | Реактиви | Результати |
| 1. | 2 мл молока + 3 краплі 0,5 %-ного соляної кислоти | |
| 2. | 2 мл молока + 3 краплі натурального шлункового соку | |
| 3. | 2 мл молока + 3 краплі нейтралізованого шлункового соку | |
| 4. | 2 мл молока + 3 краплі прокип’яченого шлункового соку |
Пробірки струшують, ставлять у водяну баню на 10 хв, після чого записують результати дослідів та роблять висновки.
Визначення протеолітичної активності пепсину за Меттом
Палички Метта готують раніше. Для цього скляні трубки діаметром 1 мм заповнюють яєчним білком і ставлять у киплячу воду на 6–8 хв для зсідання білка. Потім палички виймають та їх кінці заклеюють мендєлєєвською замазкою. Так вони зберігаються в гліцерині до вживання. Перед дослідом їх ріжуть на шматки по 2 см і опускають по 2 шматки в пробірку зі шлунковим соком для визначення його перетравлювальної сили. Пробірки на 24 год залишають в термостаті за температури 38 °С. Потім палички виймають, поміщають на міліметровий папір, визначають довжину (в мм) перетравленої частини білка на кожному кінці палички і виводять середню.
Контрольні питання
1. Фізико-хімічні властивості шлункового соку.
2. Ферменти шлункового соку та умови, необхідні для їх дії.
3. Значення соляної кислоти шлункового соку.
4. Кількісні та якісні показники шлункового соку, який виділяється різними відділами слизової оболонки (у фундальній та пілоричній частинах, на великій та малій кривизні).
5. Вплив різних кормів на перетравлювальну силу шлункового соку.
РОБОТА 6.6. ЕВАКУАЦІЯ ВМІСТУ ШЛУНКА В КИШЕЧНИК
Перехід вмісту шлунка в кишечник проходить невеликими порціями. В цьому процесі активну участь бере пілоричний сфінктер, котрий періодично закривається та відкривається. Відкриття сфінктера відбувається тоді, коли в пілоричну частину переходить кислий хімус, а в дванадцятипалій кишці реакція ще лужна. Закриття сфінктера спостерігається відразу, як тільки зі шлунка в дванадцятипалу кишку переходить порція кислого хімусу. Таким чином, соляна кислота залежно від подразнюваного рецептивного поля спричинює різну реакцію сфінктера. Швидкість переходу вмісту шлунка в кишечник залежить від його температури, реакції, ступеня подрібнення, осмотичного тиску.
Запиральний пілоричний рефлекс було встановлено Сердюковим в 1899 р. в лабораторії І.П. Павлова.
Мета роботи.Визначити вплив температури, реакції середовища на швидкість переходу хімусу зі шлунка в дванадцятипалу кишку.
Матеріали і обладнання.Собака з фістулою шлунка за В.А. Басовим, станок, лійка, гумова трубка з корком, мірний циліндр, термометр, десятихвилинний годинник, вода тепла та холодна, 1%-ний розчин соди, 0,3 %-ний розчин соляної кислоти, рослинна олія.
Хід роботи
Собаку, яка була на голодній дієті 16–18 годин, ставлять у станок. У фістульну трубку вставляють корок з гумовою трубкою, до якої прикріплюють лійку.
Через лійку в шлунок почергово заливаємо згадані вище рідини і залишаємо кожну з них на 10 хв, після чого рідину виливаємо зі шлунка. За різницею введеної та виведеної рідини визначаємо швидкість її евакуації в кишечник. Отримані результати записуємо в таблицю:
| № п/п | Назва розчину | Залито, мл | Залишилось, мл | Евакуювалось, мл |
| 1. | 1%-ний розчин соди | 200 мл | ||
| 2. | 0,3%-ний розчин НСl | 200 мл | ||
| 3. | Холодна вода | 200 мл | ||
| 4. | Тепла вода | 200 мл |
Контрольні питання
1. Фактори, які впливають на відкриття пілоричного сфінктера.
2. Інтервал роботи пілоричного сфінктера.
3. Які рецептори розташовані в області пілоруса?
РОБОТА 6.7. ДІЯ ЖОВЧІ ТА ПІДШЛУНКОВОГО СОКУ НА ЖИРИ
Сік підшлункової залози містить багато гідролітичних ферментів, що забезпечують розщеплення білків, жирів та вуглеводів. Активно діє підшлункова ліпаза, яка розщеплює жири до гліцерину та жирних кислот у лужному середовищі.
Під впливом жовчі відбувається емульгування жирів, що сприяє більш повному та швидкому їх розщепленню ліпазою; нейтралізуються також кислоти шлункового соку, підтримується кислотно-лужна рівновага кишкового хімусу, посилюється активність ферментів кишкового та підшлункового соку. Жовч має також бактерицидні властивості та стимулює моторну функцію кишечнику.
Мета роботи:1) встановити наявність емульгуючої дії жовчі; 2) визначити вплив жовчі на швидкість перетравлювання жиру підшлунковою ліпазою.
Матеріали і обладнання.Натуральний шлунковий сік або витяжка з підшлункової залози, жовч, вода, олія, спиртовий розчин фенолфталеїну, децинормальний розчин NаОН, скляні лійки, штативи, мірні пробірки, паперові фільтри, водяна баня.
Хід роботи
Вплив жовчі на фільтрацію жиру
Улійку однієї з пронумерованих пробірок ставлять фільтр, змочений жовчю, а в другу – фільтр, змочений водою. В лійки наливають по 2 мл олії, визначаючи час фільтрації.
Емульгування жиру
У дві пронумеровані пробірки наливають по 0,5 мл олії. У пробірку № 1 додають 5 мл жовчі, а в пробірку № 2–5 мл води. Добре перемішують вміст пробірок і спостерігають за стійкістю отриманої емульсії.
Вплив жовчі та підшлункового соку на швидкість травлення жиру Втри пронумеровані пробірки наливають олію, підшлунковий сік та жовч у кількості, яка зазначена в протоколі досліду.
Протокол досліду
| № п/п | Найменування та кількість реактивів | Кількість крапель фенолфталеїну | Результати |
| 1. | 0,5мл олії +2 мл натурального підшлункового соку | ||
| 2. | 0,5мл олії + 2 мл прокип’яченого підшлункового соку | ||
| 3. | 0,5 мл олії + 2 мл підшлункового соку + 0,5 мл жовчі |
Із бюретки в кожну пробірку по краплі вносять децинормальний розчин NаОН до появи червоного забарвлення. Потім пробірки ставлять у водяну баню за т емператури
38–40 °С і спостерігають, через скільки хвилин відбудеться знебарвлення рідини в кожній пробірці. Результати спостережень заносять в протокол досліду та пишуть висновки.
Контрольні питання
1. Механізм дії фермента підшлункового соку, який розщеплює жири.
2. Роль жовчі в травленні жиру та інших травних процесах.
3. Механізм емульгування жиру жовчю.
4. Склад жовчі та умови її утворення.
РОБОТА 6.8. МОТОРНА ДІЯЛЬНІСТЬ ТРАВНОГО КАНАЛУ
Моторна функція – одна з важливих функцій органів травлення, з допомогою якої забезпечується рух вмісту шлунка до кишечнику і далі. Моторна функція сприяє подрібненню, перемішуванню та кращому травленню і всмоктуванню поживних речовин корму. В шлунково-кишковому каналі розрізняють декілька типів скорочень: ритмічні, тонічні, маятникоподібні, перистальтичні та антиперистальтичні. Кожний з відділів травного каналу характеризується певними особливостями моторики. Регуляція моторики органів травлення здійснюється рефлекторно і під впливом хімічних речовин.
Мета роботи:1) визначити види скорочень шлунка та різних відділів кишечнику; 2) встановити особливості впливу симпатичних та парасимпатичних нервів на моторну діяльність і автоматизм травного каналу; 3) встановити роль механо-, термо-, хеморецепторів у здійсненні моторної діяльності шлунково-кишкового каналу.
Матеріали і обладнання. Морська свинка, жаба, фіксаційний столик, набір інструментів, вода, розчин Рінгера (для холоднокровних та теплокровних), гіпертонічний розчин NаСl, ефір, лійка, салфетки, індукційний апарат, електрична плитка.
Хід роботи
Дослідження моторної діяльності травного каналу у жаби
Децеребровану жабу фіксують на столику черевцем доверху. Розрізають черевну стінку, оголюючи кишкові петлі.
1. Подразнюємо довгастий мозок індукційним струмом і спостерігаємо за скороченням шлунково-кишкового каналу.
2. В окремих відділах кишечнику наносимо механічні та хімічні подразнення.
Спостереження за моторикою травного каналу у морської свинки
Морську свинку фіксують на операційному столику черевцем доверху і наркотизують ефіром. На шиї препарують блукаючий нерв. Роблять розріз черевної стінки, оголюючи шлунок та кишечник.
1. Спостерігають за моторикою шлунково-кишкового каналу в звичайних умовах.
2. Перерізають блукаючий нерв і його периферійний кінець подразнюють індукційним струмом.
3. Вирізають шлунково-кишковий канал і послідовно занурюють в розчин Рінгера (37 оС, 43 оС) та в гіпертонічний розчин NаСl (+37 °С).
У всіх випадках спостерігають за зміною моторики шлунково-кишкового каналу і звертаютъ увагу на види скорочень шлунка та кишечнику.
Контрольні питання
1. Значення моторної діяльності шлунково-кишкового каналу.
2. Види скорочень шлунка і кишечнику.
3. Регуляція моторики шлунково-кишкового каналу.
4. Особливості моторики передшлунків у жуйних.
5. Причини скорочень ізольованого кишечнику.
6. Які хімічні речовини стимулюють моторику шлунка та кишечнику?
РОБОТА 6.9. ДОСЛІДЖЕННЯ ПРИСТІНКОВОГО (МЕМБРАННОГО)
ТРАВЛЕННЯ В КИШЕЧНИКУ
Разом з травленням у порожнині кишечнику, розщеплення поживних речовин проходить безпосередньо на поверхні слизової оболонки кишечнику. Слизова оболонка тонкого кишечнику має безліч мікроворсинок, а це значно посилює ферментативні процеси і сприяє розщепленню поживних речовин на поверхні мікроворсинок. Цей процес був названий пристінковим, або мембранним травленням. Наявність пристінного травлення підтверджується, зокрема тим фактором, що в присутності шматочка стінки або слизової кишки ферментативне розщеплення поживних речовин значно посилюється.
Мета роботи.Підтвердити стимулюючий вплив шматочка кишечної стінки на гідроліз крохмалю амілазою кишкового соку.
Матеріали і обладнання.Свіжі шматочки тонкого відділу кишечнику щойно забитих тварин (птахи, кролики, щурі і т. д.). Можна використовувати шматочки тканин від тварин, забитих на бойні, після їх промивання холодним розчином Рінгера та обробки ацетоном, 0,2 %-ний розчин крохмального клейстеру, розчин Рінгера, реактиви для проби Троммера, пробірки, термостат, холодна вода, штативи.
Хід роботи
У пробірку наливаємо 12 мл розчину Рінгера. Готуємо 5 шматочків зі стінки порожньої кишки площею 1 см2 і опускаємо їх в пробірку. Все це інкубуємо 10 хв в термостаті за температури 38 °С. Дістаємо пробірку, а з неї виймаємо шматочки стінки кишки.
У 10 пробірок наливають по 3 мл 0,2%-ного розчину крохмального клейстеру і по 1 мл інкубаційного розчину. В пробірки № 6–10, крім того, опускають шматочок відмитої тонкої кишки. Всі пробірки ставлять в термостат за температури 38 °С. Виймаємо по 1 пробірці з серії (1–6; 2–7 і т. д.) через кожні 3 хв після початку інкубації і ставимо в холодну воду або сніг. Із вмісту пробірок роблять пробу Троммера на глюкозу (шматочки під час аналізу виймають). Гідроліз крохмалю відбудеться у пробірках обох серій, але в пробірках, де був шматок кишки, позитивна реакція спостерігається раніше, тому що гідроліз субстрату йде швидше. Цьому сприяє наявність ферментів у слизовій оболонці кишки, які діють на субстрат.
Контрольні питання
1. Хто вперше описав пристінкове або мембранне травлення?
2. Які ферменти беруть участь у процесах пристінкового травлення?
3. В яких відділах шлунково-кишкового каналу спостерігається пристінкове травлення?
4. Яка роль глікокалісу?
РОБОТА 6.10. ДОСЛІДЖЕННЯ ІНФУЗОРІЙ РУБЦЯ
У рубці жуйних є велика кількість різноманітних бактерій, найпростіших і грибів. Найпростіші представлені класом війчастих інфузорій, який нараховує біля 100 видів. Інфузорії відіграють важливу роль в рубцевому травленні. З їх допомогою проходить механічна обробка корму, вони використовують для свого живлення важкоперетравну клітковину. Крім того, відбувається розрихлення, подрібнення корму, переварювання білків, крохмалю, цукру та частково клітковини. Вони накопичують у своєму тілі полісахариди, а також здатні синтезувати вітаміни групи В.
Мета роботи:1) ознайомитись з різновидностями рубцевих інфузорій, їх розмірами та характером руху; 2) провести підрахунок кількості інфузорій в рідині рубця.
Матеріали і обладнання.Свіжий вміст рубця, мікроскоп, змішувач для підрахунку лейкоцитів, предметні та покривні скельця, скляні палички, камери Горяєва.
Хід роботи
Спостереження за життєдіяльністю інфузорій за різних температурних умов
На предметне скло наносять скляною паличкою краплю вмісту рубця, покривають покривним склом, спостерігають під мікроскопом за малого, а потім великого збільшення. Препарат охолоджують, а потім підігрівають до 45 °С і в кожному випадку спостерігають під мікроскопом.
Підрахунок інфузорій
У змішувач для лейкоцитів набирають із пробірки вміст рубця до мітки 1,0, а до мітки 11 набирають фізіологічний розчин, підфарбований метиленовою синькою. Заповнюють камеру Горяєва і підраховують інфузорії в 100 великих квадратах. Потім за формулою для підрахунку лейкоцитів крові визначають кількість інфузорій в 1 мкл вмісту і роблять перерахунок для визначення їх в 1 мл.
Контрольні питання
1. Роль мікрофлори в передшлунках жуйних.
2. В якому віці у тварин з'являються інфузорії в передшлунках?
3. Як змінюється кількість інфузорій залежно від виду корму?
4. Оптимальні умови для розвитку інфузорій та іншої мікрофлори в рубці.
7. ФІЗІОЛОГІЯ КРОВІ
Кров – рідка сполучна тканина – складає разом з лімфою та тканинною рідиною внутрішнє середовище організму, що омиває всі клітини тіла. Підтримуючи відносну постійність свого складу, кров здійснює стабілізацію внутрішнього середовища (гомеостаз), забезпечує поряд з нервовою системою функціональну єдність систем організму, бере участь в обміні речовин, диханні, виділенні, терморегуляції, виконує захисну функцію організму. Кров і органи, в яких відбувається утворення і руйнування кров’яних клітин, об’єднують в єдину систему крові. До неї відносять: кров, кістковий мозок, печінку, селезінку і лімфатичні вузли.
РОБОТА 7.1. ОТРИМАННЯ ПЛАЗМИ, СИРОВАТКИ, ФІБРИНУ І ДЕФІБРИНОВАНОЇ КРОВІ
Кров складається з рідкої частини – плазми і формених елементів: еритроцитів, лейкоцитів і тромбоцитів. Сироватка крові – це плазма, позбавлена фібрину. Видаляючи механічним шляхом із крові фібриноген, отримуємо дефібриновану кров.
Мета роботи:1) визначити співвідношення та взаємозв’язок складових частин крові;
2) отримати плазму, сироватку, дефібриновану кров і фібрин.
Матеріали і обладнання.Дослідна тварина, апарат Базерона, секундомір, розплавлений парафін, водяна баня, сніг чи холодна вода, пробірки хімічні та центрифужні, ін'єкційна голка, дерев’яна паличка, спирт, вата, вода, лимонно-кислий натрій.
Хід роботи
Отримання плазми
У пробірку насипають 20–30 мг лимонно-кислого натрію або наливають 0,5 мл його 5 %-ного розчину. Наповнюють пробірку кров’ю з яремної або вушної вени і перемішують. Пробірки з кров’ю центрифугують і відмічають пошарове розділення крові.
Визначення часу згортання крові
Для виконання роботи використовують апарат Базерона, який складається з двох камер – верхньої повітряної та нижньої водяної. В повітряній камері на зйомній металічній рамці за допомогою двох затискачів фіксується скло, яке з'єднане з вологим марлевим мішечком. У повітряну камеру наливають 15 мл теплої води для зволоження марлевого мішечка і вставляють термометр. У водяну камеру наливають 150 мл води і вставляють термометр водяної камери. Спиртівкою підігрівають водяну камеру і слідкують, щоб температура в повітряній камері була в межах 36–37 °С.
На ввігнуте скло, покрите парафіном, наносять дві краплі крові, включають секундомір, закривають повітряну камеру кришкою і через скло ведуть спостереження. Ввігнуте скло через кожні 30 с обережно повертають в одну сторону (на себе). Закінченням процесу зсідання крові вважають той момент, коли у разі повертання ввігнутого скла на 90° кров з нього не стікає. Цей час відмічають за секундоміром.
Визначення швидкості згортання крові
Три пронумеровані пробірки наповнюють кров’ю з кровоносної судини. Першу пробірку ставлять в сніг чи холодну воду, другузалишають в штативі за кімнатної температури, а третю поміщають у водяну баню за температури 45 °С. Слідкують за швидкістю зсідання крові. Для цього фіксують час від початку взяття крові до моменту зсідання.
Вплив температури на швидкість згортання крові
Три пронумеровані пробірки наповнюють кров’ю з кровоносної судини. Першу пробірку ставлять на лід чи холодну воду, другу залишають в штативі за кімнатної температури, а третю поміщають у водяну баню за температури 45 оС. Визначають швидкість згортання крові. Для цього фіксують час від початку взяття крові до моменту згортання.
Отримання сироватки крові
Пробірку наповнюють кров’ю і ставлять у водяну баню за t 38–40 °С, чекають, поки утворитъся згусток.. Утворений згусток крові відокремлюють скляною паличкою від стінок пробірки. Потім пробірку зі згустком знову поміщають у водяну баню на 1–1,5 год, після чого розглядаютъ вміст пробірки.
Отримання дефібринованої крові та фібрину
У пробірку набирають з вени 3–5 мл крові. Протягом 5–10 хв кров перемішують дерев’яною паличкою. Паличку з осілими на ній нитками фібрину промивають у воді до знебарвлення. Перевіряють, чи не звернулась дефібринована кров, що залишилась у пробірці. Розглядаютъ осілі на паличці нитки фібрину.
Контрольні питання
1. Техніка взяття крові для аналізу.
2. Плазма і сироватка крові та їх хімічний склад.
3. Декальцинована кров та їі властивості.
4. Дефібринована кров та її властивості.
5. Механізм зсідання крові та фактори, що впливають на нього.
6. Швидкість зсідання крові у різних тварин.
РОБОТА 7.2. ГЕМОЛІЗ I ОСМОТИЧНА РЕЗИСТЕНТНІСТЬ ЕРИТРОЦИТІВ (ОРЕ)
Гемоліз – це вихід гемоглобіну в плазму (розчин), який обумовлений розривом (пошкодженням чи розчиненням) оболонки еритроцита. Гемоліз може бути спричинений дією різних руйнівних факторів: механічних, термічних, хімічних, біологічних. Під резистентністю (стійкістю) еритроцитів розуміють їх здатність протистояти різним руйнівним факторам. Найчастіше досліджують резистентність еритроцитів до гіпотонічних розчинів хлористого натрію, тобто їх осмотичну стійкість.
Мета роботи:1) простежити за явищем гемолізу еритроцитів під впливом руйнівних факторів з різним механізмом дії; 2) визначити осмотичну стійкість еритроцитів різних тварин.
Матеріали і обладнання.Пробірки, предметні та покривні скельця, скляна паличка, піпетки на 1 та 5 мл, піпетка для очей, нашатирний спирт, 0,2, 0,65, 1, 3%-ний розчини NаСl, дистильована вода, декальцинована кров, центрифуга, ножиці, мікроскоп, жаба.
Хід роботи
Гемоліз під впливом фізичних та хімічних факторів
Беруть три пронумеровані пробірки. В першу наливають 5 мл дистильованої води та 5 крапель крові. У другу – 5 мл 1%-ного NаСl, 1 мл нашатирного спирту та 5 крапель крові. В третю – 5 мл 1%-ного NaСl та 5 крапель крові. Всі пробірки зтрушують, ставлять на 5 хв у штатив. Записують результати, звертаючи увагу на ступінь забарвлення рідини та її прозорість.
Визначення осмотичної резистентності еритроцитів
Готують розчини NаСl різної концентрації з 1%-ного розчину NаСl за схемою, яка дана нижче.
У кожну пробірку піпеткою вносять по дві краплі декальцинованої крові, добре змішують і дають відстоятися 3–5 хв, а потім центрифугують. За результатами досліду визначають мінімальну, максимальну резистентність та ширину резистентності еритроцитів.
| № п/п | 1%-ний NaCl, мм | Дистильована вода | Концентрація NаСl, % | Забарвлення р-ну після центрифу-гування | Осад еритроцитів | Межа резис-тентності | |
| 1. | 0,9 | 0,1 | 0,9 | ||||
| 2. | 0,8 | 0,2 | 0,8 | ||||
| 3. | 0,7 | 0,3 | 0,7 | ||||
| 4. | 0,6 | 0,4 | 0,6 | ||||
| 5. | 0,5 | 0,5 | 0,5 | ||||
| 6. | 0,4 | 0,6 | 0,4 | ||||
| 7. | 0,3 | 0,7 | 0,3 | ||||
| 8. | 0,2 | 0,8 | 0,2 | ||||
Зміни еритроцитів жаби під впливом гіпо- та гіпертонічного розчинів
На три пронумерованих скла наносять по одній краплі 0,2, 0,65 та 3%-ного розчинів NаСl. Потім до всіх крапель скляною паличкою додають невелику кількість крові жаби, змішують з розчином, покривають покривним склом і розглядають під малим та великим збільшенням мікроскопа.
Враховують результати та роблять висновки.
Контрольні питання
1. Гемоліз та його причини.
2. Осмотична резистентність еритроцитів, поняття про мінімальну та максимальну резистентність еритроцитів, про ширину резистентності.
3. Ізо-, гіпо-, гіпертонічний розчини NаСl та їх дія на еритроцити.
РОБОТА 7.3. ПІДРАХУНОК КІЛЬКОСТІ ЕРИТРОЦИТІВ
Еритроцити – це червоні клітини крові, які містять гемоглобін. Еритроцити виконують життєво важливі функції: дихальну, трофічну, видільну, гомеостатичну та транспорт антитіл. Кров здорового організму в нормальних умовах має відносну постійність, але її склад коливається залежно від віку, статі, фізіологічного стану, умов навколишнього середовища. Підрахунок еритроцитів проводять в 1 мкл крові за допомогою спеціальних лічильних камер, з попереднім розбавленням крові. У ветеринарній практиці підрахунок формених елементів має важливе діагностичне значення.
Мета роботи:
1) засвоїти методику підрахунку еритроцитів;
2) ознайомитись з принципом будови та роботою целоскопа.
Матеріали і обладнання:дослідна тварина, спирт, ефір, вата, ножиці, ін'єкційна голка, змішувач для еритроцитів, піпетка П’ятницького на 3,98 мл, капілярна піпетка від гемометра Салі, 3%-ний розчин NаСl, флакон з-під пеніциліну, лічильна камера Горяєва, покривні скельця, мікроскоп, целоскоп.
Прилади для розбавлення крові та підрахунку еритроцитів
Змішувач для еритроцитів являє собою капілярну піпетку з ампулоподібним розширенням, в середині якого знаходиться скляна кулька для перемішування рідини. На змішувач нанесені мітки 0,5, 1і101. Піпетка П’ятницького – це товстостінна капілярна трубка з міткою та грушоподібним розширенням. Об’єм піпетки 3,98 мл. Лічильна камера з сіткою Горяєва –це товсте скло з чотирма жолобками, між якими розміщені три прямокутні площини. Середня площина розділена навпіл поперечним жолобком. На кожній половині нанесена сітка Горяєва, середня площина на 0,1 мм нижче бокових. Коли до бокових площин притирають покривне скло, то між ним та сіткою утворюється камера з глибиною 0,1 мм. Сітка Горяєва складається з 225 великих квадратів. З них 100 квадратів розділені на прямокутники, 100 квадратів не розділені і 25 квадратів розділені – кожний на 16 малих. Сторона малого квадрата дорівнює 1/20 мм, площа 1/20´1/20=1/400 мм2. У лабораторних тварин кров беруть з дрібних підшкірних вен вушної раковини.
Хід роботи
Уздовж зовнішнього краю вушної раковини вистригають шерсть, шкіру протирають спиртом, знежирюють ефіром, відшукують вену і проколюють її голкою, попередньо злегка стиснувши судини біля основи вуха, щоб спричинити венозну гіперемію.
Розбавлення крові у змішувачі
Першу краплю витирають ваткою, другу – всмоктують у змішувач до мітки 0,5. Потім до мітки 101 набирають 3%-ний розчин NаСl, при цьому кров розводять у 200 разів. Якщо кров набирають до мітки 1, то розводять у 100 разів. Кінці змішувача затискають між великим і середнім пальцями і струшують 2–3 хвилини для рівномірного перемішування крові з рідиною. На змішувач надівають гумове кільце, яке закриває його вільні кінці.
Розбавлення крові за допомогою піпетки П’ятницького
Піпеткою П’ятницького для еритроцитів насмоктують 3%-ний розчин NaСl до мітки 3,98 мл і виливають у сухий флакон з-під пеніциліну. Капілярною піпеткою від гемометра Салі набирають 0,02 мл крові і видувають її у флакон з 3%-ним розчином NаСl. Флакон закривають корком. Отримують розбавлення крові в 200 разів.
Заповнення лічильної камери і підрахунок еритроцитів
До чистої сухої камери притирають покривне скло (до появи райдужних кілець). Перші 3–4 краплі зі змішувача видувають на ватку, а наступну краплю наносять на середню площину камери, поряд з покривним склом. Через капілярність рідина засмоктується під скло. Із флакона, після його струшування, розведену кров наносять піпеткою для очей. Збільшення мікроскопа: об’єктив – 40  , окуляр 7
, окуляр 7 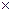 або 10
або 10 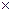 . Підраховують еритроцити у п’яти великих квадратах (80 малих), розташованих у сітці по діагоналі. В кожному малому квадраті рахують всі еритроцити, розташовані всередині нього, а також на верхній та лівій межі. Еритроцити на нижній та правій межі не враховують.
. Підраховують еритроцити у п’яти великих квадратах (80 малих), розташованих у сітці по діагоналі. В кожному малому квадраті рахують всі еритроцити, розташовані всередині нього, а також на верхній та лівій межі. Еритроцити на нижній та правій межі не враховують.
Визначення кількості еритроцитів в 1 мкл крові проводять за формулою:
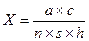 ,
,
деа – кількість підрахованих еритроцитів;
с – розведення;
n– число квадратів, у яких підраховані еритроцити;
h– глибина камери;
s– площа кожного квадрату.
Контрольні питання
1. Будова змішувача для еритроцитів і піпетки П’ятницького.
2. Будова камери Горяєва.
3. Методика підрахунку еритроцитів та визначення їх кількості в 1 мкл.
4. Функції еритроцитів, місце їх утворення в організмі, місце руйнування, строк існування еритроцитів.
5. Кількість еритроцитів у великої та дрібної рогатої худоби, свиней, коней.
РОБОТА 7.4. ПІДРАХУНОК КІЛЬКОСТІ ЛЕЙКОЦИТІВ
Лейкоцити, або білі кров’яні тільця, відіграють важливу роль у захисних та відновних процесах в організмі. Вони виконують функції фагоцитозу, утворення антитіл, знешкодження та видалення токсинів. Лейкоцити за розмірами більші від еритроцитів (їх діаметр 10–20 мк). Вони мають різні форми ядер та неоднорідну протоплазму. Кількість лейкоцитів коливається у великих межах і залежить від виду та віку тварини, від годівлі, роботи, вагітності, лактації, патологічного стану організму і т. д. Збільшення числа лейкоцитів називається лейкоцитозом,а зменшення – лейкопенією.Для розведення крові під час підрахунку лейкоцитів використовують розчин оцтової кислоти (руйнує еритроцити), підфарбований метиленовою синькою (фарбує оболонку лейкоцитів).
Мета роботи.Оволодіти методикою підрахунку лейкоцитів.
Матеріали і обладнання.Змішувач для лейкоцитів, піпетка П’ятницького на 0,38 мл, капілярна піпетка від гемометра, флакон з-під пеніциліну, лічильна камера Горяєва, мікроскоп, 3 %-ний розчин оцтової кислоти, підфарбований метиленовою синькою, вата, спирт, голка для взяття крові, дослідна тварина.
Змішувач для лейкоцитівмає менший об’єм ампулоподібного розширення, ніж змішувач для еритроцитів. На капілярну частину його нанесено поділки 0,5 та 1, а вище ампулоподібного розширення –11. Під час підрахунку лейкоцитів кров набирають до поділки 0,5 або 1. Потім всмоктують до мітки 11 розчинник (3 %-ний розчин оцтової кислоти) і перемішують. Кров розводиться в змішувачі відповідно в 10 чи 20 разів.
Хід роботи
Розведення крові за П’ятницьким
У піпетку П’ятницького на 0,38 мл насмоктують 3%-ний розчин оцтової кислоти, виливають в сухий флакон і закривають пробкою. Капілярною піпеткою від гемометра, зволоженою 3%-ним розчином лимонно-кислого натрію, набирають 0,02 мл крові, переносять у флакон з розчинником. При цьому кров розводиться в 20 разів.
Заповнення камери для підрахунку лейкоцитів проводиться в тій же послідовності, що й для підрахунку еритроцитів.
Підрахунок лейкоцитів у лічильній камері з сіткою Горяєва проводять у 100 великих неподілених квадратах, зібраних у групи по 4. Кількість лейкоцитів в 1 мкл крові визначають за допомогою тієї ж формули, що і кількість еритроцитів.
Контрольні питання
1. Функції лейкоцитів.
2. Методика підрахунку лейкоцитів.
3. Кількість лейкоцитів у різних тварин.
4. Класифікація лейкоцитів.
РОБОТА 7.5. ПРИГОТУВАННЯ ТА ФАРБУВАННЯ МАЗКІВ КРОВІ
Для вивчення структури, форми і співвідношення формених елементів готують мазки крові. Складові частини клітин – органоїди, фарбуються різними барвниками по-різному. Розглядаючи зафарбований мазок під мікроскопом, можна розділити клітини за їх морфологічною будовою і отримати інформацію про життеві процеси в живому організмі. Клітини, які містять у протоплазмі зерна, належать до групи гранулоцитів, ті, що не містять, – до групи агранулоцитів. Зернисті форми лейкоцитів за їх відношенням до різних барвників поділяються на базофіли, еозинофіли та нейтрофіли. Нейтрофіли за віком можуть бути мієлоїдними, юними, паличкоядерними і сегментоядерними. Серед незернистих форм розрізняють лімфоцити і моноцити.
Мета роботи.Засвоїти методику приготування та фарбування мазка.
Матеріали і обладнання:предметні і покривні скельця, ін’єкційна голка, спирт, фарби (азур II, еозин I), дистильована вода, склянки для фарб, піпетки, підставки і кювети для мазків, піщаний годинник на 3 хв.
Хід роботи
Приготування мазка крові
Предметне скло утримують між великим і середнім пальцями лівої руки. Першу краплю крові, що виступила після проколу, стирають ватою, а до другої невеликої краплі торкаються поверхнею предметного скла так, щоб крапля знаходилась ближче до вказівного пальця.
Великим і вказівним пальцями правої руки тримають покривне скло і ведуть його по предметному склі під кутом 45° до торкання із краплею крові. Коли кров розійдеться по лінії торкання, покривне скло повільно ведуть до великого пальця під тим же кутом. Мазок повинен мати рівні краї, бути рівномірним і тонким. Висушують мазок на повітрі, пишуть на ньому голкою номер тварини і дату взяття крові.
Фіксація та фарбування мазка
На мазок наливають 4–5 крапель метилового спирту. Через 3 хв спирт зливають і висушують мазок на повітрі.