Медико-психологическая реабилитация больных инфарктом миокарда
Карта учета самостоятельной подготовки.
ФИО____________________________________Группа__________Дата_____________
Тема_______________________________________________________________________
___________________________________________________________________________
Ответы на вопросы:
Тема № 2 Миокардиты:
МИОКАРДИТЫ
Определение, этиология, патогенез
Миокардиты — воспалительные поражения сердечной мышцы – также относятся к некоронарогенным заболеваниям миокарда. Впервые этот термин был предложен в 1837 году S. Sobernheim. На долю миокардитов приходится до 20% всех некоронарогенных заболеваний миокарда, от 4 до 11 % всех заболеваний сердечно-сосудистой системы.
Воспалительный процесс может возникнуть вследствие прямого повреждающего действия инфекционных или неинфекционных агентов или в результате косвенного воздействия этих же факторов, приводящего к формированию аллергических, иммунных или аутоиммунных реакций.
Инфекционные поражения миокарда развиваются при бактериальных, риккетсиозных, спирохетозных, грибковых, вирусных и других инфекциях. В последние десятилетия структура инфекционных агентов, вызывающих воспалительные поражения миокарда, изменилась. На смену бактериальным приходят вирусные инфекции. Сегодня насчитывается около 26 вирусов, вызывающих миокардит, число бактерий колеблется около 13. Наиболее частой причиной вирусных миокардитов являются энтеровирусы (Коксаки А, В, ЕСНО), вирус Эбштейна – Барр, цитомегаловирусы.
Повреждение кардиомиоцитов инфекционными агентами может быть прямым, обусловленным инвазией и репликацией возбудителя, вследствие воздействия циркулирующих токсинов, в связи с развитием системных воспалительных реакцией, за счет продукции аутоантигенов, обусловленной воздействием инфекционного агента на клетки иммунной системы.
К неинфекционным факторам, приводящим к возникновению миокардитов, относят некоторые лекарственные препараты—антибиотики и сульфаниламиды, лечебные сыворотки, вакцины, термические и радиохимические воздействия.
В зависимости от патогенетических механизмов развития болезни выделяют:
· инфекционные,
· инфекционно-аллергические (иммунологические)
· токсико-аллергические миокардиты.
По распространенности поражения сердечной мышцы миокардиты подразделяются на:
· очаговые и
· диффузные.
Необходимо отметить, что в клинических условиях диагностировать очаговый миокардит трудно. Поэтому сегодня на смену этой классификации приходит новая. Миокардиты подразделяются в зависимости от тяжести течения на:
· легкие (амбулаторные)
· миокардиты средней степени тяжести
· тяжелые.
По течению и длительности процесса миокардиты подразделяются на:
· острые,
· подострые,
· рецидивирующие,
· хронические,
· латентные.
Миокардиты характеризуются возникновением повреждения (альтерации), развитием экссудативного компонента воспаления с последующей пролиферацией клеточных элементов, восстановлением целостности или фиброзированием ткани в месте повреждения и формированием миокардиосклероза.
Некоторые авторы (М. И. Теодори, 1965) в зависимости от ведущего клинического синдрома заболевания подразделяют миокардиты на:
· болевые;
· аритмические;
· декомпенсационные;
· псевдокоронарные;
· псевдоклапанные;
· смешанные.
Воспалительный процесс в сердечной мышце возникает при участии многих биологически активных веществ, получивших название медиаторов воспаления. К ним относятся: гистамин, серотонин, простагландины, кинины, провоспалительные цитокины. Эти вещества способствуют повреждению миокардиоцитов, нарушению сосудистой проницаемости, микроциркуляции, развитию экссудативных процессов.
Клиническая картина и диагностика.
Клинические проявления миокардитов разнообразны и неспецифичны. К наиболее часто встречающимся симптомам относят:
· боли в области сердца, выявляющиеся практически у всех больных. Боли чаще локализуются в области сердца или его верхушки, могут продолжаться несколько часов, не связаны с физическими и психоэмоциональными нагрузками, не имеют значительной зоны распространения и иррадиации, не купируются нитроглицерином. У небольшого числа больных встречаются боли, напоминающие по характеру стенокардические;
· одышка встречается примерно у 50— 60% больных. Ее выраженность зависит от степени поражения сердечной мышцы. При очаговых миокардитах она не выражена, чаще связана с физической нагрузкой. При диффузных миокардитах одышка беспокоит больных в покое, усиливается в горизонтальном положении тела, при незначительной физической нагрузке;
· нарушения сердечного ритма и проводимости встречаются почти у всех больных миокардитами. Наиболее часто больные жалуются на сердцебиение, обусловленное физической нагрузкой, перебои в работе сердца, ощущение его "остановки", "выпадения". Иногда при тяжелых миокардитах на фоне нарушений ритма и проводимости могут развиться синкопальные состояния;
· отеки наиболее часто развиваются при диффузных (тяжелых) миокардитах, и свидетельствуют о значительных нарушениях сократительной способности миокарда, приводящих к развитию недостаточности кровообращения.
К дополнительным признакам болезни относят:
· снижение работоспособности;
· повышенную потливость;
· субфебрильную температуру.
Высокая лихорадка не характерна для миокардитов и обычно обусловлена инфекцией, на фоне которой возник миокардит, или присоединением каких-либо осложнений.
Данные объективного обследования зависят от выраженности поражения миокарда.
При очаговых (легких) миокардитах внешний вид больных не изменен. При диффузных поражениях отмечаются цианоз, набухание шейных вен, отеки на нижних конечностях, достаточно часто больные принимают вынужденное положение с приподнятым изголовьем и опущенными ногами.
Увеличение размеров сердца при очаговых (легких) миокардитах клинически не определяется. При диффузных (средней тяжести и тяжелых) миокардитах - границы сердца смещены преимущественно влево или в обе стороны. Важно динамическое исследование этого признака. Верхушечный толчок не изменен или смещен влево и вниз, ослаблен, что вызвано снижением мышечного тонуса. Иногда при значительной дилатации полостей сердца может появиться сердечный толчок.
Аускультативная симптоматика проявляется постепенно. На первых этапах развития миокардитов тоны сердца могут быть приглушены, возникает ослабление I тона, обусловленное нарушением его мышечного компонента, достаточно часто встречается расщепление I тона над верхушкой сердца. При снижении сократительной способности миокарда желудочков и предсердий могут появиться патологические Ш и IV тоны, выслушивается ритм галопа. Возникает мышечный систолический шум на верхушке, не имеющий значительной зоны проведения. При развитии диффузных миокардитов возможно формирование относительной недостаточности двух- и трехстворчатого клапанов за счет растяжения фиброзных клапанных колец. В этих случаях аускультативная симптоматика может быть сходна с картиной, наблюдаемой при соответствующих пороках сердца (псевдоклапанные варианты), что приводит к определенным трудностям при постановке диагноза. При развитии недостаточности кровообращения определяются признаки застоя в малом круге кровообращения: одышка, ослабленное дыхание, влажные хрипы в нижних отделах легких. Возникновение застоя в большом круге кровообращения характеризуется появлением отеков, увеличением размеров печени. У некоторых больных с диффузными миокардитами отмечаются тромбоэмболии различных сосудистых областей (тромбоэмболические варианты), достаточно часто они возникают при развитии тяжелых нарушений ритма.
Лабораторная диагностика миокардитов сложна, так как нет специфических изменений, позволяющих верифицировать диагноз.
В зависимости от этиологии миокардита в периферической крови могут определяться лейкоцитоз или лейкопения, палочкоядерный сдвиг влево, эозинофилия, увеличение СОЭ. Выраженность изменений обусловлена характером инфекции, патогенетическим вариантом миокардита. При латентно текущих очаговых миокардитах эти показатели могут быть не нарушены.
Изменения биохимического спектра крови характеризуются появлением и нарастанием уровня СРБ, R - белков при вирусных миокардитах, гиперглобулинемии, преимущественно за счет α-2 и -глобулинов, увеличивается содержания сиаловых кислот, серомукоида, церулоплазмина. У части пациентов отмечается повышение уровня кардиоспецифических ферментов КФК, МВ-КФК, ЛДГ и ЛДГ1, ACT. Увеличенный уровень ферментов сохраняется до 2—3 недель и может быть использован в качестве дифференциально-диагностического признака при псевдокоронарных формах миокардитов. В последние годы ряд исследователей отмечает диагностическую значимость определения повышенных уровней тропонина I при миокардитах. Чувствительность метода составляет 34%, специфичность 89%, положительная диагностическая значимость – 82%.
Выявляются изменения иммунологического статуса: увеличивается соотношение Т-хелперов и Т-супрессоров, уровень иммуноглобулинов. Возможно определение повышенных титров антител к миокардиоцитам, повышение титра вируснейтрализующих антител в 4 и более раз.
Инструментальные методы диагностики. Электрокардиографические изменения, регистрируемые при миокардитах, имеют определенную стадийность. В течение 1— 2 недель заболевания отмечаются снижение амплитуды зубцов желудочкового комплекса и зубца Т, смещение сегмента ST вниз от изолинии на 0,5—1 мм. Через 2—3 недели формируется отрицательный зубец Т, который может постепенно восстановиться или длительный период времени оставаться без изменения. Продолжительность последней стадии зависит от этиологии и варианта течения миокардита. Электрокардиографическое исследование дает возможность выявить нарушения ритма и проводимости: экстрасистолию, мерцательную аритмию, трепетание предсердий, полные или неполные блокады ножек пучка Гиса, атриовентрикулярные блокады различной степени.
Важно проведение суточного мониторирования ЭКГ, которое позволяет определить нарушения ритма и проводимости, не зарегистрированные на ЭКГ покоя.
С помощью рентгенологического исследования можно оценить конфигурацию сердца, размеры отдельных камер, тоническую функцию - обычно отмечается снижение амплитуды пульсации по контуру сердца, наиболее четко определяемое при проведении рентгенокимографии. Кроме оценки состояния сердца, возможно раннее обнаружение признаков застоя в малом круге кровообращения.
Ультразвуковое исследование сердца позволяет получить важную информацию о функциональной способности миокарда и в первую очередь о сократительной способности левого желудочка.
При клинически и лабораторно малосимптомных миокардитах выявление нарушения сократительной способности дает возможность заподозрить поражение миокарда. Для оценки этого показателя измеряют фракцию выброса — отношение ударного объема левого желудочка к его конечному диастолическому объему (норма 55—75%); передне-заднее укорочение, характеризующее отношение диастолического и систолического размеров левого желудочка (норма 30% и более); расстояние от Е-пика движения передней створки митрального клапана до межжелудочковой перегородки (норма не более 5 мм).
Возможна верификация диагноза с помощью эндомиокардиальной биопсии, позволяющей выявить признаки воспалительного процесса в миокардиоцитах. Наиболее признанными морфологическими критериями диагностики миокардита считают Далласские критерии (1984 г.).
| Далласские диагностические критерии для постановки диагноза миокардита по результатам пункционной биопсии (цит. По В.Н.Коваленко, Е.Г.Несукай,2001) | |
| Первичная биопсия | Определенный миокардит |
| Пограничный (вероятный) миокардит | |
| Отсутствие миокардита | |
| Повторные биопсии | Продолжающийся (персистирующий) миокардит |
| Разрешающийся (заживающий) миокардит | |
| Разрешившийся (заживший) миокардит |
Критериями острого миокардита служит выявление воспалительной клеточной инфильтрации миокарда с некрозом и/или дегенерацией кардиомиоцитов, нетипичной для ишемического повреждения.
Пограничный (вероятный) миокардит диагностируется при выявлении клеточной инфильтрации и неповрежденных кардиомиоцитов.
Отсутствие миокардита устанавливается в случаях нормального, неизмененного миокарда или изменениях не воспалительной природы.
Клинические симптомы и лабораторные изменения, выявляемые при миокардитах, не обладают высокой специфичностью, что затрудняет постановку диагноза.
Предлагаемые различными авторами диагностические критерии миокардитов достаточно спорны, так как не учитывают всего разнообразия симптомов и синдромов, встречающихся при этом заболевании.
Диагностические критерии миокардитов (NYHA, 1973)
Большие критерии
· Клинические и лабораторные данные о перенесенной инфекции
· Признаки появившиеся в течение 10 дней после нее
1. Застойная сердечная недостаточность.
2. Кардиогенный шок
3. Полная А-В блокада с синдромом Морганьи-Эдемса-Стокса
4. Патологические изменения на ЭКГ – сегмента ST и зубца T
5. Повышение активности кардиоспецифических ферментов
Малые критерии
· Лабораторное подтверждение перенесенного вирусного заболевания
· Тахикардия
· Ослабление 1 тона
· Ритм галопа
· Результаты эндомиокардиальной биопсии
Диагноз миокардита устанавливается при сочетании анамнестических данных о перенесенной инфекции с двумя большими критериями, или одного большого с двумя малыми.
В клинической практике наиболее часто приходится встречаться с
миокардитами, сопровождающими течение инфекционных заболеваний, и инфекционно-аллергическими миокардитами.
Инфекционно-аллергические миокардиты развиваются через 2—3 недели после острой или обострения хронической инфекции. Клинические признаки многообразны, встречаются почти все симптомы, характерные для миокардитов, лабораторные данные отражают признаки ранее перенесенной инфекции - после перенесенной бактериальной инфекции отмечается лейкоцитоз, после вирусной — лейкопения. Несмотря на обилие симптомов и наличие определенных анамнестических данных, возникают сложности в постановке диагноза, и требуется проведение дифференциальной диагностики с миокардитом при острой ревматической лихорадке, тиреотоксикозом, вегетососудистой дистонией.
При проведении дифференциальной диагностики с миокардитом при острой ревматической лихорадке (ОРЛ) необходимо учитывать следующие признаки:
· связь ОРЛ со стрептококковой носоглоточной инфекцией;
· наличие артрита или артралгий;
· скудность жалоб кардиального характера (признаки поражения сердца чаще выявляются при объективном обследовании больных);
· частое сочетание поражения миокарда и эндокарда;
· четкое соответствие жалоб данным клинического и лабораторного обследований;
· повышение титра противострептококковых антител, не характерное для инфекционно-аллергического миокардита.
· Отсутствие стадийности ЭКГ-изменения при ревматическом миокардите , выявление признаков нарушения АВ проведения.
При проведении дифференциальной диагностики инфекционно-аллергического миокардита и тиреотоксикоза с преимущественно сердечными проявлениями небходимо учитывать следующие данные. Для тиреотоксикоза характерны:
· отсутствие связи заболевания с перенесенными или хроническими инфекциями, значительное снижение массы тела;
· постоянная тахикардия, не реагирующая на противовоспалительную терапию;
· ускорение предсердно-желудочковой проводимости;
· признаки гиперфункции миокарда;
· отсутствие стадийности ЭКГ-изменений ;
· инормализация ЭКГ при проведении фармакологических проб (калиевой, обзидановой).
Достаточно сложно проводить дифференциальную диагностику инфекционно-аллергического миокардита с вегетососудистой дистонией. Для вегетососудистой дистонии характерны:
· отсутствие хронологической связи заболевания с перенесенными инфекциями,
· зависимость проявления признаков заболевания от психоэмоциональных перегрузок,
· наличие большого количества жалоб не только кардиального, но и психосоматического характера,
· отсутствие объективных признаков поражения сердца,
· неизмененные лабораторные показатели,
· сохраненная сократительная способность миокарда.
Особое место среди различных видов воспалительных поражений миокарда занимает идиопатический миокардит Абрамова— Фидлера (гигантоклеточный миокардит). Данная форма заболевания характеризуется тяжелым течением с развитием кардиомегалии и выраженной хронической сердечной недостаточности. Причина возникновения подобного варианта поражения миокарда не выяснена. Обсуждается возможная роль вирусной инфекции и неспецифических аллергических реакций, возникающих как после перенесенной инфекции, так и после приема лекарственных препаратов—лечебных сывороток, вакцин, антибиотиков.
Клиническая картина формируется достаточно быстро. В зависимости от ведущего синдрома М. И. Теодори (1965) выделены следующие варианты течения заболевания:
· асистолический;
· тромбоэмболический;
· аритмический;
· псевдокоронарный;
· смешанные варианты.
Прогноз при идиопатическом миокардите неблагоприятен. Больные погибают быстро, в сроки от 2—3 месяцев до года. Причинами смерти обычно бывают терминальные нарушения ритма, массивные тромбоэмболии, тотальная недостаточность кровообращения.
Значительные сложности возникают в процессе дифференциальной диагностики миокардита Абрамова—Фидлера и дилатационной кардиомиопатии. Для миокардита наряду со значительной дилатацией полостей сердца и недостаточностью кровообращения характерны признаки воспаления, не встречающиеся при дилатационной кардиомиопатии, - лейкоцитоз, эозинофилия, гипер-гамма-глобулинемия, увеличение СОЭ, более острое течение заболевания. Иногда сделать выбор между двумя тяжелыми вариантами поражения миокарда позволяют только данные пункционной биопсии.
Лечение миокардитов
Лечение миокардитов является сложной задачей. До настоящего времени нет единых подходов к выработке общих принципов оказания помощи больным миокардитами. Практически нет результатов многоцентровых, плацебо - контролируемых исследований об эффективности того или иного препарата.
Немедикаментозное лечение включает:
· гипоаллергенную диету. Показаны молочные продукты - кефир, сметана, творог, овощи - морковь, тыква, брюква, фрукты - печенные яблоки, груши, сливы, крупы, мясо - говядина, крольчатина;
· соблюдение двигательного режима – постельного или полупостельного (в зависимости от распространенности и тяжести воспалительного процесса в миокарде).
Основу медикаментозной терапии составляет устранение влияния инфекционного или неинфекционного агента.
Патогенетическое лечение направлено на подавление воспалительных, аутоиммунных, аллергических реакций, образования провоспалительных биологически активных веществ, восстановление и поддержание гемодинамики, воздействие на метаболизм миокарда.
Если установлена связь миокардита с инфекцией и имеются ее признаки, основу лечения составляют антибактериальные препараты, которые назначаются в течение 10—15 дней. Выбор препарата зависит вида диагностированной инфекции.
При отсутствии данных о перенесенной инфекции, хронической очаговой инфекции и достоверных признаках воспаления, аллергических реакций, нарушений иммунитета основу терапии составляют противовоспалительные средства: аминохинолиновые препараты, нестероидные противовоспалительные средства (НПВС), а в тяжелых случаях — глюкокортикоидные гормоны. Однако необходимо еще раз подчеркнуть, что результатов, оценивающих эффективность этих препаратов при лечении миокардитов по данным мета-анализа или многоцентровых исследований нет.
Аминохинолиновые препараты– группа лекарственных средств, оказывающих ряд влияний на патологический процесс. К ним относятся:
· противовоспалительное,
· иммуномодулирующее,
· антиоксидантное,
· антимикробное,
· антипролиферативное,
· антиагрегантное,
· гиполипидемическое
· гипогликемическое
Противовоспалительное и иммуномодулирующее действие связано с нарушением продукции цитокинов и других медиаторов воспаления, подавлением синтеза аутоантител. Кроме этого, стабилизация мембран лизосом приводит к ингибированию высвобождения протеолитических ферментов.
К аминохинолиновым препаратам относятся гидроксихлорохин (плаквенил), хлорохин (делагил). Схемы назначения стандартны. В течение первых недель заболевания суточная доза плаквенила составляет 400 мг в 2 приема, делагила – 500 мг в 2 приема, в последующем переходят на однократный прием препаратов в дозе плаквенила – 200 мг, делагила – 250 мг в сутки.
Побочные эффекты – хлорохиновая ретинопатия (требует консультации окулиста), гастралгии, фотодерматиты, в некоторых случаях – лейкопения.
Нестероидные противовоспалительные средства (НПВС) - большая группа лекарственных препаратов, производных различных химических веществ, объединенных рядом общих характеристик. Эффекты НПВС характеризуются:
· неспецифичностью противовоспалительного действия;
· сочетанием противовоспалительного, жаропонижающего и обезболивающего эффектов;
· блокированием биосинтеза простагландинов, лежащим в основе противовоспалительного действия;
· торможением агрегации тромбоцитов;
· иммуносупрссивным действием.
Наряду с основным механизмом действия, связанным с подавлением образования простагландинов за счет ингибирования каскада арахидоновой кислоты по циклооксигеназному пути в настоящее время выявлены дополнительные механизмы притивовоспалительных и иммуносупрессивных эффектов НПВП. К ним относятся:
· торможене перекисного окисления липидов;
· стабилизация мембран лизосом;
· уменьшение образования АТФ;
· торможение агрегации нейтрофилов;
· троможение продукции РФ;
· нарушение проведения болевых импульсов в спинном мозге
· нарушение образования протеогликанов – структурных компонентов основного вещества соединительной ткани.
По химической структуре выделяют следующие группы НПВС:
1) производные салициловой кислоты — ацетилсалициловая кислота, натрия салицилат, холин-магния трисалицилат, салициламид, бенорилат;
2) производные пиразолона — анальгин, фенилбутазон (бутадион), оксифенбутазон, фенпразон;
3) производные индол - и инденуксусной кислот — индометацин (метиндол, индоцид), сулиндак, толметин (толектин);
4) производные фенилуксусной кислоты — диклофенак (вольтарен, ортофен, диклоберл), алклофенак, фенклофенак;
5) производные пропионовой кислоты — ибупрофен (бруфен), кетопрофен, фенопрофен, флурбипрофен, напроксен (напросин);
6) производные антраниловой кислоты—флуфенамовая кислота (арлеф), мефенамовая кислота (понстан, понсил), толфенамовая кислота (клотан), нифлуминовая кислота (актол);
7) оксикамы — пироксикам, теноксикам.
Противовоспалительное действие НПВС основанное на уменьшении проницаемости капилляров, стабилизации лизосом, торможении выработки макроэргов, синтеза медиаторов воспаления, модификации субстрата воспаления, цитостатическом эффекте, позволяет воздействовать на все фазы воспалительного процесса — альтерацию, экссудацию и пролиферацию. Однако выраженность противовоспалительного, обезболивающего и жаропонижающего действия НПВС неоднозначна.
Для практической работы удобна клиническая классификация НПВС, в соответствии с которой выделяют:
1) препараты, обладающие анальгетическим и слабым противовоспалительным действием, — парацетамол;
2) препараты, обладающие анальгетическим и умеренно выраженным противовоспалительным действием — производные пропионовой кислоты;
3) препараты, обладающие анальгетическим и значительным противовоспалительным действием, — производные салициловой кислоты, пиразолона, индол -, инден- и фенилуксусной кислот, оксикамы.
Ацетилсалициловая кислота широко используется в клинической практике. Суточная доза составляет 2—4 г. В последние годы создано много новых лекарственных форм, уменьшающих раздражающее действие салицилатов на желудок: забуференные, растворимые, имеющие покрытие. Однако, несмотря на определенные меры профилактики, при приеме салицилатов могут возникать побочные действия. При приеме больших доз может развиться салицилизм, проявляющийся звоном в ушах, снижением слуха, головокружением, головной болью, нарушением ориентации. Нарушения со стороны желудочно-кишечного тракта проявляются изжогой, дискомфортом в эпигастрии, рвотой. На слизистой желудка могут появляться эрозии, возможны кровотечения, которые обусловлены как местным повреждающим действием салицилатов на слизистую желудка, так и общим действием препарата на агрегацию тромбоцитов.
Производные пиразолона из-за высокой токсичности и выраженных побочных эффектов применяются ограниченно.
Производные индол- и инденуксусной кислот нашли широкое применение в клинической практике.
Индометацин назначается в суточной дозе 75—100 мг в 2— 3 приема, при использовании свечей суточная доза 100—200 мг назначается 1—2 раза, пролонгированные формы в дозе 75 мг назначаются 1—2 раза в сутки. Препарат рекомендуется назначать в начальной дозе 25—50 мг, постепенно увеличивая ее до терапевтической в течение 2—5 дней. Из побочных действий наиболее часто встречаются признаки поражения желудочно-кишечного тракта, ЦНС — головная боль, головокружение, обморочные состояния, сонливость, нарушение ориентации, ухудшение функции почек, проходящее после отмены индометацина, повышенная чувствительность к препарату, проявляющаяся крапивницей, кожным зудом, отеком Квинке, астматическими приступами, возможны помутнение роговицы, изменение полей зрения.
Сулиндак — инденовое производное индометацина, сходен с ним по механизму действия, но лишен некоторых побочных эффектов, в частности отрицательного влияния на почечный кровоток. Назначается в суточной дозе 100—200 мг 2 раза в день.
Диклофенак (вольтарен, ортофен, диклоберл) — по противовоспалительному действию не уступает индометацину, но побочные явления менее выражены. Выпускается в таблетках, покрытых защитной оболочкой, по 25 мг, капсулах по 100 мг. Назначается в начальной суточной дозе 25— 50 мг, постепенно ее увеличивают до 100—150 мг.
Пироксикам—производное оксикама, по противовоспалительному действию и побочным эффектам близок к индометацину. Применяется в суточной дозе 30 мг в 1—2 приема.
Изучение механизмов противовоспалительного действия НПВС, связанного с блокадой циклооксигеназы (ЦОГ), ключевого фермента каскада арахидоновой кислоты – каскада синтеза простагландинов, являющихся медиаторами воспалительных реакций, открытие изоферментов ЦОГ-1, ЦОГ-2, ЦОГ-3 позволило создать новую классификацию НПВП и по-новому подойти к проблеме побочных эффектов данной группы препаратов. Воздействуя на ЦОГ-1 , НПВП подавляют образование простагландинов в желудке (желудочная цитопротекция), почках (состояние почечного кровотока), тромбоцитах (подавление агрегации тромбоцитов). Подавление активности ЦОГ-2 приводит к развитию противовоспалительных эффектов. Особенности влияния НПС на метаболизм ПГ представлены на рисунке 2.
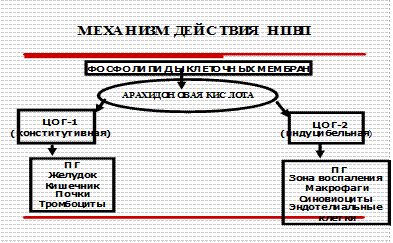
Рис. 2 Простагландинзависимые механизмы действия НПВП
Современная классификация НПВП основана на особенностях действия препарата на изоферменты ЦОГ и включает следующие группы лекарственных средств:
- Селективные ингибиторы ЦОГ-1 – низкие дозы ацетилсалициловой кислоты (75 – 125 мг)
- Классические НПВП – ингибиторы ЦОГ-1 и ЦОГ-2
- Селективные ингибиторы ЦОГ-2 - мелоксикам, нимесулид
- Высокоселективные (специфические) ингибиторы ЦОГ-2 - коксибы: целекоксиб, рофекоксиб, вальдекоксиб, эторикоксиб, лумиракоксиб.
Появление новых групп лекарственных средств, выявление особенностей их действия привело к созданию новых подходов к оценке побочных действий этих препаратов. В настоящее время основные побочные эффекты НПВП можно объединить в несколько групп.
Наиболее частым осложнением классических НПВП и в меньшей степени селективных ингибиторов ЦОГ-2 является НПВП- гастропатия, для которой характерно поражение слизистой оболочки желудочно-кишечного тракта с развитием язв, кровотечений, перфораций. Частота этого осложнения составляет 1 % у пациентов, принимающих препараты в течение 3-6 месяцев, 2-4 % у больных, принимающих препараты в течение года.
К факторам риска развития НПВП – гастропатии относятся:
· Пожилой возраст
· Наличие в анамнезе язвы желудка, желудочно-кишечного кровотечения, мелены
· Длительная терапия НПВП в высоких дозах
· Одновременный прием 2-3 препаратов одной группы.
Клинические особенности НПВП – гастропатии проявляются характерным поражением преимущественно антрального отдела желудка (гиперемия слизистой, кровоизлияния, эрозии, язвы). Среди жалоб больных наиболее часто встречаются тошнота, рвота, диспепсия, изжога, боли в эпигастрии. Достаточно часто клиника отсутствует, и диагноз устанавливается по данным фиброгастродуоденоскопии. Более чем у половины больных первым проявлением могут быть желудочно-кишечные кровотечения.
Относительный риск развития НПВП – гастропатии при приеме классических НПВП представлен в таблице.
| ПРЕПАРАТ | ОТНОСИТЕЛЬНЫЙ РИСК |
| Ибупрофен | 1,0 |
| Аспирин | 1,6 (1,3 – 2,0) |
| Диклофенак | 1,8 (1,4 – 2,3) |
| Индометацин | 2,4 (1,9 – 3,1) |
| Пироксикам | 3,8 (2,7 – 5,2) |
| Кетопрофен | 4,2 (2,7 – 6,4) |
Лечение и профилактика НПВП-гастропатии сводится к следующим положениям. При наличии диспепсии, препаратами выбора являются антагонисты Н-2 рецепторов (ранитидин 150 мг, или фамотидин 20 мг или циметидин 400 мг 2 раза в сутки) или ингибиторы протонной помпы (ланзопразол 30 мг, омепразол 20 мг, пантопразол 40 мг, рабипразол 20 мг внутрь 1 раз в сутки до завтрака). При выявлении H. Pylori, эрадикация инфекции позволяет снизить риск поражения желудочно-кишечного тракта. Эффективность этих вмешательств относится к уровню доказательности рекомендаций В - рекомендации основаны на данных контролируемых нерандомизированных испытаний или на основе исследований с высоким уровнем дизайна, например, когортные исследования.
При активной язве и возможности отмены НПВП внутрь назначаются ингибиторы протонной помпы (ланзопразол 30 мг, омепразол 20 мг, пантопразол 40 мг, рабипразол 20 мг внутрь 1 раз в сутки до завтрака). Уровень доказательности А- рекомендации созданы на основе метаз-анализа рандомизированных контролируемых испытаний или на основе данных одного рандомизированного контролируемого клинического испытания. Возможно применение антагонистов Н-2 рецепторов (уровень доказательности В).
При активной язве и невозможности отмены НПВП и селективных ингибиторов ЦОГ-2 показано применение ингибиторов протонной помпы (ланзопразол 30 мг, омепразол 20 мг, пантопразол 40 мг, рабипразол 20 мг внутрь 1 раз в сутки до завтрака) – уровень доказательности А.
Для профилактики НПВП - гастропатии при наличии факторов риска рекомендуются ингибиторы протонной помпы (ланзопразол 30 мг, омепразол 20 мг, пантопразол 40 мг, рабипразол 20 мг внутрь 1 раз в сутки до завтрака), или мизопростол 600 мг в сутки в три приема, или переход на селективные или высокоселективные ингибиторы ЦОГ-2 (уровень доказательности А).
НПВП могут оказать неблагоприятное влияние на почки в виде поражения интерстиция, уменьшения скорости клубочковой фильтрации, развития папиллярного некроза. Факторами риска развития подобных побочных эффектов со стороны почек являются:
· исходные нарушения функции почек,
· возраст старше 70 лет,
· прием высоких доз НПВП,
· прием диуретиков,
· сопутствующая хроническая сердечная недостаточность.
Наиболее часто почечные поражения вызывает индометацин. Нарушение клубочковой фильтрации и повышение АД отмечается у 1-4% больных, интерстициальный нефрит до 1 %.
Кроме перечисленных выше побочных действий НПВС, выявлено их неблагоприятное влияние на течение беременности и родов. Поэтому при миокардите у беременных женщин эта группа препаратов не применяется.
Длительность назначения НПВС при миокардитах зависит от этиологии, патогенетического варианта, а также характера течения процесса. В последние годы в литературе появилось достаточное количество работ о нецелесообразности назначения НПВП в первые недели развития вирусного поражения миокарда. Использование неспецифической противовоспалительной терапии может приводить к ускорению репликации вируса, увеличению повреждения миокарда. Эти данные привели к тому, что во многих странах НПВП не используются ля лечения миокардитов.
В случае высокой активности воспалительного процесса, наличия признаков
иммунного или аутоиммунного воспаления, при миокардите Абрамова—Фидлера основу противовоспалительной терапии составляют глюкокортикоидные гормоны.
Механизм противовоспалительного и иммуномодулирующего действия глюкокортикоидов достаточно сложен. Препараты обладают:
· стабилизирующим действием на клеточные мембраны и мембраны органелл,
· предотвращают выделение протеолитических ферментов, повреждающих клетки,
· снижают проницаемость капиллярного эндотелия,
· улучшают микроциркуляцию,
· уменьшают экссудацию лейкоцитов и тучных клеток.
· ингибируют биосинтез простагландинов, действуя на уровне фосфолипаз.
Влияние глюкокортикоидов на иммунные реакции происходит различными путями—лимфоцитолиз, ускорение катаболизма иммуноглобулинов, уменьшение образования интерферона, защита клеток от разрушения веществами, образующимися при реакции антиген — антитело (гистамин, серотонин, кинины).
При тяжелых миокардитах назначают преднизолон в дозе 60-80 мг в сутки до достижения клинического и лабораторного эффекта, обычно в течение 7—10 дней, в последующем дозу снижают на 2,5—5 мг (в зависимости от начальной дозы) 1 раз в 5—7 дней.
При назначении преднизолона в высоких дозах побочные действия глюкокортикоидов встречаются чаще. К ним относят:
· синдром Кушинга,
· депрессии и психозы,
· пептические язвы,
· замедление заживления тканей,
· увеличение частоты инфекционных осложнений.
Неясна значимость применения цитостатиков при лечении больных миокардитами. Возможно, результаты проводимых многоценторовых исследований позволят ответить на эти вопросы.
Опубликованы предварительные результаты исследования IMAC (Intervention in Myocarditis and Acute Cardiomyopaty), целью которого было изучение эффективности внутривенного введения иммуноглобулина у пациентов с миокардитами и острыми кардиомиопатиями. Конечной точкой исследования была оценка фракции выброса левого желудочка, изученная с помощью радионуклидного сканирования через 6 и 12 месяцев наблюдения. Исследование проведено в основной и контрольной группах, представленных больными мужского и женского пола в возрасте 43, 0±12,3 года с фракцией выброса менее 40% и длительностью заболевания менее 6 месяцев Основная группа получала иммуноглобулин внутривенно из расчета 2 мг на кг массы тела, контрольная – плацебо. Предварительные результаты позволяют говорить об увеличении фракции выброса в обеих группах больных. Окончательные результаты пока не опубликованы.
Таким образом, литературные данные свидетельствуют об отсутствии единых подходов к лечению данного заболевания. Требуется анализ результатов многоцентровых исследований для выработки единых рекомендаций по тактике лечения при миокардитах.
В настоящее время можно говорить о том, что миокардиты легкого течения не требуют медикаментозной терапии.
При миокардитах средней степени тяжести лечение симптоматическое, и лишь при тяжелых миокардитах, сопровождающихся развитием дилатации полостей сердца, хронической сердечной недостаточности высоких функциональных классов, тяжелыми нарушениями ритма и проводимости показана терапия высокими дозами глюкокортикоидов, или сочетанная терапия глюкокортикоидами и цитостатиками.
Прогноз при миокардитах зависит от варианта течения. При легких миокардитах отмечается выздоровление пациентов. Исходом миокардита средней степени тяжести может быть выздоровление или дилатация полостей сердца вследствие развившегося постмиокардитического кардиосклероза. При тяжелых вариантах течения наиболее часто встречаются летальные исходы и дилатация полостей сердца. Тяжелый миокардит с наличием риска летального исхода, также как и постмиокардитический кардиосклероз с дилатацией полостей сердца и хронической сердечной недостаточностью могут быть показанием для трансплантации сердца.
За пациентами, перенесшими миокардит, необходимо проводить наблюдение в течение первого года после болезни. Основу наблюдения составляют санация очагов инфекции и предупреждение рецидивов заболевания.
Задание:
Больной К., 40 лет, автослесарь, обратился к участковому терапевту с жалобами на ноющую боль в области сердца на протяжении 2 дней, сердцебиение и одышку при физической нагрузке, общую слабость. На зарегистрированной ЭКГ выявлена фибрилляция предсердий, в связи с чем пациент был госпитализирован.
С 35-летнего возраста пациент отмечал кратковременное приступообразное сердцебиение. На протяжении полугода после перенесенного гриппа приступы сердцебиения участились и стали более продолжительными, возникали при обычной физической нагрузке и сопровождались одышкой и общей слабостью. 2 нед назад переболел острым респираторным заболеванием, проявлявшимся ринореей, головной болью и лихорадкой до 38 °С. В течение 2 дней беспокоит постоянная ноющая боль в области сердца, не ослабевающая после приема нитроглицерина, сердцебиение стало постоянным, появились отеки стоп.
При осмотре в момент поступления обнаружены цианоз губ и кончика носа, отек стоп и лодыжек, мелкопузырчатые хрипы в нижнезадних отделах легких, смещение левой границы сердца на 2 см влево, глухость сердечных тонов, тахикардия, пульс аритмичный, 120 в минуту (дефицита пульса нет), АД - 100/60 мм рт.ст., печень на 3 см выступает из-под края реберной дуги, болезненна при пальпации. В анализе крови лейкоцитоз (10,3х109/л), увеличение СОЭ (38 мм/ч), гипергаммаглобулинемия (23 %), СРБ -«+++», гиперфибриногенемия (5,3 г/л), незначительное повышение активности АСТ, АЛТ,КФК.
Общий анализ мочи: относительная плотность - 1,020, белок - следовые количества, глюкоза не обнаружена, лейкоциты -1-2 в поле зрения, эритроциты - 1-2 в поле зрения. На ЭКГ - фибрилляция предсердий, тахисистолическая форма, депрессия сегмента ST и отрицательный зубец Т в отведениях I, aVL, V4-6. Эхокардиография: дилатация желудочков и предсердий, диффузный гипокинез миокарда,
ФВ - 32 %, митральная регургитация II степени. Рентгенологическое исследование органов грудной клетки выявило расширение и малоструктурность корней легких, увеличение размеров сердца, малую амплитуду пульсации сердца.
1. Сформулируйте клинический диагноз.
2. С какими заболеваниями следует проводить дифференциальный диагноз? Составьте план обследования.
3. Каковы морфологические изменения в миокарде при хроническом течении миокардита?
4. Назначьте лечение, обоснуйте свое решение.
5. Каков прогноз заболевания?
Тема № 3 Особые формы стенокардии:
Хотя стабильная стенокардия является наиболее часто встречающимся клиническим синдромом у пациентов с рецидивирующими, стабильными эпизодами ишемии миокарда, существуют и другие важные, особые, хотя и не столь часто встречаемые клинические проявления, которые связаны с периодически возникающими эпизодами ишемии миокарда.
МИКРОВАСКУЛЯРНАЯ СТЕНОКАРДИЯ
Микроваскулярная стенокардия обычно характеризуется:
• приступами стенокардии, преимущественно возникащими при нагрузке и достаточно типична, чтобы предположить наличие ИБС;
• депрессией сегмента ST, похожей на ишемическую, во время ангинозного приступа или при проведении провокационных проб, главным образом, нагрузочного ЭКГ теста (рис. 17.31);
• наличием венечных артерий без атеросклеротических поражений по данным ангиографии;
• исключенным спазмом эпикардиальных венечных артерий и отсутствием известных системных заболеваний или заболеваний сердца, которые могли бы вызывать микроваскулярную дисфункцию коронарного русла.
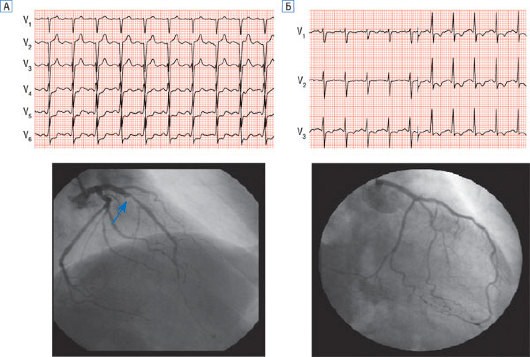
Рис. 17.31. "Ишемический" характер депрессии сегмента ST (около 1,5 мм) в переднебоковых отведениях, вызванной нагрузочной стресс-пробой на тредмиле (по протоколу Брюса) у двух пациентов со стабильной стенокардией напряжения (вверхние рисунки). Морфология и тяжесть депрессии сегмента ST и достигнутая нагрузка (Брюс 2) схожи у обоих больных. Однако у пациента А (нижний рисунок слева) при коронароангиографии выявлена субокклюзия проксимального отдела передней межжелудочковой ветви левой венечной артерии (указано стрелкой), тогда как у больного Б (нижний рисунок справа) обнаружены неизмененные венечные артерии (микроваскулярная стенокардия).
Данная клиническиая картина в медицинской литературе и в клинической практике обычно называется синдромом Х, но в данном тексте будет использоваться термин "микроваскулярная стенокардия" в связи с тем, что появляется все больше доказательств микрососудистой дисфункции и ишемического происхождения стенокардии у такого рода больных.
Распространенность и частота заболеваемости микрососудистой стенокардией плохо изучены. Тем не менее среди пациентов с болями в грудной клетке, подозрительными на транзиторную ишемию миокарда, при выполнении коронарографии в 10-30% случаев выявляются нормальные или малоизмененные венечные артерии без признаков вазоспазма. Хотя у некоторых из пациентов может отсутствовать синдром ишемии миокарда, у большинства из них имеются признаки, характерные для микрососудистой стенокардии. Доля их остается неопределенной.
ПАТОГЕНЕЗ
До сих пор не могут прийти к единому мнению о том, является ли микроваскулярная дисфункция причиной ишемии миокарда и болей в грудной клетке у пациентов со стенокардией и нормальными венечными артериями. По данным многочисленных исследований с использованием различных методов и техник сообщалось о сниженном коронарном резерве у этих больных. В данном процессе могут принимать участие как сниженная сосудорасширяющая функция, эндотелий-зависимая и эндотелий-независимая, так и повышенная вазоконстрикторная активность венечных артерий. Механизмы этого до сих пор неизвестны, но они могут включать патологическую адренергическую активность, резистентность к инсулину, воспалительный процесс, а у женщин недостаток эстрогена.
С другой стороны, существует единогласное мнение о наличии у данной категории больных повышенной болевой чувствительности, которая даже при легкой степени ишемии миокарда может способствовать появлению боли в грудной клетке. Однако остается спорным момент, связано ли повышенное восприятие сердечной боли с общей ноцицептивной патологией, вызванной дефектом коры головного мозга или специфическими изменениями периферических нейронов сердца.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
В большинстве случаев боль в грудной клетке, возникающую при физической нагрузке и исчезающую в покое, невозможно отличить от боли, связанной с микроваскулярной стенокардией, и боли, вызванной обструктивным атеросклеротическим поражением венечных артерий. Однако некоторые свойства ангинозного приступа характерны для микрососудистой стенокардии, в том числе продолжительность приступа после прекращения нагрузки и отсроченное, неполное купирование болей при сублингвальном приеме нитратов.
ДИАГНОЗ
Физикальное обследование, как правило, ничем не примечательно, а при выполнении нагрузочного ЭКГ-теста регистрируются изменения, характерные для обструктивного атеросклеротического поражения венечных сосудов (рис. 17.31). Результаты выполненной нагрузочной перфузионной сцинтиграфии миокарда положительны у половины пациентов. Отсутствие зон нарушенной сократимости миокарда ЛЖ при выполнении стресс-ЭхоКГ (с дипиридамолом, добутамином или физической нагрузкой), несмотря на появление болей в грудной клетке и депрессии сегмента ST, с большой долей вероятности предполагает наличие микроваскулярной стенокардии, так же как и отсутствие эффекта купирования ангинозного приступа при прекращении нагрузки и нормализации сегмента ST после приема нитратов короткого действия.
Необходимо отметить, что оценка состояния микроциркуляторного русла затруднительна у каждого пациента со стенокардией и нормальными венечными артериями при помощи инвазивных или усовершенствованных неинвазивных методов (например, ПЭТ или МРТ) из-за продолжительности и/или чрезмерной стоимости методов диагностики. В этой связи в последнее время была предложена методика оценки коронарного кровотока в ответ на сосудорасширяющую стимуляцию, которую можно было бы измерить при трансторакальной допплерографии передней межжелудочковой ветви (рис. 17.32) или контрастной ЭхоКГ.
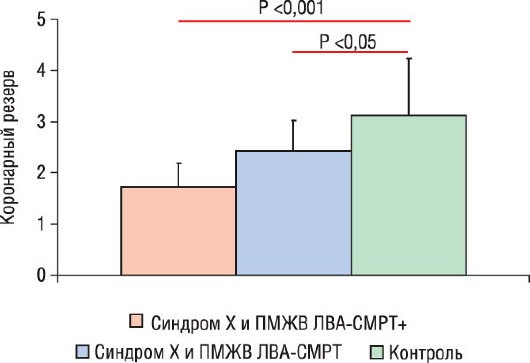
Рис. 17.32. Повышение скорости коронарного кровотока в передней межжелудочковой ветви левой венечной артерии (ПМЖВ ЛВА) в ответ на введение аденозина (140 мг/кг/мин), определенное при трансторакальном допплеровском исследовании у группы пациентов с миокроваскулярной стенокардией с и без обратимых перфузионных дефектов в зоне кровоснабжения передней межжелудочковой ветви левой венечной артерии при МРТ в сосудистом режиме во время нагрузочной пробы с добутамином (МРТ+ и МРТ соответственно). Больные показали более низкую вазодилатирующую реакцию на введение аденозина по сравнению с контрольной группой здоровых лиц, сопоставимых по возрасту и полу. Наименьшая вазодилатация отмечалась среди пациентов со стресс- индуцированными дефектами перфузии при сосудистой МРТ. Подробнее см.
ПРОГНОЗ
Показано, что прогноз при микрососудистой стенокардии благоприятный, так как не отмечалось увеличения риска возникновения серьезных осложнений со стороны сердца. Значительное нарушение сократительной способности ЛЖ было обнаружено при наблюдении в небольшой группе пациентов, у которых появлялась БЛНПГ в покое или в момент нагрузки. Вероятно, у них были латентные формы дилатационной кардиомиопатии. Примечательно, что по данным последних исследований можно предположить: эндотелиальная дисфункция у женщин, страдающих микрососудистой стенокардией, может быть ассоциирована с развитием клинически бессимптомного, но ангиографически документированного поражения венечных артерий.
В последних исследованиях с длительным периодом наблюдений (в среднем 11,6 года) у 155 пациентов с микроваскулярной стенокардией каких-либо серьезных осложнений (смерть, ИМ) не наблюдалось.
Несмотря на благоприятный прогноз, у некоторых пациентов с микроваскулярной стенокардией наблюдаются стойкие проявления и даже ухудшение течения заболевания со временем, возникновение более частых сильных длительных приступов стенокардии, устойчивых к медикаментозному лечению. Симптомы могут ограничивать повседневную активность пациентов и приводить к частому выполнению неинвазивных и даже инвазивных диагностических процедур, а также к госпитализации в стационар или реанимационное отделение. Таким образом, качество жизни у таких больных может сильно страдать, и поэтому микрососудистая стенокардия является социально и экономически значимым заболеванием.
ЛЕЧЕНИЕ
Лечение микрососудистой стенокардии первоначально основано на традиционных антиангинальных препаратах (β-адреноблокаторы, антагонисты кальция и нитраты) в различных комбинациях. У пациентов со стойкими клиническим проявлениями эффективность была показана в небольших исследованиях при добавлении к терапии иАПФ (благодаря их способности ингибировать сосудосуживающий и оксидативный эффекты ангиотензина II), производных ксантина (улучшают перераспределение кровотока в зоне ишемии миокарда), статинов (улучшают функцию эндотелия) и эстрогенов (у женщин в пременопаузе и менопаузе улучшают функцию эндотелия). У пациентов со стенокардией, рефрактерной к медикаментозной терапии, и повышенной болевой чувствительностью можно добавить к терапии имипрамин (ингибирует передачу висцеральной боли). Обнаружено, что электрическая нейромодуляторная стимуляция сокращает количество приступов стенокардии и ее можно рассматривать в качестве терапии таких состояний.
ВАЗОСПАСТИЧЕСКАЯ СТЕНОКАРДИЯ
Вариантная стенокардии впервые описана Принцметалом (Prinzmetal), с коллегами в 1959 г. Название происходит от факта того, что, в отличие от стенокардии напряжения, такая стенокардия возникает в покое и сопровождается подъемом ST-сегмента на ЭКГ.
Начало возникновения приступа вариантной стенокардии может напоминать типичный ОКС в результате возобновления болевых эпизодов в грудной клетке в покое, хотя обычные типичные короткие по продолжительности приступы заставляют заподозрить вазоспастический генез болей. Тем не менее у некоторых пациентов правильный диагноз устанавливается с опозданием, спустя недели или месяцы с момента появления симптомов, когда уже имеется ясная, стабильная, предсказуемая картина их ангинозных болей. Например, в Японии это состояние рассматривается как хроническое заболевание из-за частого сохранения симптомов в течение нескольких месяцев или лет.
На сегодняшний день нет систематических исследований, определяющих эпидемиологическую картину вариантной стенокардии. Но в недавнем исследовании вариантная стенокардия явилась окончательным диагнозом приблизительно у 1,5% пациентов с кратковременными ангинозными атаками. Похожие цифры получены в предыдущем исследовании. Процент встречаемости может быть выше у жителей Японии по сравнению с европейцами.
ПАТОГЕНЕЗ
Ангиографические исследования в 1960-х гг. показали, что вариантная стенокардия имеет уникальный механизм, заключающийся в спазме (до окклюзии/субокклюзии) эпикардиальной артерии, приводящем к кратковременной трансмуральной ишемии (рис. 17.33). Как уже обсуждалось ранее, патогенетические механизмы спазма венечных артерий неизвестны, однако показано, что неспецифическая пострецепторная гиперреактивность гладкомышечных клеток в одном или нескольких сегментах эпикардиальных венечных артерий в ответ на множественные вазоконстрикторные стимулы может быть причиной данного клинического синдрома.
Рис. 17.33. Документальное подтверждение окклюзирующего коронарного вазоспазма обеих ветвей левой венечной артерии (передней межжелудочковой и огибающей; показано стрелками) после внутрикоронарного введения 16 мкг эргоновина пациенту с типичной вариантной стенокардией (наверху слева). Коронарный вазоспазм быстро купирован после

внутрикоронарного введения 2 мг изосорбида динитрата (наверху справа). На ЭКГ - элевация сегмента ST до 2 мм (снизу слева), которая исчезает после введения нитратов (внизу справа).
Коронароангиография показала, что спазм венечной артерии возникает в месте значимого (более 50%) стеноза приблизительно в половине случаев вариантной стенокардии, в то время как у остальных пациентов он происходит в месте неизмененной венечной артерии или незначительного стеноза.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Вариантную стенокардию следует заподозрить у пациентов с ангинозной болью, возникающей исключительно или преимущественно в покое, без каких-либо явных провоцирующих причин. Боль обычно короткая по продолжительности (2-5 мин), иногда с иррадиацией в кисть, часто с типичной суточной периодичностью, с более частыми появлением ранним утром или в ночные часы, быстро купируемая короткодействующие нитратами. Некоторые пациенты отмечают "горячие" и "холодные" симтомные фазы с периодами смягчения и ухудшения симптомов, длящиеся неделями или месяцами. Однако в некоторых случаях симптомы могут присутствовать годами, возобновляясь при отмене терапии. Толерантность к физической нагрузке часто сохранена, в то время как физическая нагрузка вызывает спазм венечных артерий приблизительно у 25% пациентов
У некоторых пациентов могут развиваться тяжелые желудочковые тахиаритмии, связанные с эпизодами ишемии миокарда, вызванной спазмом венечной артерии. У таких пациентов могут возникать обмороки или предобморочные состояния, связанные с ангинозной болью, что является фактором риска ВСС (рис. 17.34). Причины индивидуальной предрасположенности к желудочковым тахиаритмиям плохо известны, нет определенной взаимосвязи с тяжестью ишемии. Тяжелые брадиаритмии (синус-арест, АВ-блокада) также могут появиться, в особенности у пациентов с трансмуральной ишемией нижней стенки. Продолжительный и некупированный окклюзирующий спазм, с другой стороны, может привести к развитию ИМ.
Рис. 17.34. Эпизод полиморфной ЖТ, перерастающей в ФЖ и остановку сердца во время трансмуральной ишемии, возникшей тремя минутами раньше аритмии (прерывающиеся пленки). Данный эпизод был зарегистрирован у больного при длительном ЭКГ- мониторировании с помощью наружного записывающего устройства (loop-recorder) с анамнезом недиагностированных предобморочных состояний. Срочные реанимационные мероприятия, оказанные рядом находившимися людьми, позволили спасти жизнь пациенту, у которого развилась ФЖ через 20 мин после события. Коронароангиография показала нормальные венечные артерии с вазоспазмом, вызванным внутрикоронарным введением эргоновина.
Несмотря на обычно типичную ангинозную картину, вариантная стенокардия часто остается недиагностируемой, имея потенциальный риск развития трансмуральной ишемии. В недавнем исследовании было показано, что, на самом деле, точный клинический диагноз вариантной стенокардии был поставлен в срок до 1 мес с момента появления симптомов лишь менее чем в половине случаев из 202 обследованных пациентов, в то время как у 32% этот срок превысил 3 мес.

ДИАГНОЗ
Клинический диагноз вариантной стенокардии может быть подтвержден зафиксированной элевацией сегмента ST (≥1 мм и до 20-30 мм) на стандартной ЭКГ во время приступа стенокардии (рис. 17.33 и 17.34). Когда трудно записать ЭКГ во время эпизода болей в грудной клетке, вариантная стенокардия может обычно диагностироваться во время 24-48-часового амбулаторного мониторинга ЭКГ, который позволяет также оценить общую ишемическую нагрузку и распределение эпизодов ишемии в течение дня, большинство из которых бессимптомны. ЭКГ-нагрузочный тест может диагностировать вазоспастическую стенокардию у меньшего количества больных, вызывая обратимую элевацию сегмента ST во время нагрузки или в восстановительном периоде.
Примечательно, что нитраты короткого действия перед нагрузочным тестом обычно предотвращают возникновение стенокардии и изменения сегмента ST, особенно у больных без значимой обструкции венечных артерий, тогда как они с трудом устраняют ишемию, связанную с тяжелым стенозированием проксимального отдела венечной артерии.
Около 10% пациентов для подтверждения диагноза спазма венечных артерий необходимо проведение провокационных проб. Провокационные тесты для исключения спазма могут быть выполнены либо неинвазивно, либо во время коронароангиографии, и являются диагностически значимыми, если вызывают симптомы стенокардии с типичной элевацией сегмента ST. Неинвазивные тесты проводятся, главным образом, при в/в введении эргоновина, под тщательным клиническим и ЭКГ-мониторированием. В качестве альтернативы может быть использован проба с гипервентиляцией, хотя она имеет более низкую чувствительность.
Инвазивные пробы, провоцирующие спазм, обычно выполняются путем внутрикоронарного введения эргоновина или ацетилхолина во время ангиографии. Преимущества инвазивных проб заключаются в непосредственной документированной визуализации спазма венечных артерий и в оценке анатомии коронарного русла. Выполнение инвазивных методов оправданно больным, у которых использование системных провокационных проб для выявления спазма венечных артерий связано с повышенным риском возникновения рефрактерного спазма (например, длительный приступ стенокардии, замедленная реакция на прием нитратов короткого действия), так как они позволяют напрямую вводить интракоронарно сосудорасширяющие препараты (нитраты, блокаторы медленных кальциевых каналов). Неинвазивные тесты, с другой стороны, могут воспроизводиться более легко для оценки эффективности приема ЛС и изменений в восприимчивости к спазму при дальнейшем наблюдении.
ПРОГНОЗ
По данным ранних исследований прогноз вариантной стенокардии в основном зависит от наличия многососудистого поражения коронарного русла. Проведенные исследования, однако, показали, что ВСС и остановка сердца, так же как острый ИМ, могут развиваться у больных с нормальными или почти нормальными эпикардиальными артериями. Высокий риск включает в себя многососудистый спазм, тяжелые ишемия-связанные бради- или тахиаритмии, продолжительный спазм, в частности при отсутствии быстрой реакции на нитраты, и, наконец, развитие спазма, рефрактерного к высоким дозам антагонистов кальция.
Важно отметить, что прогноз вариантной стенокардии напрямую зависит от времени постановки диагноза. Действительно, большинство событий происходит в течение нескольких дней или месяцев с момента начала симптомов. Таким образом, своевременная диагностика является обязательной, хотя бы потому, что назначение сосудорасширяющей медикаментозной терапии сможет эффективно предотвратить повторение спазма, уменьшая тем самым риск развития серьезных осложнений и, следовательно, значительно улучшая отдаленный прогноз у таких больных.
ЛЕЧЕНИЕ
Постоянное профилактическое лечение вариантной стенокардии основано на применении блокаторов медленных кальциевых каналов. Обычная средняя доза (например, 240-360 мг/день верапамила или дилтиазема, 60-80 мг/день нифедипина) предупреждает возникновение спазма у 90% больных (рис. 17.35). Нитраты пролонгированного действия (20-40 мг изосорбида динитрата или 10-20 мг изосорбида мононитрата по 2 раза в сутки каждого) могут быть добавлены к терапии некоторым пациентам для повышения эффективности лечения, их следует назначать с учетом времени суток, в которое чаще возникают эпизоды ишемии во избежание привыкания к нитратам. Применение β-адреноблокаторов не показано, и их приема следует избегать, так как они могут провоцировать спазм, в результате блокирования β-рецепторов (β-обусловленная вазодилатация) и оставляя α-реце-пторы свободными (провоцируя α-опосредованную вазоконстрикцию).
Рис. 17.35. Изменения сегмента ST в течение 24-часового 3-канального амбулаторного ЭКГ- мониторирования (отведения CM5-CM3 - модифицированное aVF) у больного с анамнезом загрудинных болей в течение последних 3 мес. Голубые линии указывают на уровень сегмента ST, а зеленые - показывают наклон сегмента ST. А - можно увидеть несколько кратковременных эпизодов (n = 16) подъема сегмента ST, наиболее типично выявляемые в вечерние и ранние утренние часы (красные круги). Б - у того же больного через 3 дня после начала медикаментозной терапии дилтиаземом в дозе 120 мг три раза в день эпизодов подъема сегмента ST зарегистрировано не было.
Примерно в 10% случаев спазм венечных артерий может быть резистентным к стандартной сосудорасширяющей терапии, хотя эта рефрактерность обычно наблюдается лишь в короткий период у большинства пациентов. Использование высоких доз антагонистов кальция и нитратов (т.е. 960 мг/день дилтиазема или 800 мг/день верапамила, каждый из которых комбинируется с 100 мг нифедипина и 80 мг изосорбида динитрата) позволяет контролировать приступы стенокардии в такие периоды. В очень редких случаях, когда лечение оказывается недостаточным, эффективно добавление антиадренергического препарата гуанитидина или клофелина. Возможные эффекты были доказаны при приеме антиоксидантных препаратов и статинов. ЧТА со стентированием спазмирующего участка (даже при отсутствии значимого стеноза) также доказало эффективность своего применения для контроля симптомов и эффективности медикаментозной терапии у таких больных. И наконец, имплантация ИКД или кардиостимулятора показана больным с развитием угрожающих для жизни тахиаритмий или брадиаритмий соответственно, вызванных спазмом, который не поддается или плохо поддается медикаментозной терапии.
БЕЗБОЛЕВАЯ ИШЕМИЯ
Результаты большого числа исследований с использованием ХМ согласуются в том, что большинство (70-80%) эпизодов спонтанной ишемии миокарда протекают бессимптомно, т.е. не сопровождаются приступами стенокардии или их эквивалентами. Более того, безболевая ишемия может очень часто регистрироваться в ходе различных нагрузочных диагностических тестов. Доля безболевых ишемических эпизодов примерно одинакова для различных синдромов коронарной ишемии и не зависит от конкретных причин самой ишемии. Стоит отметить, что, с клинической точки зрения, прогноз болевой и безболевой форм ишемии приблизительно одинаков и в обоих случаях продиктован первичными причинами нарушения кровоснабжения сердечной мышцы.
Причины безболевых ишемических приступов не вполне четко ясны, но принято считать, что в возникновении данного феномена может быть задействовано несколько механизмов. Некоторые источники склонны усматривать связь между возникновением